|
Hidrogen peroksida
Hidrogen peroksida adalah senyawa kimia dengan rumus H2O2. Dalam bentuk murninya, ia berupa cairan bening berwarna biru pucat,[5] sedikit lebih kental daripada air. Hidrogen peroksida adalah peroksida paling sederhana (senyawa dengan ikatan tunggal oksigen–oksigen). H2O2 digunakan sebagai oksidator, zat pemutih, dan antiseptik. Hidrogen peroksida pekat, atau "peroksida uji tinggi", adalah spesies oksigen reaktif dan telah digunakan sebagai propelan roket.[6] Sifat kimianya didominasi oleh ketidakstabilan ikatan peroksidanya. Hidrogen peroksida tidak stabil dan perlahan terurai jika terpapar cahaya. Hidrogen peroksida biasanya disimpan dengan zat penstabil dalam larutan asam lemah dalam botol berwarna gelap, karena ketidakstabilannya. Hidrogen peroksida ditemukan dalam sistem biologis termasuk tubuh manusia. Enzim yang menggunakan atau menguraikan hidrogen peroksida diklasifikasikan sebagai peroksidase. SifatTitik didih H2O2 telah diekstrapolasi menjadi 150,2 °C, sekitar 50 °C lebih tinggi daripada air. Dalam praktiknya, hidrogen peroksida akan mengalami dekomposisi termal yang berpotensi meledak jika dipanaskan pada suhu ini. H2O2 dapat didistilasi dengan aman pada suhu yang lebih rendah di bawah tekanan rendah.[7] StrukturHidrogen peroksida (H2O2) adalah molekul nonplanar dengan simetri C2 (puntir); ini pertama kali ditunjukkan oleh Paul-Antoine Giguère pada tahun 1950 menggunakan spektroskopi inframerah.[8][9] Meskipun ikatan O−O adalah ikatan tunggal, molekul ini memiliki penghalang rotasi relatif besar yaitu 2460 cm−1 (29,45 kJ/mol);[10] sebagai perbandingan, penghalang rotasi etana adalah 12,5 kJ/mol. Peningkatan penghalang dianggap berasal dari tolakan antara pasangan elektron sunyi atom oksigen yang berdekatan dan menghasilkan hidrogen peroksida yang memperlihatkan sifat atropisomerisme. Struktur molekul H2O2 gas dan kristal berbeda secara signifikan. Perbedaan terkait dengan efek ikatan hidrogen, yang tidak ada dalam keadaan gas.[11] Kristal H2O2 adalah tetragonal dengan grup ruang D44P4121.[12] Larutan berairDalam larutan berair, hidrogen peroksida berbeda dari zat murni karena efek ikatan hidrogen antara air dan molekul hidrogen peroksida. Hidrogen peroksida dan air membentuk campuran eutektik, menunjukkan penurunan titik beku hingga -56 °C; air murni memiliki titik beku 0 °C dan hidrogen peroksida murni −0,43 °C. Titik didih dari campuran yang sama juga tertekan sehubungan dengan rata-rata dari kedua titik didih (125,1 °C). Campurannya mendidih pada 114 °C. Titik didih ini 14 °C lebih tinggi daripada air murni dan 36,2 °C lebih rendah daripada hidrogen peroksida murni.[13] 
Perbandingan dengan analogiHidrogen peroksida memiliki beberapa analog struktural dengan pengaturan ikatan Hm−X−X−Hn (air juga ditampilkan sebagai perbandingan). Ini memiliki titik didih tertinggi (teoritis) dari seri ini (X = O, N, S). Titik leburnya juga cukup tinggi, sebanding dengan hidrazin dan air, dengan hanya hidroksilamin yang mengkristal secara signifikan lebih mudah, menunjukkan ikatan hidrogen yang kuat. Difosfan dan hidrogen disulfida hanya menunjukkan ikatan hidrogen yang lemah dan memiliki sedikit kesamaan kimia dengan hidrogen peroksida. Semua analogi ini tidak stabil secara termodinamika. Secara struktural, semua analogi mengadopsi struktur miring yang sama, karena tolakan antara pasangan bebas yang berdekatan.
PenemuanAlexander von Humboldt melaporkan salah satu peroksida sintetis pertama, barium peroksida, pada tahun 1799 sebagai produk samping dari percobaannya mendekomposisi udara. Sembilan belas tahun kemudian, Louis Jacques Thénard menyadari bahwa senyawa ini dapat digunakan untuk preparasi senyawa yang sebelumnya tidak diketahui, yang disebutnya sebagai eau oxygénée (bahasa Prancis: air beroksigen) – yang kemudian dikenal sebagai hidrogen peroksida.[14][15][16] Saat ini istilah air beroksigen merujuk pada air yang mengandung oksigen terlarut (O2). Proses Thénard dikembangkan menggunakan asam klorida, diikuti dengan penambahan asam sulfat untuk mengendapkan produk samping barium sulfat. Proses ini digunakan dari akhir abad ke-19 hingga pertengahan abad ke-20.[17] Thénard dan Joseph Louis Gay-Lussac mensintesis natrium peroksida pada tahun 1811. Efek pemutihan (bleaching) peroksida dan garamnya terhadap pewarna alami diketahui saat itu, tetapi upaya awal produksi peroksida skala industri gagal. Pabrik pertama yang memproduksi hidrogen peroksida dibangun pada tahun 1873 di Berlin. Penemuan sintesis hidrogen peroksida dengan elektrolisis menggunakan asam sulfat memperkenalkan metode elektrokimia yang lebih efisien. Metode ini pertama kali dikomersialkan pada tahun 1908 di Weißenstein, Carinthia, Austria. Proses antrakuinon, yang masih digunakan, dikembangkan selama tahun 1930an oleh pabrikan kimia Jerman IG Farben di Ludwigshafen. Meningkatnya permintaan dan peningkatan dalam metode sintesis menghasilkan peningkatan produksi tahunan hidrogen peroksida dari 35.000 ton pada tahun 1950, menjadi lebih dari 100.000 ton pada tahun 1960, menjadi 300.000 ton pada tahun 1970; dan pada tahun 1998 telah mencapai 2,7 juta ton.[18] Hidrogen peroksida murni sejak lama diyakini tidak stabil, karena upaya awal untuk memisahkannya dari air, yang bercampur selama sintesis, semuanya gagal. Ketidakstabilan ini disebabkan oleh ketakmurnian renik (garam logam transisi), yang mengkatalisis dekomposisi hidrogen peroksida. Hidrogen peroksida murni pertama kali diperoleh pada 1894—hampir 80 tahun setelah penemuannya—oleh Richard Wolffenstein, yang membuatnya dengan distilasi vakum.[19] Penentuan struktur molekul hidrogen peroksida terbukti sangat sulit. Pada tahun 1892 ahli kimia fisik Italia Giacomo Carrara (1864–1925) menentukan massa molekulnya dengan penurunan titik beku, yang menegaskan bahwa rumus molekulnya adalah H2O2.[20] Sedikitnya enam struktur molekul hipotetis tampak konsisten dengan bukti yang ada.[21] Pada tahun 1934, ahli fisika matematika Inggris William Penney dan ahli fisika Skotlandia Gordon Sutherland mengusulkan struktur molekul hidrogen peroksida yang sangat mirip dengan yang diterima saat ini.[22] Sebelumnya, hidrogen peroksida dibuat secara industri dengan hidrolisis amonium persulfat, yang diperoleh dari elektrolisis larutan amonium bisulfat (NH4HSO4) dalam asam sulfat: Produksi Saat ini, hidrogen peroksida diproduksi hampir secara eksklusif menggunakan proses antrakuinon, yang diresmikan pada tahun 1936 dan dipatenkan pada tahun 1939. Dimulai dengan reduksi antrakuinon (seperti 2-etilantrakuinon atau turunan 2-amil) pada antrahidrokuinon yang sesuai, biasanya melalui hidrogenasi dengan katalis paladium. Dengan adanya oksigen, antrahidrokuinon kemudian mengalami autoksidasi: atom hidrogen yang labil dari gugus hidroksi dipindahkan ke molekul oksigen, menghasilkan hidrogen peroksida dan meregenerasi antrakuinon. Sebagian besar proses komersial mencapai oksidasi dengan menggelembungkan udara tekan melalui larutan antrahidrokuinon, kemudian hidrogen peroksida diekstraksi dari larutan dan antrakuinon didaur ulang kembali untuk siklus hidrogenasi dan oksidasi selanjutnya.[23][24] Reaksi bersih proses yang dikatalisis antrakuinon adalah:[23] Keekonomian proses sangat bergantung pada daur ulang yang efektif atas pelarut ekstraksi, katalis hidrogenasi dan kuinon yang mahal.   Sumber lainBeberapa metode dapat mendeteksi jumlah hidrogen peroksida yang kecil. Pada saat elektrolisis asam encer, H2O2 terbentuk sedikit di sekitar katode tempat munculnya hidrogen, jika diberi gelembung oksigen di sekitarnya. H2O2 juga diproduksi dengan memberi paparan sinar ultraviolet dari lampu merkuri, sinar matahari, atau busur listrik kepada air yang ditampung dalam wadah transparan UV (mis. kuarsa). Ia dapat dideteksi dalam air es setelah membakar aliran gas hidrogen yang ditujukan ke arahnya dan juga terdeteksi pada es mengambang. Pendinginan udara lembab dengan cepat melalui celah percikan sekitar 2000 °C menghasilkan jumlah yang dapat dideteksi.[25] Proses yang secara komersial layak menghasilkan hidrogen peroksida langsung dari unsur-unsurnya telah menjadi daya tarik selama bertahun-tahun. Sintesis langsung yang efisien sulit untuk dicapai, karena reaksi hidrogen dengan oksigen secara termodinamika mendukung produksi air. Telah dikembangkan sistem untuk sintesis, yang sebagian besar menggunakan katalis logam terdispersi halus, mirip dengan yang digunakan untuk hidrogenasi substrat organik.[26][27] Tak ada satu pun yang telah mencapai titik untuk dapat digunakan dalam sintesis berskala industri. KetersediaanHidrogen peroksida paling banyak tersedia sebagai larutan dalam air. Untuk konsumen, biasanya tersedia di apotek dengan konsentrasi 3% dan 6% berat. Konsentrasi kadang-kadang dijelaskan sebagai volume gas oksigen yang dihasilkan; satu mililiter dari larutan 20 volume menghasilkan dua puluh mililiter gas oksigen ketika benar-benar terurai. Untuk penggunaan laboratorium, larutan dengan konsentrasi 30% berat adalah yang paling umum. Tersedia juga konsentrasi 70% hingga 98% berderajat kemurnian komersial, tetapi karena larutan H2O2 dengan konsentrasi lebih dari 68% akan berpotensi berubah seluruhnya menjadi uap dan oksigen (terjadi peningkatan suhu uap dengan peningkatan konsentrasi di atas 68%), nilai ini berpotensi jauh lebih berbahaya dan memerlukan penanganan khusus di area penyimpanan khusus. Pembeli biasanya harus mengizinkan inspeksi oleh produsen komersial. Pada tahun 1994, produksi dunia H2O2 adalah sekitar 1,9 juta ton dan tumbuh menjadi 2,2 juta pada tahun 2006,[28] yang sebagian besar berada pada konsentrasi 70% atau kurang. Pada tahun itu, 30% H2O2 terjual di pasaran dengan harga sekitar 0,54 USD/kg, setara dengan US$1,50/kg (US$0,68/lb) dengan basis "100%".[29] Hidrogen peroksida terjadi di air permukaan, air tanah dan di atmosfer. Ia terbentuk setelah iluminasi atau aksi katalitik alami oleh zat yang terkandung dalam air. Air laut mengandung 0,5 hingga 14 μg/L hidrogen peroksida, air tawar 1 hingga 30 μg/L dan udara 0,1 hingga 1 bagian per miliar.[18] ReaksiDekomposisi
Hidrogen peroksida tidak stabil secara termodinamika dan terurai menjadi air dan oksigen dengan ΔH Laju dekomposisi meningkat dengan meningkatnya suhu, konsentrasi, dan pH. Stabilitas terbaik ditunjukkan dengan dengan larutan encer asam yang dingin. Dekomposisi dikatalisis oleh berbagai senyawa, termasuk sebagian besar logam transisi dan senyawanya (mis. mangan dioksida (MnO2), perak, dan platinum).[31] Ion logam tertentu, seperti Fe2+ atau Ti3+, dapat menyebabkan dekomposisi terjadi melalui jalur yang berbeda, disertai pembentukan radikal bebas seperti radikal hidroksil (HO·) dan hidroperoksil (HOO·). Katalis non-logam termasuk kalium iodida, bereaksi sangat cepat dan membentuk dasar dari demonstrasi pasta gigi gajah. Hidrogen peroksida juga dapat didekomposisi secara biologis oleh enzim katalase. Dekomposisi hidrogen peroksida membebaskan oksigen dan panas; ini bisa berbahaya, karena menumpahkan hidrogen peroksida konsentrasi tinggi pada bahan yang mudah terbakar dapat memicu kebakaran. Reaksi redoksSifat redoks hidrogen peroksida bergantung pada pH. Dalam larutan asam, H2O2 adalah oksidator kuat, lebih kuat daripada klorin, klorin dioksida, dan kalium permanganat. Ketika digunakan untuk membersihkan peralatan gelas laboratorium, larutan hidrogen peroksida dan asam sulfat disebut sebagai larutan Piranha. H2O2 adalah sumber radikal hidroksil (·OH), yang sangat reaktif. H2O2 digunakan dalam reaksi osilasi Briggs-Rauscher[32][33] dan Bray-Liebhafsky[34][35] yang spektakuler.
Dalam larutan asam Fe2+ dioksidasi menjadi Fe3+ (hidrogen peroksida bertindak sebagai oksidator): dan sulfit (SO2−3) dioksidasi menjadi sulfat (SO2−4). Namun, kalium permanganat direduksi menjadi Mn2+ oleh H2O2 asam. Pada kondisi basa, beberapa reaksi ini terbalik; misalnya, Mn2+ dioksidasi menjadi Mn4+ (sebagai MnO2). Dalam larutan basa, hidrogen peroksida dapat mereduksi berbagai ion anorganik. Ketika bertindak sebagai reduktor, gas oksigen juga dihasilkan. Misalnya, hidrogen peroksida akan mereduksi natrium hipoklorit dan kalium permanganat, yang merupakan metode praktis untuk menyiapkan oksigen di laboratorium: Reaksi organikHidrogen peroksida sering digunakan sebagai oksidator. Contohnya adalah oksidasi tioeter menjadi sulfoksida:[36][37] Hidrogen peroksida alkalis digunakan untuk epoksidasi alkena yang kekurangan elektron seperti turunan asam akrilat,[38] dan untuk oksidasi alkilboran menjadi alkohol, langkah kedua dari hidroborasi-oksidasi. Ini juga merupakan pereaksi utama dalam proses oksidasi Dakin. Prekursor untuk senyawa peroksida lainnyaHidrogen peroksida adalah asam lemah, membentuk garam hidroperoksida atau peroksida dengan kebanyakan logam. Ia juga mengubah oksida logam menjadi peroksida yang sesuai. Misalnya, setelah perlakuan dengan hidrogen peroksida, asam kromat (CrO3 + H2SO4) membentuk peroksida biru yang tidak stabil CrO(O2)2. Reaksi semacam ini digunakan secara industri untuk menghasilkan peroksoanion. Misalnya, reaksi dengan boraks menghasilkan natrium perborat, pemutih yang digunakan dalam deterjen: H2O2 mengubah asam karboksilat (RCO2H) menjadi asam peroksi (RC(O)O2H), yang dengan sendirinya digunakan sebagai Oksidator. Hidrogen peroksida bereaksi dengan aseton membentuk aseton peroksida dan dengan ozon membentuk trioksidana. Hidrogen peroksida membentuk aduk (bahasa Inggris: adduct) yang stabil dengan urea (Hidrogen peroksida - urea), natrium karbonat (natrium perkarbonat) dan senyawa lainnya.[39] Aduk asam-basa dengan trifenilfosfin oksida adalah "pembawa" yang berguna untuk H2O2 dalam beberapa reaksi. Hidrogen peroksida adalah oksidator dan sekaligus reduktor. Oksidasi hidrogen peroksida oleh natrium hipoklorit menghasilkan oksigen singlet. Reaksi bersih ion besi(III) dengan hidrogen peroksida adalah ion besi(II) dan oksigen. Proses ini berlangsung melalui oksidasi elektron tunggal dan radikal hidroksil, dan digunakan dalam beberapa oksidasi kimia organik, mis. dalam pereaksi Fenton. Hanya sedikit ion besi yang diperlukan karena peroksida juga mengoksidasi besi(II) menjadi ion besi(III). Reaksi bersih hidrogen peroksida dan permanganat atau mangan dioksida adalah ion mangan; namun, sampai peroksida habis, beberapa ion mangan dioksidasi ulang untuk membuat reaksi menjadi katalitik. Ini membentuk dasar untuk monopropelan roket. Fungsi biologis Hidrogen peroksida terbentuk dalam tubuh manusia dan hewan lainnya sebagai produk jangka pendek dalam proses biokimia dan bersifat toksik untuk sel. Toksisitasnya karena ia mengoksidasi protein, lipida membran dan DNA dengan ion peroksidanya.[40] Kelompok enzim biologis yang disebut superoksida dismutase (SOD) terbentuk di hampir semua sel hidup sebagai antioksidan penting. Mereka memicu disproporsionasi superoksida menjadi oksigen dan hidrogen peroksida, yang kemudian didekomposisi dengan cepat oleh enzim katalase menjadi oksigen dan air.[41] Peroksisom adalah organel yang ditemukan di hampir semua sel eukariotik.[42] Mereka terlibat dalam katabolisme asam lemak rantai sangat panjang, asam lemak rantai bercabang, asam D-amino, poliamina, dan biosintesis plasmalogen, eterfosfolipid penting untuk fungsi normal otak dan paru-paru mamalia.[43] Setelah oksidasi, mereka menghasilkan hidrogen peroksida dalam proses berikut:[44] Katalase, enzim peroksisomal lain, menggunakan H2O2 ini untuk mengoksidasi substrat lain, termasuk fenol, asam format, formaldehida, dan alkohol, melalui reaksi peroksidasi:
Reaksi ini penting dalam sel hati dan ginjal, di mana peroksisom menetralkan berbagai zat beracun yang masuk ke dalam darah. Beberapa etanol minuman dioksidasi menjadi asetaldehida dengan cara ini.[45] Selain itu, ketika kelebihan H2O2 terakumulasi dalam sel, katalase mengubahnya menjadi H2O melalui reaksi berikut: Sumber hidrogen peroksida lainnya adalah degradasi adenosin monofosfat yang menghasilkan hipoxantin. Hipoxantin kemudian dikatabolisis oksidatif terlebih dahulu menjadi xantin dan kemudian menjadi asam urat. Reaksi ini dikatalisis oleh enzim xantin oksidase:[46] Degradasi hipoxantina melalui xantin hingga asam urat untuk membentuk hidrogen peroksida.  Degradasi guanosin monofosfat menghasilkan xantina sebagai produk antara yang kemudian diubah dengan cara yang sama menjadi asam urat disertai pembentukan hidrogen peroksida.[46] Telur landak laut, segera setelelah difertilisasi oleh sperma, menghasilkan hidrogen peroksida. Ia kemudian dengan cepat terdisosiasi menjadi radikal OH·. Radikal ini bertindak sebagai inisiator proses polimerisasi radikal, yang mengelilingi telur dengan lapisan pelindung polimer.[47] Kumbang bombardier memiliki alat yang memungkinkan untuk menembakkan gelembung yang korosif dan berbau tak sedap ke musuh-musuhnya. Kumbang ini menghasilakn dan menyimpan hidrokuinon dan hidrogen peroksida, dalam dua reservoir terpisah di ujung belakang abdomennya. Ketika merasa terancam, otot-ototnya bekontraksi yang memaksa kedua pereaksi melewati katup tabung menuju bejana pencampur yang berisi air dan campuran enzim katalitik. Ketika bercampur, pereaksi mengalami reaksi kimia eksotermik yang hebat, menaikkan suhu mendekati titik didih air. Cairan yang mendidih dan berbau busuk tersebut perlahan-lahan menjadi gas (penguapan parsial) dan keluar melalui katup pengeluaran dengan suara kencang.[48][49][50] Hidrogen peroksida adalah molekul pensinyalan pada tumbuhan untuk menangkal patogen.[51] Hidrogen peroksida memiliki peran sebagai molekul pensinyalan dalam pengaturan berbagai proses biologis.[52] Senyawa ini merupakan faktor utama yang terlibat dalam teori radikal-bebas pada penuaan, berdasarkan pada kemudahan hidrogen peroksida untuk terurai menjadi radikal hidroksil dan cara radikal superoksida, produk samping dari metabolisme seluler, dapat bereaksi dengan air sekitar untuk membentuk hidrogen peroksida.[53] Radikal hidroksil ini pada gilirannya bereaksi dengan cepat dan merusak komponen sel vital, terutama mitokondria.[54][55][56] Setidaknya satu penelitian juga mencoba mengaitkan produksi hidrogen peroksida dengan kanker.[57] Jumlah hidrogen peroksida dalam sistem biologis dapat diuji menggunakan uji fluorometrik.[58] PenggunaanPemutihSekitar 60% dari produksi hidrogen peroksida dunia digunakan sebagai pemutih untuk bubur kertas dan kertas.[28] DeterjenAplikasi industri kedua terbesar adalah pembuatan natrium perkarbonat dan natrium perborat, yang digunakan sebagai pemutih lunak dalam deterjen. Natrium perkarbonat, yang merupakan aduk dari natrium karbonat dan hidrogen peroksida, adalah bahan aktif dalam produk deterjen binatu seperti OxiClean dan Tide deterjen. Ketika dilarutkan dalam air, ia melepaskan hidrogen peroksida dan natrium karbonat,[59] Dengan sendirinya, zat pemutih in hanya efektif pada suhu pencucian 60 °C (140 °F) atau lebih tinggi, sehingga sering kali digunakan secara bersamaan dengan aktivator pemutih (bahasa Inggris: bleach activator), yang memfasilitasi pembersihan pada suhu yang lebih rendah. Produksi senyawa organikHidrogen peroksida digunakan dalam produksi berbagai peroksida organik, misalnya dibenzoil peroksida. Ia digunakan dalam polimerisasi, sebagai serbuk pemutih, dan sebagai perawatan jerawat. Asam peroksi, seperti asam perasetat dan asam meta-kloroperoksibenzoat juga dibuat menggunakan hidrogen peroksida. Hidrogen peroksida telah digunakan untuk membuat bahan peledak berbasis peroksida organik, seperti aseaton peroksida. Disinfektan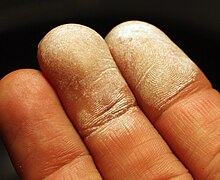  Hidrogen peroksida digunakan dalam proses pengolahan air limbah tertentu untuk menghilangkan ketakmurnian organik. Dalam proses oksidasi lanjutan, reaksi Fenton[60][61] menghasilkan radikal hidroksil (·OH) yang sangat reaktif. Ini mendegradasi senyawa-senyawa organik, termasuk mereka yang biasanya kuat, seperti aromatik atau senyawa terhalogenasi.[62] Ia juga bisa mengoksidasi senyawa berbasis belerang yang ada dalam limbah; yang otomatis memiliki keuntungan mengurangi baunya.[63] Hidrogen peroksida dapat digunakan untuk sterilisasi bermacam permukaan,[64] termasuk peralatan bedah,[65] dan dapat dibuat sebagai uap (VHP) untuk sterilisasi ruangan.[66] H2O2 menunjukkan spektrum efikasi yang luas terhadap virus, bakteri, jamur, dan spora bakteri.[67] Secara umum, aktivitas yang lebih besar tampak terhadap bakteri gram-positif daripada gram-negatif. Meski demikian, adanya katalase atau peroksidase lainnya dalam organisme ini dapat meningkatkan toleransi terhadap konsentrasi H2O2 yang lebih rendah.[68] Konsentrasi H2O2 yang lebih tinggi (10 sampai 30%) dan waktu kontak yang lebih lama diperlukan untuk aktivitas antispora.[69] Hidrogen peroksida merupakan pemutih yang lebih ramah lingkungan dibandingkan pemutih berbasis klorin, karena H2O2 terdegradasi menjadi oksigen dan air dan umumnya diakui aman sebagai antimikroba oleh Badan Pengawas Obat dan Makanan Amerika Serikat (FDA).[70] Hidrogen peroksida dapat digunakan untuk mengobati jerawat,[71] meskipun benzoil peroksida adalah pengobatan yang lebih umum. Gimik dan penggunaan ceruk Hidrogen peroksida memiliki beragam enggunaan domestik, terutama sebagai zat pembersih dan disinfektan.
H2O2 encer (antara 1,9% dan 12%) yang dicampur dengan larutan amonia telah digunakan untuk memutihkan rambut. Sifatnya yang dapat memutihkan menimbulkan istilah "pirang peroksida (bahasa Inggris: peroxide blonde)".[72] Hidrogen peroksida juga digunakan untuk pemutih gigi. Ia banyak dijumpai dalam sebagian besar pasta gigi pemutih. Hidrogen peroksida menunjukkan hasil positif dalam mencerahkan gigi. Cara kerjanya adalah, dengan mengoksidasi pigmen berwarna pada enamel, sehingga bayangan gigi menjadi lebih cerah. Hidrogen peroksida dapat dicampur dengan soda kue dan garam untuk membuat pasta gigi rumahan.[73]
 H2O2 konsentrasi tinggi disebut sebagai "peroksida uji tinggi" (high-test peroxide, HTP). Ia dapat digunakan sebagai monopropelan (tidak dicampur dengan bahan bakar) atau sebagai komponen oksidator dalam bipropelan roket. Penggunaan sebagai monopropelan memiliki keuntungan karena 70–98% konsentrasi hidrogen peroksida terdekomposisi menjadi uap dan oksigen. Propelan ini dipompa menuju bejana reaksi, di mana katalis, biasanya lembaran perak atau platina, memicu dekomposisi, menghasilkan uap pada suhu lebih dari 600 °C (1.112 °F), yang dibuan melalui nosel, menghasilkan daya dorong (thrust). Monopropelan H2O2 menghasilkan impuls spesifik (Isp) maksimal sebesar 161 s (1,6 kN·s/kg). Peroksida adalah monopropelan utama pertama yang diadopsi untuk digunakan dalam aplikasi roket. Hidrazina akhirnya digunakan untuk menggantikan monopropelan hidrogen peroksida untuk aplikasi pendorong karena dapat menaikkan impuls spesifik vakum sebesar 25%.[74] Hidrazina (toksik) dan hidrogen peroksida (kurang toksik [masing-masing ACGIH TLV 0,01 dan 1 ppm]) adalah daua monopropelan (selain gas dingin) yang telah banyak diadopsi dan diutilisasi untuk aplikasi propulsi dan tenaga. Sabuk roket Bell, sistem kendali reaksi untuk X-1, X-15, Centaur, Mercury, Little Joe, dan juga generator gas pompa turbo untuk X-1, X-15, Jupiter, Redstone dan Viking menggunakan hidrogen peroksida sebagai monopropelan.[75] Sebagai bipropelan, H2O2 didekomposisi untuk membakar bahan bakar sebagai oksidator. Impuls spesifik setinggi 350 s (3,5 kN·s/kg) dapat dicapai, tergantung bahan bakarnya. Peroksida yang digunakan sebagai oksidator memberikan Isp yang agak lebih rendah daripada oksigen cair, tetapi padat, dapat disimpan, nonkriogenik dan dapat lebih mudah digunakan untuk menggerakkan turbin gas untuk memberikan tekanan tinggi menggunakan siklus tertutup yang efisien. Ia juga dapat digunakan untuk pendinginan regeneratif mesin roket. Pada 1940-an dan 1950-an, turbin Hellmuth Walter KG menggunakan hidrogen peroksida untuk digunakan dalam kapal selam saat menyelam; ternyata terlalu berisik dan membutuhkan terlalu banyak perawatan dibandingkan dengan sistem tenaga diesel-listrik. Beberapa torpedo menggunakan hidrogen peroksida sebagai oksidator atau propelan. Kesalahan operator dalam penggunaan torpedo hidrogen peroksida disebut sebagai kemungkinan penyebab tenggelamnya HMS Sidon dan kapal selam Rusia Kursk.[76] SAAB Underwater Systems memproduksi Torpedo 2000. Torpedo ini, yang digunakan oleh Angkatan Laut Swedia, bertenaga mesin piston yang digerakkan oleh HTP sebagai oksidator dan minyak tanah sebagai bahan bakar dalam sistem bipropellant.[77][78]
Hidrogen peroksida bereaksi dengan di-ester tertentu, seperti ester fenil oksalat (sialuma), menghasilkan kemiluminesensi; aplikasi ini yang paling umum dijumpai dalam bentuk tongkat pendar (bahasa Inggris: glow stick).
Beberapa hortikulturawan dan penggiat hidroponik menyarankan menggunakan larutan hidrogen peroksida lemah untuk pengairan. Larutan ini terdekomposisi secara spontan dengan membebaskan oksigen yang meningkatkan perkembangan akar tanaman dan membantu mengobati busuk akar (kematian sel akar akibat kekurangan oksigen) dan beragam hama lainnya.[79][80] Some horticulturalists and users of hydroponics advocate the use of weak hydrogen peroxide solution in watering solutions. Its spontaneous decomposition releases oxygen that enhances a plant's root development and helps to treat root rot (cellular root death due to lack of oxygen) and a variety of other pests.
Hidrogen peroksida digunakan dalam akuakultur untuk mengendalikan kematian akibat berbagai mikrob. Pada tahun 2019, FDA menyetujui untuk mengendalikan Saprolegniasis dalam seluruh ikan laut, untuk mengendalikan penyakit columnaris eksternal pada ikan laut air hangat, dan untuk mengendalikan Gyrodactylus spp. dalam salmonida air tawar.[81] Uji laboratorium yang dilakukan oleh peternak ikan menunjukkan bahwa hidrogen peroksida rumah tangga biasa dapat digunakan dengan aman untuk menghasilkan oksigen bagi ikan kecil. Hidrogen peroksida membebaskan oksigen melalui proses dekomposisi ketika terpapar katalis seperti mangan dioksida. KeselamatanPeraturannya beragam, tetapi konsentrasi rendah, seperti 6%, tersedia secara luas dan legal untuk diperjualbelikan bagi penggunaan medis. Sebagian besar larutan peroksida yang dijual bebas tidak cocok untuk dikonsumsi. Konsentrasi yang lebih tinggi dapat dianggap berbahaya dan biasanya disertai dengan lembar data keselamatan (SDS). Dalam konsentrasi tinggi, hidrogen peroksida adalah oksidator yang agresif dan akan menimbulkan korosi pada banyak bahan, termasuk kulit manusia. H2O2 berkonsentrasi tinggi akan bereaksi hebat dengan reduktor.[82] Aliran hidrogen peroksida konsentrasi tinggi, biasanya di atas 40%, harus dianggap berbahaya karena hidrogen peroksida pekat memenuhi definisi oksidator DOT menurut peraturan A.S., jika dilepaskan ke lingkungan. EPA Reportable Quantity (RQ) untuk limbah berbahaya D001 adalah 45 kilogram (99 pon), atau sekitar 38 liter (10 US gal), hidrogen peroksida pekat. Hidrogen peroksida harus disimpan di tempat yang sejuk, kering, berventilasi baik dan jauh dari zat yang mudah terbakar. Ia harus disimpan dalam wadah yang terbuat dari bahan non-reaktif seperti baja nirkarat atau kaca (bahan lain termasuk beberapa plastik dan paduan aluminium juga mungkin cocok).[83] H2O2 harus disimpan dalam wadah tak tembus cahaya, dan formulasi farmasi berada dalam botol coklat yang tidak tembus cahaya, karena senyawa ini cepat rusak ketika terkena cahaya.[84] Hidrogen peroksida, baik dalam bentuk murni atau encer, dapat menimbulkan beberapa risiko, utamanya adalah bahwa ia membentuk campuran eksplosif ketika kontak dengan senyawa organik.[85] Hidrogen peroksida yang sangat pekat tidak stabil dan dapat menyebabkan ledakan akibat peningkatan uap dari cairan yang tersisa. Akibatnya, distilasi hidrogen peroksida pada tekanan normal sangat berbahaya. Ia juga bersifat korosif, terutama dalam bentuk pekatnya, tetapi bahkan larutan H2O2 rumah tangga pun dapat mengiritasi mata, selaput lendir, dan kulit.[86] Menelan larutan hidrogen peroksida sangat berbahaya, karena terdekomposisi dalam lambung dan melepaskan sejumlah besar gas (sepuluh kali volume larutan 3%), yang menyebabkan kembung internal. Menghirup H2O2 dengan konsentrasi lebih dari 10% dapat menyebabkan iritasi paru yang parah.[87] Dengan tekanan uap yang signifikan (1,2 kPa pada 50 °C[88]), uap hidrogen peroksida berpotensi bahaya. Menurut NIOSH A.S., batas bahaya langsung bagi kehidupan dan kesehatan (IDLH) hanya 75 ppm.[89] Administrasi Keselamatan dan Kesehatan Kerja AS (OSHA) telah menetapkan batas paparan yang diizinkan sebesar 1,0 ppm yang dihitung sebagai rata-rata tertimbang waktu 8 jam (29 CFR 1910.1000, Tabel Z-1).[85] Hidrogen peroksida juga telah diklasifikasikan oleh American Conference of Governmental Industrial Hygienists (ACGIH) sebagai "diketahui karsinogen pada hewan, dengan relevansi yang tidak diketahui pada manusia".[90] Untuk tempat kerja yang memiliki risiko terpapar uap dengan konsentrasi berbahaya, pantauan hidrogen peroksida harus digunakan secara terus menerus. Informasi tentang bahaya hidrogen peroksida dapat diperoleh dari OSHA[85] dan dari ATSDR.[91] Efek buruk pada lukaSejarahnya, hidrogen peroksida digunakan untuk mendisinfeksi luka, sebagian karena biayanya yang rendah dan ketersediaannya yang cepat dibandingkan dengan antiseptik lainnya. Saat ini hal Itu dianggap menghambat penyembuhan dan meninggalkan bekas luka, karena ia menghancurkan sel-sel kulit yang baru terbentuk.[92] Satu studi menemukan bahwa hanya konsentrasi yang sangat rendah (larutan 0,03%, larutan H2O2 3% yang diencerkan 100 kali) yang dapat menyembuhkan, dan hanya jika tidak diterapkan berulang. Larutan 0,5% ditemukan dapat menghambat penyembuhan.[93] Penggunaan di bidang pembedahan dapat menyebabkan embolisme udara.[94][95] Meskipun demikian, H2O2 masih digunakan untuk perawatan luka di banyak negara, dan, di Amerika Serikat, lazim sebagai antiseptik utama dalam pertolongan pertama.[96][97] Kulit yang terpapar larutan hidrogen peroksida encer mengalami pemutihan kulit karena mikroemboli yang disebabkan oleh gelembung oksigen pada pembuluh darah kapiler.[98] Penggunaan dalam pengobatan alternatifPraktisi pengobatan alternatif telah menganjurkan penggunaan hidrogen peroksida untuk berbagai kondisi, termasuk emfisema, influenza, AIDS, dan khususnya kanker.[99] Tidak ada bukti efektivitas dan dalam beberapa kasus terbukti fatal.[100][101][102][103][104] Praktik ini menuntut konsumsi hidrogen peroksida setiap hari, baik secara oral atau injeksi, dan didasarkan pada dua pedoman. Pertama, bahwa hidrogen peroksida diproduksi secara alami oleh tubuh untuk memerangi infeksi; dan kedua, bahwa patogen manusia (termasuk kanker: Lihat hipotesis Warburg) bersifat anaerob dan tidak dapat bertahan hidup di lingkungan yang kaya oksigen. Oleh karena itu, menelan atau menyuntikkan hidrogen peroksida diyakini dapat membunuh penyakit dengan meniru respons kekebalan selain meningkatkan kadar oksigen dalam tubuh. Ini membuat praktiknya mirip dengan terapi berbasis oksigen lainnya, seperti terapi ozon dan terapi oksigen hiperbarik. Efektivitas dan keamanan terapi hidrogen peroksida dipertanyakan secara ilmiah. Hidrogen peroksida diproduksi oleh sistem kekebalan tubuh, tetapi dengan cara yang dikendalikan dengan hati-hati. Sel yang disebut fagosit menelan patogen dan kemudian menggunakan hidrogen peroksida untuk menghancurkannya. Peroksida beracun bagi sel dan patogen sehingga disimpan dalam kompartemen khusus, yang disebut fagosom. Hidrogen peroksida bebas akan merusak jaringan apa pun yang dihadapinya melalui stres oksidatif, suatu proses yang juga telah diusulkan sebagai penyebab kanker.[105] Klaim bahwa terapi hidrogen peroksida meningkatkan kadar oksigen seluler belum didukung. Jumlah yang diberikan hanya akan memberikan oksigen tambahan yang sangat sedikit dibandingkan dengan yang diperoleh dari respirasi normal. Sulit juga untuk menaikkan tingkat oksigen di sekitar sel-sel kanker dalam tumor, karena pasokan darah cenderung buruk, suatu kondisi yang dikenal sebagai tumor hipoksia. Dosis hidrogen peroksida oral yang besar pada konsentrasi 3% dapat menyebabkan iritasi dan melepuh pada mulut, tenggorokan, dan perut serta sakit perut, muntah, dan diare.[100] Injeksi hidrogen peroksida intravena telah dikaitkan dengan beberapa kematian.[102][103][104] American Cancer Society menyatakan bahwa "tidak ada bukti ilmiah bahwa hidrogen peroksida adalah pengobatan kanker yang aman, efektif, atau bermanfaat."[101] Selain itu, terapi ini tidak disetujui oleh FDA AS. Insiden bersejarah
ReferensiCatatan
Daftar pustaka
Pranala luarWikiversity memiliki bahan belajar tentang Observing the Effects of Concentration on Enzyme Activity
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
















![{\displaystyle {\ce {R-CH2-CH2-CO-SCoA + O2 ->[{\ce {FAD}}] R-CH=CH-CO-SCoA + H2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c81784a048a5c7ac9b29e369eaef884fdf03642f)

![{\displaystyle {\ce {H2O2 ->[{\ce {CAT}}] {1/2O2}+ H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df4f002a0680eb6c0668474a565b44dd6b1f7ff9)