|
Asam klorida
Asam klorida adalah larutan akuatik dari gas hidrogen klorida (HCl). Ia adalah asam kuat, dan merupakan komponen utama dalam asam lambung. Senyawa ini juga digunakan secara luas dalam industri. Asam klorida harus ditangani dengan prosedur keselamatan yang tepat karena merupakan cairan yang sangat korosif. Asam klorida pernah menjadi zat yang sangat penting dan sering digunakan dalam awal sejarahnya. Ia ditemukan oleh alkimiawan Persia Abu Musa Jabir bin Hayyan sekitar tahun 800. Senyawa ini digunakan sepanjang abad pertengahan oleh alkimiawan dalam pencariannya mencari batu filsuf, dan kemudian digunakan juga oleh ilmuwan Eropa termasuk Glauber, Priestley, and Davy dalam rangka membangun pengetahuan kimia modern. Sejak Revolusi Industri, senyawa ini menjadi sangat penting dan digunakan untuk berbagai tujuan, meliputi sebagai pereaksi dalam produksi massal senyawa kimia organik seperti vinil klorida untuk plastik PVC dan MDI/TDI untuk poliuretana. Kegunaan kecil lainnya meliputi penggunaan dalam pembersih rumah, produksi gelatin, aditif makanan, dan pengolahan kulit. Sekitar 20 juta ton gas HCl diproduksi setiap tahun. pada abad ke-20 proses Leblanc digantikan dengan proses Slovay yang tidak menghasilkan asam klorida sebagai produk sampingan. EtimologiAsam klorida dikenal oleh alkemiawan Eropa sebagai roh garam atau acidum salis (asam garam). Kedua nama tersebut yang masih digunakan, terutama dalam bahasa lain, seperti Jerman: Salzsäure, Belanda: Zoutzuur, Swedia: Saltsyra, dan Polandia: kwas solny. Gas HCl disebut udara asam laut. Nama sebelumnya (pra-sistematis) adalah asam muriatat (bahasa Inggris: muriatic acid) (muriatic berarti "yang berkaitan dengan air garam atau garam", dan dari situ muriat berarti hidroklorida), dan nama ini masih kadang-kadang digunakan.[2][3] Nama "asam klorida"diciptakan oleh kimiawan Prancis Joseph Louis Gay-Lussac pada tahun 1814.[4] SejarahAqua regia, campuran yang terdiri dari asam klorida dan asam nitrat, dibuat dengan melarutkan sal amoniak dalam asam nitrat, digambarkan dalam karya Pseudo-Geber, alkemiawan Persia abad ke-13.[5][6][7][8][9] Referensi lain menunjukkan bahwa penyebutan pertama aqua regia adalah dalam manuskrip Bizantium bertanggal abad ketiga belas.[10][11][12][13] Asam klorida pertama kali ditemukan sekitar tahun 800 sesudah masehi oleh ahli kimia Jabir bin Hayyan (Geber) dengan mencampurkan natrium klorida dengan asam sulfat ("vitriol").[14][15] Jabir menemukan banyak senyawa-senyawa kimia penting lainnya, dan mencatat penemuannya ke dalam lebih dari dua puluh buku. Penemuan Jabir atas air raja yang dapat melarutkan emas mengandung asam klorida dan asam nitrat.[7][14][15] Pada Abad Pertengahan, asam klorida dikenal oleh ahli kimia Eropa sebagai spirits of salt atau acidum salis (asam garam). Istilah asam garam ini pun masih digunakan di beberapa bahasa dunia, misalnya dalam bahasa Jerman Salzsäure, bahasa Belanda Zoutzuur, bahasa Mandarin 鹽酸 (yansuan), dan bahasa Jepang 塩酸 (ensan). Gas HCl disebut sebagai udara asam laut. Produksi asam klorida secara signifikan dicatat oleh Basilius Valentinus pada abad ke-15. Pada abad ke-17, Johann Rudolf Glauber dari Karlstadt am Main, Jerman menggunakan natrium klorida dan asam sulfat untuk membuat natrium sulfat melalui proses Mannheim. Proses ini akan melepaskan gas hidrogen klorida sebagai produk sampingannya. Joseph Priestley dari Leeds berhasil menghasilkan hidrogen klorida murni pada tahun 1772,[16] dan pada tahun 1818, Humphry Davy dari Penzance, Inggris, membuktikan bahwa komposisi kimia zat tersebut terdiri dari hidrogen dan klorin.[7][14][15][17]  Semasa Revolusi Industri di Eropa, permintaan atas senyawa-senyawa alkalin meningkat. Proses industri baru yang mengizinkan produksi natrium karbonat (soda abu) dalam skala besar berhasil dikembangkan oleh Nicolas Leblanc. Dalam proses Leblanc, natrium klorida diubah menjadi natrium karbonat menggunakan asam sulfat, batu kapur, dan batubara. Proses ini melepaskan hidrogen klorida sebagai produk samping. Sebelum diberlakukannya Undang-Undang Alkali tahun 1863 oleh Britania, HCl yang berlebih dilepaskan ke udara bebas. Setelah berlakunya undang-undang ini, produsen soda abu diwajibkan untuk melarutkan gas ini ke dalam air dan menghasilkan asam klorida dalam skala industri.[7][14][18] Pada abad ke-20, proses Leblanc digantikan oleh proses Solvay yang tidak menghasilkan asam klorida sebagai produk sampingan. Setelah tahun 2000, asam klorida kebanyakan dihasilkan dari pelarutan produk samping hidrogen klorida dari produksi industri senyawa organik.[7][18][19] Sejak tahun 1988, asam klorida telah dimasukkan ke dalam Tabel II Konvensi Perserikatan Bangsa-Bangsa Tentang Pemberantasan Peredaran Gelap Narkotika dan Psikotropika karena ia dapat digunakan dalam produksi heroin, kokaina, dan metamfetamina.[20] Konvensi ini disahkan di Indonesia oleh Undang-Undang Nomor 7 Tahun 1997.[21] Kimia Hidrogen klorida (HCl) adalah asam monoprotik, yang berarti bahwa ia dapat terdisosiasi (terionisasi) melepaskan satu H+ (sebuah proton tunggal) hanya sekali. Dalam larutan asam klorida, H+ ini bergabung dengan molekul air membentuk ion hidronium, H:[22][23]
Ion lain yang terbentuk adalah ion klorida, Cl−. Asam klorida oleh karenanya dapat digunakan untuk membuat garam klorida, seperti natrium klorida. Asam klorida adalah asam kuat karena ia terdisosiasi penuh dalam air.[22][23] Asam monoprotik memiliki satu tetapan disosiasi asam, Ka, yang mengindikasikan tingkat disosiasi zat tersebut dalam air. Untuk asam kuat seperti HCl, nilai Ka cukup besar. Beberapa usaha perhitungan teoretis telah dilakukan untuk menghitung nilai Ka HCl.[24] Ketika garam klorida seperti NaCl ditambahkan ke dalam larutan HCl, ia tidak akan mengubah pH larutan secara signifikan. Hal ini mengindikasikan bahwa Cl− adalah basa konjugat yang sangat lemah dan HCl secara penuh berdisosiasi dalam larutan tersebut. Untuk larutan asam klorida sedang hingga pekat, asumsi bahwa molaritas H+ sama dengan molaritas (satuan konsentrasi) HCl cukuplah baik, dengan ketepatan mencapai empat digit angka bermakna.[22][23] Dari enam asam mineral kuat dalam kimia, asam klorida merupakan asam monoprotik yang paling sulit mengalami reaksi redoks. Ia juga merupakan asam kuat yang paling tidak berbahaya untuk ditangani dibandingkan dengan asam kuat lainnya. Walaupun asam, ia mengandung ion klorida yang tidak reaktif dan tidak beracun. Asam klorida dalam konsentrasi menengah cukup stabil untuk disimpan dan terus mempertahankan konsentrasinya. Oleh karena alasan inilah, ditambah kenyataan bahwa asam ini tersedia dalam bentuk pereaksi murni, asam klorida merupakan reagen pengasam yang sangat baik. Asam klorida merupakan asam pilihan dalam titrasi untuk menentukan jumlah basa. Asam yang lebih kuat akan memberikan hasil yang lebih baik oleh karena titik akhir yang jelas. Asam klorida azeotropik (kira-kira 20,2%) dapat digunakan sebagai standar primer dalam analisis kuantitatif, walaupun konsentrasinya bergantung pada tekanan atmosfernya ketika dibuat.[25] Asam klorida sering digunakan dalam analisis kimia untuk "mencerna" sampel-sampel analisis. Asam klorida pekat melarutkan banyak jenis logam dan menghasilkan logam klorida dan gas hidrogen. Ia juga bereaksi dengan senyawa dasar semacam kalsium karbonat dan tembaga(II) oksida, menghasilkan klorida terlarut yang dapat dianalisis.[22][23] Sifat-sifat fisikaCiri-ciri fisika asam klorida, seperti titik didih, titik leleh, massa jenis, dan pH tergantung pada konsentrasi atau molaritas HCl dalam larutan asam tersebut. Sifat-sifat ini berkisar dari larutan dengan konsentrasi HCl mendekati 0% sampai dengan asam klorida berasap 40% HCl[22][23][26]
 Sifat fisik asam klorida, seperti titik didih dan leleh, rapat jenis, dan pH, tergantung pada konsentrasi atau molaritas HCl dalam larutan akuatik. Mereka berkisar dari konsentrasi yang sangat rendah mendekati 0% HCl hingga angka untuk asam klorida pekat berasap yaitu lebih dari 40% HCl.[23][26][29] Asam klorida sebagai campuran dua bahan antara HCl dan H2O mempunyai titik didih-konstan azeotrop pada 20,2% HCl dan 108,6 °C (227 °F). Asam klorida memiliki empat titik eutektik kristalisasi-konstan, berada di antara kristal HCl·H2O (68% HCl), HCl·2H2O (51% HCl), HCl·3H2O (41% HCl), HCl·6H2O (25% HCl), dan es (0% HCl). Terdapat pula titik eutektik metastabil pada 24,8% antara es dan kristalisasi dari HCl·3H2O.[26] ProduksiAsam klorida dibuat dengan melarutkan hidrogen klorida ke dalam air. Hidrogen klorida dapat dihasilkan melalui beberapa cara. Produksi skala besar asam klorida hampir selalu merupakan produk sampingan dari produksi industri senyawa kimia lainnya.[7] Pasar industriAsam klorida diproduksi dalam bentuk larutan 38% HCl (pekat). Konsentrasi yang lebih besar daripada 40% dimungkinkan secara kimiawi, namun laju penguapan sangatlah tinggi, sehingga penyimpanan dan penanganannya harus dilakukan dengan ekstra hati-hati, misalnya dalam suhu dan tekanan rendah. Konsentrasi HCl yang paling optimal untuk transportasi dengan meminimalisasi kehilangan produk karena penguapan adalah 30% sampai dengan 34%. Konsentrasi yang lebih tinggi memerlukan penambahan tekanan dan pendinginan untuk mengurangi kehilangan akibat penguapan. Di Amerika Serikat, larutan antara 20% hingga 32% dijual sebagai asam muriatat. Kandungan asam klorida pada kebanyakan cairan pembersih umumnya berkisar antara 10% sampai dengan 12%.[7] Cairan pembersih tersebut harus diencerkan terlebih dahulu sebelum digunakan. Produsen asam klorida terbesar di dunia adalah Perusahaan Dow Chemical dengan total produksi sebesar 2 juta ton per tahun (sebagai gas HCl), disusul Georgia Gulf Corporation, Tosoh Corporation, Akzo Nobel, dan Tessenderlo dengan produksi masing-masing 0,5 hingga 1,5 Mt/tahun. Produksi HCl dunia diperkirakan sebesar 20 juta ton per tahun, dengan 3 juta ton berasal dari sintesis langsung, dan sisanya merupakan hasil dari produk sampingan sintesis organik. Total pasar dunia diperkirakan mencapai 5 Mt/tahun.[7] AplikasiAsam klorida adalah asam anorganik kuat yang digunakan dalam berbagai proses industri seperti pengolahan logam. Aplikasi ini sering menentukan kualitas produk yang diperlukan.[7] Pengawetan bajaSalah satu aplikasi yang paling penting dari asam klorida yaitu dalam pengawetan baja, untuk menghilangkan karat atau kerak oksida dari besi atau baja sebelum pengolahan selanjutnya, seperti ekstrusi, rolling, galvanisasi, dan teknik lainnya.[7][19] HCl berderajatkemurnian teknis dengan konsentrasi 18% adalah yang paling umum digunakan sebagai pengawet untuk pengawetan baja karbon.
Asam buangannya telah lama digunakan kembali sebagai larutan besi(II) klorida (juga dikenal sebagai fero klorida), tetapi tingkat logam berat yang tinggi dalam cairan pengawet telah menurun praktik ini. Industri pengawetan baja telah mengembangkan proses regenerasi asam klorida, seperti roaster semprot atau proses regenerasi HCl fluida, yang memungkinkan pemulihan HCl dari limbah bekas pengawetannya. Proses regenerasi yang paling umum adalah proses pirohidrolisis, sesuai persamaan berikut:[7]
Dengan pemulihan asam bekas pengawetan, ditetapkanlah siklus asam tertutup.[19] Besi(III) oksida merupakan produk samping dari proses regenerasi yang berharga, dan dapat digunakan dalam berbagai industri sekunder.[7] Produksi senyawa organikPenggunaan utama lain asam klorida adalah dalam produksi senyawa organik, seperti vinil klorida dan dikloroetana untuk PVC. Ini adalah penggunaan yang pasti namun terbatas, mengkonsumsi secara lokal produk asam klorida yang tidak pernah sampai ke pasar terbuka. Senyawa organik lainnya yang diproduksi dengan asam klorida termasuk bisphenol A untuk polikarbonat, karbon aktif, dan asam askorbat, serta berbagai produk farmasi.[19]
Produksi senyawa anorganikBerbagai produk dapat diproduksi dengan asam klorida melalui reaksi asam-basa normal, menghasilkan senyawa anorganik. Ini termasuk bahan kimia pengolahan air seperti besi(III) klorida dan polialuminium klorida (PAC).
Baik besi(III) klorida dan PAC digunakan sebagai flokulan dan koagulan dalam pengolahan limbah, produksi air minum, dan produksi kertas. Senyawa anorganik lain yang diproduksi dengan asam klorida termasuk kalsium klorida untuk aplikasi jalan, nikel(II) klorida untuk elektroplating, dan seng klorida untuk industri galvanis dan produksi baterai.[19]
Pengendali pH dan netralisasiAsam klorida dapat digunakan untuk mengatur keasaman (pH) larutan.
Dalam industri yang menuntut kemurnian tinggi (makanan, farmasi, air minum), asam klorida berkualitas tinggi digunakan untuk mengontrol pH aliran air proses. Dalam industri yang tidak menuntut kualitas terlalu tinggi, asam klorida teknis cukup untuk menetralisir aliran limbah dan pengendalian pH kolam renang.[19] Regenerasi penukar ionAsam klorida berkualitas tinggi digunakan dalam regenerasi resin penukar ion. Pertukaran kation banyak digunakan untuk mengusir ion seperti Na+ dan Ca2+ dari larutan akuatiknya, menghasilkan akua demineralisata. Asam ini digunakan untuk mencuci kation dari resin.[7] Na+ digantikan dengan H+ dan Ca2+ dengan 2 H+. Penukar ion dan akua demineralisata digunakan dalam seluruh industri kimia, produksi air minum, dan sebagian besar industri pangan.[7] Lain-lainAsam klorida digunakan untuk sejumlah besar aplikasi skala kecil, seperti pengolahan kulit, pemurnian garam dapur, pembersih rumah tangga,[30] dan konstruksi bangunan.[19] Produksi minyak dapat dirangsang dengan menyuntikkan asam klorida ke dalam formasi batuan sumur minyak, melarutkan sebagian dari batu, dan menciptakan struktur berpori besar. Pengasaman sumur minyak adalah proses umum dalam industri produksi minyak Laut Utara.[7] Asam klorida telah digunakan untuk melarutkan kalsium karbonat, yaitu hal-hal seperti membersihkan kerak pada ketel dan untuk membersihkan lumpang pada pembuatan bata. Namun, ini merupakan cairan berbahaya yang harus digunakan dengan hati-hati. Ketika digunakan pada pembuatan bata reaksi dengan mortar hanya berlangsung sampai semua asam habis dikonversi, menghasilkan kalsium klorida, karbon dioksida, dan air:
Banyak reaksi kimia yang melibatkan asam klorida diterapkan dalam produksi makanan, bahan makanan, dan aditif makanan. Produk khusus termasuk aspartam, fruktosa, asam sitrat, lisin, protein nabati terhidrolisis sebagai pengaya makanan, dan dalam produksi gelatin. Asam klorida food grade (ekstra-murni) dapat ditambahkan pada produk akhir bila diperlukan.[7][19] Keberadaan dalam organisme hidup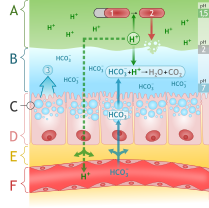 Asam lambung merupakan salah satu sekresi utama lambung. Ia utamanya terdiri dari asam klorida dan mengasamkan kandungan perut hingga mencapai pH sekitar 1 sampai dengan 2.[31] Ion klorida (Cl−) dan hidrogen (H+) disekresikan secara terpisah di bagian fundus perut yang berada di bagian teratas lambung oleh sel parietal mukosa lambung ke dalam jaringan sekretori kanalikulus sebelum memasuki lumen perut.[32] Asam lambung berfungsi untuk membantu pencernaan makanan dan mencegah mikroorganisme masuk lebih jauh ke dalam usus. pH asam lambung yang rendah akan mendenaturasi protein, sehingga akan lebih mudah dicerna oleh enzim pepsin. pH yang rendah ini juga akan mengaktivasi prekursor enzim pepsinogen. Setelah meninggalkan lambung, asam klorida dalam kim akan dinetralkan oleh natrium bikarbonat dalam usus dua belas jari.[31] Lambung itu sendiri terlindung dari asam kuat oleh sekresi lapisan mukosa yang tebal dan penyanggaan oleh natrium bikarbonat yang diinduksi oleh sekretin. Nyeri ulu hati dan sakit maag dapat berkembang apabila mekanisme perlindungan ini gagal bekerja. Obat-obat antagonis H2 dan penghambat pompa proton dapat menghambat produksi asam dalam lambung, dan antasid digunakan untuk menetralkan asam yang ada.[31][33] Keselamatan
Asam klorida pekat (asam klorida berasap) akan membentuk kabut asam. Baik kabut dan larutan tersebut bersifat korosif terhadap jaringan tubuh, dengan potensi kerusakan pada organ pernapasan, mata, kulit, dan usus. Seketika asam klorida bercampur dengan bahan kimia oksidator lainnya, seperti natrium hipoklorit (pemutih NaClO) atau kalium permanganat (KMnO4), gas beracun klorin akan terbentuk.
Alat-alat pelindung seperti sarung tangan PVC atau karet, pelindung mata, dan pakaian pelindung haruslah digunakan ketika menangani asam klorida.[14] Bahaya larutan asam klorida bergantung pada konsentrasi larutannya. Badan Perlindungan Lingkungan Amerika Serikat memasukkan asam klorida sebagai zat beracun.[35] Tabel di bawah ini merupakan klasifikasi bahaya larutan asam klorida Uni Eropa.[34] Nomor UN atau DOT adalah 1789. Nomor ini dicantumkan pada plakat di peti kemas. Lihat juga
Referensi
Pranala luarWikimedia Commons memiliki media mengenai Asam klorida.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia