|
Asam nitrat
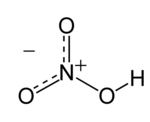
Senyawa kimia asam nitrat (HNO3) adalah sejenis cairan korosif yang tak berwarna, dan merupakan asam beracun yang dapat menyebabkan luka bakar. Larutan asam nitrat dengan kandungan asam nitrat lebih dari 86% disebut sebagai asam nitrat berasap, dan dapat dibagi menjadi dua jenis asam, yaitu asam nitrat berasap putih dan asam nitrat berasap merah. SejarahAsam nitrat pertama kali disintesis sekitar 800 M oleh alkimiawan Jabir ibnu Hayyan, yang juga menemukan distilasi modern dan proses kimiawi dasar lainnya yang masih digunakan sekarang ini. KimiaAsam nitrat adalah larutan asam kuat yang mempunyai nilai pKa sebesar -2. Di dalam air, asam ini terdisosiasi menjadi ion-ionnya, yaitu ion nitrat NO3− dan ion hidronium (H3O+). Garam dari asam nitrat disebut sebagai garam nitrat (contohnya seperti kalsium nitrat atau barium nitrat). Dalam temperatur ruangan, asam nitrat berbentuk uap berwarna merah atau kuning. Asam nitrat dan garam nitrat adalah sesuatu yang berbeda dengan asam nitrit dan garamnya, garam nitrit. SifatAsam nitrat murni (100%) merupakan cairan tak berwarna dengan berat jenis 1.522 kg/m³. Ia membeku pada suhu -42 °C, membentuk kristal-kristal putih, dan mendidih pada 83 °C. Ketika mendidih pada suhu kamar, terdapat dekomposisi (penguraian) sebagian dengan pembentukan nitrogen dioksida sesudah reaksi:
yang berarti bahwa asam nitrat anhidrat sebaiknya disimpan di bawah 0 °C untuk menghindari penguraian. Nitrogen dioksida (NO2) tetap larut dalam asam nitrat yang membuatnya berwarna kuning, atau merah pada suhu yang lebih tinggi. Manakala asam murni cenderung mengeluarkan asap putih ketika terpapar ke udara, asam dengan nitrogen dioksida terlarut mengeluarkan uap berwarna coklat kemerah-merahan, yang membuatnya dijuluki "asam berasap merah" atau "asam nitrat berasap". Asam nitrat berasap juga dirujuk sebagai asam nitrat 16 molar (bentuk paling pekat asam nitrat pada temperatur dan tekanan standar). Asam nitrat bercampur dengan air dalam berbagai proporsi dan distilasi menghasilkan azeotrop dengan konsentrasi 68% HNO3 dan titik didih 120,5 °C pada 1 atm. Terdapat dua hidrat padat yang diketahui, yaitu monohidrat (HNO3·H2O) dan trihidrat (HNO3·3H2O). Nitrogen oksida (NOx) larut dalam asam nitrat dan sifat ini memengaruhi semua sifat fisik asam nitrat yang bergantung pada konsentrasi oksida (seperti tekanan uap di atas cair, suhu didih, dan warna yang dijelaskan di atas). Peningkatan konsentrasi asam nitrat dipengaruhi oleh penguraian termal maupun cahaya, dan hal ini dapat menimbulkan sejumlah variasi yang tak dapat diabaikan pada tekanan uap di atas cairan karena nitrogen oksida yang dihasilkan akan terlarut sebagian atau sepenuhnya di dalam asam. Sifat-sifat asamSebagai mana asam pada umumnya, asam nitrat bereaksi dengan alkali, oksida basa, dan karbonat untuk membentuk garam, seperti amonium nitrat. Karena memiliki sifat mengoksidasi, asam nitrat pada umumnya tidak menyumbangkan protonnya (yakni, ia tidak membebaskan hidrogen) pada reaksi dengan logam dan garam yang dihasilkan biasanya berada dalam keadaan teroksidasi yang lebih tinggi.Karenanya, perkaratan (korosi) tingkat berat bisa terjadi. Perkaratan bisa dicegah dengan penggunaan logam ataupun aloi anti karat yang tepat. Asam nitrat memiliki tetapan disosiasi asam (pKa) 1,4: dalam larutan akuatik, asam nitrat hampir sepenuhnya (93% pada 0.1 mol/L) terionisasi menjadi ion nitrat NO3 dan proton terhidrasi yang dikenal sebagai ion hidronium, H3O+. HNO3 + H2O → H3O+ + NO3- Sifat-sifat oksidasiReaksi dengan logamSebagai sebuah oksidator yang kuat, asam nitrat bereaksi dengan hebat dengan sebagian besar bahan-bahan organik dan reaksinya dapat bersifat eksplosif. Produk akhirnya bisa bervariasi tergantung pada konsentrasi asam, suhu, serta reduktor. Reaksi dapat terjadi dengan semua logam kecuali deret logam mulia dan aloi tertentu. Karakteristik ini membuat asam nitrat menjadi agen yang umumnya digunakan dalam uji asam. Sebagai kaidah yang umum, reaksi oksidasi utamanya terjadi dengan asam pekat, memfavoritkan pembentukan nitrogen dioksida (NO2). Cu + 4H+ + 2NO3- → Cu+2 + 2NO2 + 2H2O Sifat-sifat asam cenderung mendominasi pada asam nitrat encer, diikuti dengan pembentukan nitrogen oksida (NO) yang lebih diutamakan. 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O Karena asam nitrat merupakan oksidator, hidrogen (H2) jarang terbentuk. Hanya magnesium (Mg), mangan (Mn), dan kalsium (Ca) yang bereaksi dengan asam nitrat dingin dan encer yang dapat menghasilkan hidrogen: Mg(s) + 2HNO3(aq) → Mg(NO3)2(aq) + H2(g) Asam nitrat mampu menyerang dan melarutkan semua logam yang ada pada tabel periodik, kecuali emas dan platina. PemasifanKendati kromium (Cr), besi (Fe), dan aluminium (Al) akan terlarut dalam asam nitrat yang encer, asam pekat akan membentuk sebuah lapisan logam oksida yang melindungi logam dari oksidasi lebih lanjut. Hal ini disebut dengan pemasifan. Konsentrasi pemasifan yang umum berkisar dari 18% sampai 22% berat. Reaksi dengan non-logamKetika asam nitrat bereaksi dengan berbagai unsur non-logam, terkecuali silikon serta halogen, biasanya ia akan mengoksidasi non-logam tersebut ke keadaan oksidasi tertinggi dengan asam nitrat menjadi nitrogen dioksida untuk asam pekat dan nitrogen monoksida untuk asam encer. C + 4HNO3 → CO2 + 4NO2 + 2H2O ataupun 3C + 4HNO3 → 3CO2 + 4NO + 2H2O Sintesis dan produksiAsam nitrat dibuat dengan mencampur nitrogen dioksida (NO2) dengan air. Menghasilkan asam nitrat yang sangat murni biasanya melibatkan distilasi dengan asam sulfat, karena asam nitrat membentuk sebuah azeotrop dengan air dengan komposisi 68% asam nitrat dan 32% air. Asam nitrat kualitas komersial biasanya memiliki konsentrasi antara 52% dan 68% asam nitrat. Produksi komersial dari asam nitrat melalui proses Ostwald yang ditemukan oleh Wilhelm Ostwald. Asam nitrat dapat dibuat dengan mereaksikan 200 gram potasium nitrat (KNO3) ke dalam larutan asam sulfat (H2SO4) 96% 106 ml, kemudian mendistilasi campuran ini di titik didih asam nitrat (83 °C) sampai hanya tersisa kristal putih potasium hidrogen sulfat (KHSO4), di tabung reaksinya. PenggunaanAsam nitrat biasanya digunakan di laboratorium sebagai reagen. Larutan ini juga dipakai untuk memproduksi bahan-bahan yang meledak seperti nitrogliserin, trinitrotoluena (TNT) dan Siklotrimetilenatrinitramin (RDX), dan juga untuk pembuatan amonium nitrat. Asam nitrat juga digunakan di bagian metalurgi dan pengilangan karena dapat bereaksi dengan metal. Ketika dicampurkan dengan asam klorida, maka campuran ini akan membentuk aqua regia, satu dari sedikit reagen yang dapat melarutkan emas dan platinum. Asam nitrat juga merupakan komponen dari hujan asam. ReferensiPranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||