|
Polonium
Polonium adalah sebuah unsur kimia dengan lambang Po dan nomor atom 84. Sebuah logam langka yang sangat radioaktif tanpa isotop stabil, polonium adalah sebuah kalkogen dan secara kimiawi mirip dengan selenium dan telurium, meskipun karakter logamnya mirip dengan tetangga horizontalnya di tabel periodik: talium, timbal, dan bismut. Karena waktu paruh semua isotopnya pendek, keterjadian alaminya terbatas pada jejak kecil polonium-210 yang cepat meluruh (dengan waktu paruh 138 hari) dalam bijih uranium, karena ia merupakan anak kedua terakhir dari uranium-238 yang alami. Meskipun ada isotop yang berumur sedikit lebih lama, mereka jauh lebih sulit untuk diproduksi. Saat ini, polonium biasanya diproduksi dalam jumlah miligram melalui iradiasi neutron oleh bismut. Karena radioaktivitasnya yang kuat, yang menghasilkan radiolisis dalam ikatan kimia dan pemanasan radioaktif sendiri, sifat kimianya sebagian besar telah diselidiki hanya pada skala kecil. Polonium ditemukan pada Juli 1898 oleh Marie Skłodowska-Curie dan Pierre Curie, ketika ia diekstraksi dari bijih uranium uraninit dan teridentifikasi hanya dengan radioaktivitasnya yang kuat: ia adalah unsur pertama yang ditemukan melalui sifat radioaktifnya. Polonium dinamai dari negara asal Marie Curie, Polandia. Polonium memiliki beberapa aplikasi, dan itu terkait dengan radioaktivitasnya: pemanas di prob antariksa, perangkat antistatis, sumber neutron dan partikel alfa, serta racun. Polonium sangatlah berbahaya bagi manusia. Karakteristik210Po adalah sebuah pemancar alfa yang memiliki waktu paruh 138,4 hari; ia meluruh langsung menjadi isotop anaknya yang stabil, 206Pb. Satu miligram (5 curie) 210Po memancarkan partikel alfa per detik sebanyak 5 gram 226Ra,[4] yang berarti ia 5.000 kali lebih radioaktif daripada radium. Beberapa curie (1 curie sama dengan 37 gigabecquerel, 1 Ci = 37 GBq) dari 210Po memancarkan cahaya biru yang disebabkan oleh ionisasi udara di sekitarnya. Sekitar satu dari 100.000 pancaran alfa menyebabkan eksitasi pada inti yang kemudian menghasilkan pancaran sinar gama dengan energi maksimum 803 keV.[5][6] Bentuk wujud padat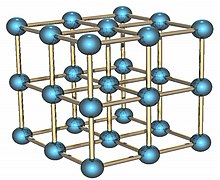 Polonium adalah unsur radioaktif yang ada dalam dua alotrop metalik. Bentuk alfa adalah satu-satunya contoh yang diketahui dari struktur kristal kubik sederhana dalam basis atom tunggal pada STP, dengan panjang tepi 335,2 pikometer; bentuk beta adalah rombohedral.[7][8][9] Struktur polonium telah dicirikan oleh difraksi sinar-X[10][11] dan difraksi elektron.[12] 210Po (sama dengan 238Pu[butuh rujukan]) memiliki kemampuan untuk mengudara dengan mudah: jika sebuah sampel dipanaskan di udara hingga 55 °C (131 °F), 50% darinya menguap dalam 45 jam untuk membentuk molekul Po2 diatomik, meskipun titik lebur polonium adalah 254 °C (489 °F) dan titik didihnya adalah 962 °C (1.764 °F).[13][14][2] Ada lebih dari satu hipotesis tentang bagaimana polonium melakukan ini; satu pendapat mengemukakan bahwa gugus kecil atom polonium terkelupas oleh peluruhan alfa.[15] Sifat KimiaSifat kimia polonium mirip dengan telurium, meskipun ia juga menunjukkan beberapa kesamaan dengan tetangganya bismut karena karakter logamnya. Polonium mudah larut dalam asam encer tetapi hanya sedikit larut dalam alkali. Larutan polonium mula-mula berwarna merah muda oleh ion Po2+, tetapi kemudian dengan cepat menjadi kuning karena radiasi alfa dari polonium yang mengionisasi pelarut dan mengubah Po2+ menjadi Po4+. Karena polonium juga memancarkan partikel alfa setelah disintegrasi maka proses ini disertai dengan gelembung dan emisi panas dan cahaya oleh peralatan kaca karena partikel alfa yang terserap; akibatnya, larutan polonium bersifat volatil dan akan menguap dalam beberapa hari kecuali disegel.[16][17] Pada pH sekitar 1, ion polonium mudah dihidrolisis dan dikomplekskan oleh asam seperti asam oksalat, asam sitrat, dan asam tartarat.[18] SenyawaPolonium tidak memiliki senyawa umum, dan hampir semua senyawanya dibuat secara sintetis; lebih dari 50 di antaranya telah diketahui.[19] Golongan senyawa polonium yang paling stabil adalah polonida, yang dibuat melalui reaksi langsung dua unsur. Na2Po memiliki struktur antifluorit, polonida Ca, Ba, Hg, Pb dan lantanida membentuk kisi NaCl, BePo dan CdPo memiliki struktur wurtzit, dan MgPo memiliki struktur nikel arsenida. Sebagian besar polonida terurai pada pemanasan hingga sekitar 600 °C, kecuali HgPo yang terurai pada ~300 °C dan polonida lantanida, yang tidak terurai tetapi melebur pada suhu di atas 1000 °C. Misalnya, polonida praseodimium (PrPo) melebur pada 1250 °C, dan polonida tulium (TmPo) melebur pada 2200 °C.[20] PbPo adalah salah satu dari sangat sedikit senyawa polonium alami, karena polonium meluruh melalui peluruhan alfa menjadi timbal.[21] Polonium hidrida (PoH2) adalah cairan yang mudah menguap pada suhu kamar yang rentan terhadap disosiasi; ia tidak stabil secara termal.[20] Air adalah satu-satunya hidrogen kalkogenida lain yang diketahui berbentuk cair pada suhu kamar; namun, hal ini dikarenakan ikatan hidrogen. Tiga oksida, PoO, PoO2, dan PoO3, adalah produk dari oksidasi polonium.[22] Halida dari struktur PoX2, PoX4 dan PoF6 telah diketahui. Mereka larut dalam hidrogen halida yang sesuai, yaitu, PoClX dalam HCl, PoBrX dalam HBr, dan PoI4 dalam HI.[23] Polonium dihalida dibentuk oleh reaksi langsung dari unsur-unsur yang sesuai atau dengan reduksi PoCl4 dengan SO2 dan dengan PoBr4 dengan H2S pada suhu kamar. Tetrahalida dapat diperoleh dengan mereaksikan polonium dioksida dengan HCl, HBr atau HI.[24] Senyawa polonium lainnya termasuk kalium polonit sebagai polonit, polonat, asetat, bromat, karbonat, sitrat, kromat, sianida, format, (II) dan (IV) hidroksida, nitrat, selenat, selenit, monosulfida, sulfat, disulfat, dan sulfit.[23][25] Kimia organopolonium terbatas telah diketahui, sebagian besar terbatas pada dialkil dan diaril polonida (R2Po), triarilpolonium halida (Ar3PoX), dan diarilpolonium dihalida (Ar2PoX2).[26][27] Polonium juga membentuk senyawa yang larut dengan beberapa agen pengelat, seperti 2,3-butanediol dan tiourea.[26]
IsotopPolonium memiliki 42 isotop yang diketahui, semuanya bersifat radioaktif. Mereka memiliki massa atom yang berkisar antara 186 hingga 227 u. 210Po (waktu paruh 138,376 hari) adalah yang paling banyak tersedia dan dibuat melalui penangkapan neutron oleh bismut alami. 209Po yang berumur lebih panjang (waktu paruh 125,2±3,3 tahun, berumur paling panjang dari semua isotop polonium)[33] dan 208Po (waktu paruh 2,9 tahun) dapat dibuat melalui pemborbardiran alfa, proton, atau deuteron terhadap timbal atau bismut dalam siklotron.[34] Sejarah Terkadang disebut "radium F", polonium ditemukan oleh Marie dan Pierre Curie pada bulan Juli 1898,[35][36] dan diberi nama dari tanah kelahiran Marie Curie di Polandia (bahasa Latin: Polonia).[37][38] Polandia pada saat itu berada di bawah partisi Rusia, Jerman, dan Austria-Hungaria, dan tidak eksis sebagai negara merdeka. Itu adalah harapan Curie bahwa penamaan unsur ini setelah tanah airnya akan mempublikasikan kurangnya kemerdekaan.[39] Polonium mungkin merupakan unsur pertama yang disebutkan untuk menyoroti kontroversi politik.[39] Unsur ini adalah yang pertama kali ditemukan oleh Curie saat mereka menyelidiki penyebab radioaktivitas uraninit. Uraninit, setelah penghilangan unsur radioaktif uranium dan torium, menjadi lebih radioaktif daripada gabungan uranium dan torium. Ini mendorong Curie untuk mencari unsur radioaktif tambahan. Mereka pertama kali memisahkan polonium dari uraninit pada Juli 1898, dan lima bulan kemudian, juga mengisolasi radium.[16][35][40] Ilmuwan Jerman Willy Marckwald berhasil mengisolasi 3 miligram polonium pada tahun 1902, meskipun pada saat itu dia yakin itu adalah unsur baru, yang dia juluki "radio-telurium", dan baru pada tahun 1905 terbukti sama dengan polonium.[41][42] Di Amerika Serikat, polonium diproduksi sebagai bagian dari Proyek Dayton, bagian dari Proyek Manhattan, selama Perang Dunia II. Polonium dan berilium adalah bahan utama dari inisiator 'Urchin' di tengah lubang bola bom.[43] 'Urchin' memprakarsai reaksi berantai nuklir pada saat kekritisan yang cepat untuk memastikan bahwa senjata itu tidak gagal. 'Urchin' digunakan dalam senjata A.S. awal; senjata A.S. selanjutnya menggunakan generator pulsa neutron untuk tujuan yang sama.[43] Sebagian besar fisika dasar polonium dirahasiakan sampai setelah perang. Fakta bahwa ia digunakan sebagai inisiator dirahasiakan hingga tahun 1960-an.[44] Komisi Energi Atom dan Proyek Manhattan mendanai eksperimen manusia menggunakan polonium pada lima orang di Universitas Rochester antara tahun 1943 dan 1947. Orang-orang tersebut diberikan antara 9 dan 22 microcurie (330 dan 810 kBq) polonium untuk mempelajari ekskresinya.[45][46][47] Keterjadian dan produksiPolonium adalah unsur yang sangat langka di alam karena waktu paruh semua isotopnya pendek. Tujuh isotop terjadi dalam jumlah jejak sebagai produk peluruhan: 210Po, 214Po, dan 218Po terjadi dalam rantai peluruhan 238U; 211Po dan 215Po terjadi dalam rantai peluruhan 235U; 212Po dan 216Po terjadi dalam rantai peluruhan 232Th. Dari mereka, 210Po adalah satu-satunya isotop dengan waktu paruh lebih dari 3 menit.[48] Polonium dapat ditemukan dalam bijih uranium sekitar 0,1 mg per ton metrik (1 bagian dalam 1010),[49][50] yang merupakan sekitar 0,2% dari kelimpahan radium. Jumlahnya di kerak bumi tidak berbahaya. Polonium telah ditemukan dalam asap tembakau dari daun tembakau yang ditanam dengan pupuk fosfat.[51][52][53] Karena ia hadir dalam konsentrasi kecil, isolasi polonium dari sumber alami merupakan proses yang sangat lama. Kumpulan polonium terbesar yang pernah diekstraksi, dilakukan pada paruh pertama abad ke-20, hanya mengandung 40 Ci (1,5 TBq) (9 mg) polonium-210 dan diperoleh dengan mengolah 37 ton residu dari produksi radium.[54] Polonium sekarang biasanya diperoleh dengan menyinari bismut dengan neutron atau proton berenergi tinggi.[16][55] Pada tahun 1934, sebuah percobaan menunjukkan bahwa ketika 209Bi dibombardir dengan neutron, 210Bi dibuat, yang kemudian meluruh menjadi 210Po melalui peluruhan beta-minus. Pemurnian akhir dilakukan secara pirokimia diikuti dengan teknik ekstraksi cair-cair.[56] Polonium sekarang dapat dibuat dalam jumlah miligram dalam prosedur ini yang menggunakan fluks neutron tinggi yang ditemukan di reaktor nuklir.[55] Hanya sekitar 100 gram yang diproduksi setiap tahun, hampir seluruhnya di Rusia, membuat polonium sangatlah langka.[57][58] Proses ini dapat menyebabkan masalah dalam reaktor berpendingin logam cair berbasis timbal-bismut seperti yang digunakan pada K-27 milik Angkatan Laut Soviet. Langkah-langkah harus diambil dalam reaktor tersebut untuk mengatasi kemungkinan 210Po yang tidak diinginkan dilepaskan dari pendingin.[59][60] Isotop polonium yang berumur lebih panjang, 208Po dan 209Po, dapat dibentuk oleh pemborbardiran proton atau deuteron terhadap bismut menggunakan siklotron. Isotop lain yang lebih memiliki sedikit neutron dan lebih tidak stabil dapat dibentuk dengan iradiasi platina dengan inti karbon.[61] AplikasiSumber partikel alfa berbasis polonium diproduksi di Uni Soviet.[62] Sumber tersebut diterapkan untuk mengukur ketebalan lapisan industri melalui atenuasi radiasi alfa.[63] Karena radiasi alfa yang kuat, satu gram sampel 210Po akan secara spontan memanas hingga di atas 500 °C (932 °F) menghasilkan daya sekitar 140 watt. Oleh karena itu, 210Po digunakan sebagai sumber panas atom untuk menggerakkan generator termoelektrik radioisotop melalui bahan termoelektrik.[4][16][64][65] Misalnya, sumber panas 210Po digunakan pada wahana penjelajah Bulan Lunokhod 1 (1970) dan Lunokhod 2 (1973) untuk menjaga komponen internalnya tetap hangat selama malam bulan, serta satelit Kosmos 84 dan 90 (1965).[62][66] Partikel alfa yang dipancarkan oleh polonium dapat diubah menjadi neutron menggunakan berilium oksida, dengan laju 93 neutron per juta partikel alfa.[64] Campuran Po-BeO digunakan sebagai sumber neutron pasif dengan rasio produksi sinar gama-ke-neutron sebesar 1,13 ± 0,05, lebih rendah daripada sumber neutron berbasis fisi nuklir.[67] Contoh campuran atau paduan Po-BeO yang digunakan sebagai sumber neutron adalah pemicu atau inisiator neutron untuk senjata nuklir[16][68] dan untuk inspeksi sumur minyak. Sekitar 1500 sumber jenis ini, dengan aktivitas individual sebesar 1.850 Ci (68 TBq), telah digunakan setiap tahun di Uni Soviet.[69] Polonium juga merupakan bagian dari kuas atau alat yang lebih rumit yang menghilangkan muatan statis pada pelat fotografi, pabrik tekstil, gulungan kertas, lembaran plastik, dan pada substrat (seperti otomotif) sebelum penerapan pelapisan.[70] Partikel alfa yang dipancarkan oleh polonium mengionisasi molekul udara yang menetralkan muatan pada permukaan terdekat.[71][72] Beberapa sikat antistatis mengandung hingga 500 microcurie (20 MBq) 210Po sebagai sumber partikel bermuatan untuk menetralkan listrik statis.[73] Di A.S., perangkat dengan tidak lebih dari 500 μCi (19 MBq) 210Po per unit (yang disegel) dapat dibeli dalam jumlah berapa pun di bawah "lisensi umum",[74] yang berarti pembeli tidak perlu didaftarkan oleh otoritas mana pun. Polonium perlu diganti di perangkat tersebut hampir setiap tahun karena waktu paruhnya yang pendek; ia juga sangat radioaktif dan oleh karena itu sebagian besar telah digantikan oleh sumber partikel beta yang lebih tidak berbahaya.[4] Sejumlah kecil 210Po kadang-kadang digunakan di laboratorium dan untuk tujuan pengajaran—biasanya sekitar 4–40 kBq (0,11–1,08 μCi), dalam bentuk sumber tersegel, dengan polonium diendapkan pada substrat atau dalam resin atau matriks polimer—sering dikecualikan dari lisensi oleh NRC dan otoritas serupa karena tidak dianggap berbahaya. Sejumlah kecil 210Po diproduksi untuk dijual ke publik di Amerika Serikat sebagai "sumber jarum" untuk eksperimen laboratorium, dan dijual eceran oleh perusahaan pemasok ilmiah. Polonium adalah lapisan pelapisan yang pada gilirannya dilapisi dengan bahan seperti emas, yang memungkinkan radiasi alfa (digunakan dalam eksperimen seperti bilik awan) untuk lewat sambil mencegah pelepasan polonium dan menghadirkan bahaya beracun.[butuh rujukan] Busi polonium dipasarkan oleh Firestone dari tahun 1940 hingga 1953. Walaupun jumlah radiasi dari busi sangat kecil dan bukan ancaman bagi konsumen, manfaat busi tersebut dengan cepat berkurang setelah sekitar satu bulan karena waktu paruh polonium yang pendek dan karena penumpukan pada konduktor akan memblokir radiasi yang meningkatkan kinerja mesin. (Alasan di balik busi polonium, serta steker radium prototipe Alfred Matthew Hubbard yang mendahuluinya, adalah bahwa radiasi akan meningkatkan ionisasi bahan bakar di dalam silinder dan dengan demikian memungkinkan motor menyala lebih cepat dan efisien.)[75][76] Biologi dan toksisitas IkhtisarPolonium dapat menjadi berbahaya dan tidak memiliki peran biologis.[16] Secara massa, polonium-210 sekitar 250.000 kali lebih beracun daripada hidrogen sianida (LD50 untuk 210Po kurang dari 1 mikrogram untuk orang dewasa rata-rata (lihat di bawah) dibandingkan dengan sekitar 250 miligram untuk hidrogen sianida[77]). Bahaya utamanya adalah radioaktivitasnya yang intens (sebagai pemancar alfa), yang membuatnya sulit ditangani dengan aman. Bahkan dalam jumlah mikrogram, penanganan 210Po sangatlah berbahaya, membutuhkan peralatan khusus (sebuah kotak sarung tangan bertekanan negatif yang dilengkapi dengan filter performa tinggi), pemantauan yang memadai, dan prosedur penanganan yang ketat untuk menghindari kontaminasi. Partikel alfa yang dipancarkan oleh polonium akan merusak jaringan organik dengan mudah jika polonium tertelan, terhirup, atau diserap, meskipun partikel alfa tidak dapat menembus epidermis dan karenanya tidak berbahaya selama partikel alfa tetap berada di luar tubuh. Mengenakan sarung tangan yang tahan bahan kimia dan utuh adalah tindakan pencegahan wajib untuk menghindari difusi polonium transkutan langsung melalui kulit. Polonium yang diberikan dalam asam nitrat pekat dapat dengan mudah berdifusi melalui sarung tangan yang tidak memadai (misalnya sarung tangan lateks) atau asam itu dapat merusak sarung tangan.[78] Polonium tidak memiliki sifat kimia beracun.[79] Telah dilaporkan bahwa beberapa mikroba dapat memetilasi polonium dengan aksi metilkobalamin.[80][81] Ini mirip dengan cara raksa, selenium, dan telurium dimetilasi pada makhluk hidup untuk membuat senyawa organologam. Studi menyelidiki metabolisme polonium-210 pada tikus telah menunjukkan bahwa hanya 0,002 sampai 0,009% dari polonium-210 yang tertelan diekskresikan sebagai polonium-210 volatil.[82] Efek akutMedian dosis letal (LD50) untuk paparan radiasi akut adalah sekitar 4,5 Sv.[83] Dosis efektif setara 210Po adalah 0,51 µSv/Bq jika tertelan, dan 2,5 µSv/Bq jika terhirup.[84] Dosis fatal 4,5 Sv dapat disebabkan oleh menelan 88 MBq (2.400 μCi), sekitar 50 nanogram (ng), atau menghirup 18 MBq (490 μCi), sekitar 10 ng. Satu gram 210Po secara teori dapat meracuni 20 juta orang, di antaranya 10 juta akan mati. Toksisitas sebenarnya dari 210Po lebih rendah dari perkiraan ini karena paparan radiasi yang tersebar selama beberapa minggu (waktu paruh biologis polonium pada manusia adalah 30 hingga 50 hari[85]) agak kurang merusak daripada dosis sesaat. Diperkirakan bahwa median dosis letal 210Po adalah 15 megabecquerel (0,41 mCi), atau 0,089 mikrogram (μg), jumlah yang masih sangat kecil.[86][87] Sebagai perbandingan, satu butir garam dapur adalah sekitar 0,06 mg = 60 μg.[88] Efek jangka panjang (kronis)Selain efek akut, paparan radiasi (baik internal maupun eksternal) membawa risiko kematian jangka panjang akibat kanker sebesar 5–10% per Sv.[83] Populasi umum terpapar polonium dalam jumlah kecil sebagai produk radon di udara dalam ruangan; isotop 214Po dan 218Po diperkirakan menyebabkan mayoritas[89] dari perkiraan 15.000–22.000 kematian akibat kanker paru-paru di A.S. setiap tahunnya yang dikaitkan dengan radon dalam ruangan.[90] Merokok dengan tembakau juga menyebabkan paparan tambahan polonium.[91] Batas paparan dan penanganan regulasiBeban tubuh maksimum yang diperbolehkan untuk menelan 210Po hanyalah 11 kBq (300 nCi), yang setara dengan massa partikel yang hanya 6,8 pikogram. Konsentrasi maksimum yang diizinkan di tempat kerja dari 210Po di udara adalah sekitar 10 Bq/m3 (3×10−10 µCi/cm3).[92] Organ target polonium pada manusia adalah limpa dan liver.[93] Karena limpa (150 g) dan liver (1,3 hingga 3 kg) jauh lebih kecil daripada bagian tubuh lainnya, jika polonium terkonsentrasi di organ vital ini, itu merupakan ancaman yang lebih besar bagi kehidupan daripada dosis (rata-rata) yang akan diderita oleh seluruh tubuh jika disebarkan secara merata ke seluruh tubuh, dengan cara yang sama seperti sesium atau tritium (sebagai T2O).[butuh rujukan] 210Po banyak digunakan dalam industri, dan tersedia dengan sedikit regulasi atau batasan.[butuh rujukan][94] Di A.S., sistem pelacakan yang dijalankan oleh Komisi Pengaturan Nuklir diterapkan pada tahun 2007 untuk mencatat pembelian lebih dari 16 curie (590 GBq) polonium-210 (cukup untuk membuat 5.000 dosis letal). IAEA "dikatakan sedang mempertimbangkan peraturan yang lebih ketat ... Ada pembicaraan bahwa mungkin akan memperketat persyaratan pelaporan polonium dengan faktor 10, menjadi 16 curie (590 GBq)."[95] Pada 2013, ini masih satu-satunya bahan produk sampingan yang memancarkan alfa yang tersedia, sebagai Kuantitas Pengecualian NRC, yang dapat diadakan tanpa lisensi bahan radioaktif.[butuh rujukan] Polonium dan senyawanya harus ditangani dalam kotak sarung tangan, yang selanjutnya ditutup dalam kotak lain, dijaga pada tekanan yang sedikit lebih tinggi daripada kotak sarung tangan untuk mencegah kebocoran bahan radioaktif. Sarung tangan yang terbuat dari karet alam tidak memberikan perlindungan yang memadai terhadap radiasi dari polonium; sarung tangan bedah diperlukan. Sarung tangan neoprena melindungi radiasi dari polonium lebih baik daripada karet alam.[96] Kasus keracunanTerlepas dari sifat polonium yang sangat berbahaya, keadaan di mana keracunan polonium dapat terjadi, jarang terjadi. Sifatnya yang sangat langka, waktu paruh semua isotopnya yang pendek, fasilitas dan peralatan khusus yang diperlukan untuk mendapatkan kuantitas yang signifikan, dan tindakan pencegahan keselamatan terhadap kecelakaan laboratorium, membuat peristiwa paparan yang berbahaya tidak mungkin terjadi. Dengan demikian, hanya segelintir kasus keracunan radiasi yang secara khusus disebabkan oleh paparan polonium telah dikonfirmasi.[butuh rujukan] Abad ke-20Menanggapi kekhawatiran tentang risiko paparan polonium di tempat kerja, jumlah 210Po diberikan kepada lima sukarelawan manusia di Universitas Rochester dari tahun 1944 hingga 1947, untuk mempelajari perilaku biologisnya. Studi-studi ini didanai oleh Proyek Manhattan dan AEC. Empat pria dan seorang wanita berpartisipasi, semuanya menderita kanker stadium akhir, dan berusia antara awal tiga puluhan hingga awal empat puluhan; semuanya dipilih karena peneliti menginginkan subjek yang tidak terpapar polonium baik melalui pekerjaan atau kecelakaan.[97] 210Po disuntikkan ke empat pasien rawat inap, dan secara oral diberikan kepada pasien kelima. Tak satu pun dari dosis yang diberikan (semua mulai dari 0,17 hingga 0,30 μCi kg−1) mendekati jumlah yang fatal.[97][98] Kematian pertama yang terdokumentasi secara langsung akibat keracunan polonium terjadi di Uni Soviet, pada 10 Juli 1954.[99][100] Seorang pria berusia 41 tahun yang tidak dikenal datang untuk perawatan medis pada tanggal 29 Juni, dengan muntah dan demam yang parah; hari sebelumnya, dia telah bekerja selama lima jam di area di mana, tanpa dia ketahui, sebuah kapsul berisi 210Po telah mengalami penurunan tekanan dan mulai menyebar dalam bentuk aerosol. Selama periode ini, total asupan 210Po di udara diperkirakan mencapai 0,11 GBq (hampir 25 kali perkiraan LD50 jika dihirup sebesar 4,5 MBq). Meski dirawat, kondisinya terus memburuk dan dia meninggal 13 hari setelah kejadian paparan.[99] Juga dikemukakan bahwa kematian Irène Joliot-Curie pada tahun 1956 akibat leukemia disebabkan oleh efek radiasi polonium. Dia secara tidak sengaja terekspos pada tahun 1946 ketika sebuah kapsul polonium yang tersegel meledak di bangku laboratoriumnya.[101] Selain itu, beberapa kematian di Israel selama 1957–1969 diduga berasal dari paparan 210Po.[102] Sebuah kebocoran ditemukan di laboratorium Institut Weizmann pada tahun 1957. Jejak 210Po ditemukan di tangan Profesor Dror Sadeh, fisikawan yang meneliti bahan radioaktif. Tes medis menunjukkan tidak adanya bahaya, tetapi tes tersebut tidak termasuk sumsum tulang. Sadeh, salah satu muridnya, dan dua rekannya meninggal karena berbagai penyakit kanker selama beberapa tahun berikutnya. Masalahnya diselidiki secara diam-diam, tetapi tidak pernah ada pengakuan resmi tentang hubungan antara kebocoran dan kematian.[103] Abad ke-21Penyebab kematian Alexander Litvinenko di tahun 2006, mantan agen FSB Rusia yang membelot ke Britania Raya pada tahun 2001, diidentifikasi keracunan dengan dosis 210Po letal;[104][105] kemudian ditentukan bahwa 210Po mungkin sengaja diberikan kepadanya oleh dua mantan agen keamanan Rusia, Andrey Lugovoy dan Dmitry Kovtun.[106][107] Dengan demikian, kematian Litvinenko adalah kejadian pertama (dan, sampai saat ini, satu-satunya) yang dikonfirmasi di mana toksisitas ekstrim polonium telah digunakan dengan niat jahat.[108][109][110] Pada tahun 2011, muncul dugaan bahwa kematian pemimpin Palestina Yasser Arafat, yang meninggal pada tanggal 11 November 2004 tanpa sebab yang pasti, juga diakibatkan oleh keracunan polonium yang disengaja,[111][112] dan pada bulan Juli 2012, konsentrasi 210Po yang sangat tinggi terdeteksi dalam pakaian dan barang-barang pribadi Arafat oleh Institut de Radiophysique di Lausanne, Swiss.[113][114] Namun, juru bicara Institut menekankan bahwa terlepas dari tes ini, laporan medis Arafat tidaklah konsisten dengan keracunan 210Po,[114] dan jurnalis sains Deborah Blum menyatakan bahwa asap tembakau mungkin lebih bertanggung jawab, karena Arafat dan banyak rekannya adalah perokok berat;[115] tes selanjutnya oleh tim Prancis dan Rusia menetapkan bahwa peningkatan kadar 210Po bukanlah hasil dari keracunan yang disengaja, dan tidak menyebabkan kematian Arafat.[116][117] Ada juga dugaan bahwa Roman Tsepov diracun dengan polonium. Dia memiliki gejala yang mirip dengan Aleksander Litvinenko.[118] PengobatanTelah dikemukakan bahwa agen pengelat, seperti British Anti-Lewisite (dimerkaprol), dapat digunakan untuk mendekontaminasi manusia.[119] Dalam satu percobaan, tikus diberi dosis fatal 1,45 MBq/kg (8,7 ng/kg) 210Po; semua tikus yang tidak diobati mati setelah 44 hari, tetapi 90% tikus yang diobati dengan agen pengelat HOEtTTC tetap hidup selama 5 bulan.[120] Deteksi dalam spesimen biologisPolonium-210 dapat dihitung dalam spesimen biologis dengan spektrometri partikel alfa untuk mengonfirmasi diagnosis keracunan pada pasien rawat inap atau untuk memberikan bukti dalam investigasi kematian medikolegal. Ekskresi urin polonium-210 dasar pada orang sehat karena paparan rutin terhadap sumber lingkungan biasanya berkisar antara 5–15 mBq/hari. Tingkat yang melebihi 30 mBq/hari menunjukkan paparan radionuklida yang berlebihan.[121] Keterjadian pada manusia dan biosferPolonium-210 tersebar luas di biosfer, termasuk di jaringan manusia, karena posisinya dalam rantai peluruhan uranium-238. Uranium-238 alami di kerak Bumi meluruh melalui serangkaian perantara radioaktif padat termasuk radium-226 hingga gas mulia radioaktif radon-222, beberapa di antaranya, selama waktu paruh 3,8 hari, berdifusi ke atmosfer. Di sana ia meluruh melalui beberapa tahap lagi menjadi polonium-210, yang sebagian besar, selama waktu paruh 138 hari, tersapu kembali ke permukaan Bumi, lalu memasuki biosfer, sebelum akhirnya meluruh menjadi timbal-206 yang stabil.[122][123][124] Pada awal tahun 1920-an, ahli biologi Prancis Antoine Lacassagne, dengan menggunakan polonium yang disediakan oleh rekannya Marie Curie, menunjukkan bahwa unsur tersebut memiliki pola serapan tertentu pada jaringan kelinci, dengan konsentrasi tinggi, terutama di hati, ginjal, dan testis.[125] Bukti yang lebih baru menunjukkan bahwa perilaku ini dihasilkan dari polonium yang menggantikan kongenernya belerang, juga dalam golongan 16 dari tabel periodik, dalam asam amino yang mengandung belerang atau molekul terkait[126] dan bahwa pola distribusi yang serupa terjadi pada jaringan manusia.[127] Polonium memang merupakan unsur yang secara alami ada pada semua manusia, berkontribusi cukup besar terhadap dosis latar alami, dengan variasi geografis dan budaya yang luas, dan tingkat yang sangat tinggi pada penduduk Arktik, misalnya.[128] TembakauPolonium-210 dalam tembakau berkontribusi pada banyak kasus kanker paru-paru di seluruh dunia. Sebagian besar polonium ini berasal dari timbal-210 yang tersimpan di daun tembakau dari atmosfer; timbal-210 adalah produk gas radon-222, yang sebagian besar tampaknya berasal dari peluruhan radium-226 dari pupuk yang diberikan pada tanah tembakau.[53][129][130][131][132] Kehadiran polonium dalam asap tembakau telah diketahui sejak awal 1960-an.[133][134] Beberapa perusahaan tembakau terbesar di dunia meneliti cara untuk menghilangkan zat tersebut—tanpa hasil—selama periode 40 tahun. Hasilnya tidak pernah dipublikasikan.[53] MakananPolonium ditemukan dalam rantai makanan, terutama dalam makanan laut.[135][136] Lihat pulaReferensi
Bibliografi
Pranala luarWikimedia Commons memiliki media mengenai Polonium. Lihat entri Polonium di kamus bebas Wiktionary.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



