|
Radium
Radium adalah sebuah unsur kimia dengan lambang Ra dan nomor atom 88. Radium merupakan unsur golongan 2 keenam dalam tabel periodik, juga dikenal sebagai logam alkali tanah. Radium murni berwarna putih keperakan, tetapi mudah bereaksi dengan nitrogen (daripada oksigen) saat terpapar udara, membentuk radium nitrida (Ra3N2) dengan lapisan permukaan hitam. Semua isotop radium bersifat radioaktif, dengan yang paling stabil adalah radium-226 dengan waktu paruh 1.600 tahun. Ketika radium meluruh, ia memancarkan radiasi pengion sebagai produk sampingan, yang dapat menimbulkan bahan kimia fluoresen dan menyebabkan radioluminesen. Radium, dalam bentuk radium klorida, ditemukan oleh Marie dan Pierre Curie pada tahun 1898 dari bijih yang ditambang di Jáchymov. Mereka mengekstraksi senyawa radium dari uraninit dan menerbitkan penemuan tersebut di Akademi Sains Prancis lima hari kemudian. Radium diisolasi dalam bentuk logamnya oleh Marie Curie dan André-Louis Debierne melalui elektrolisis radium klorida pada tahun 1911.[2] Di alam, radium ditemukan dalam bijih uranium dan (pada tingkat yang lebih rendah) torium dalam jumlah renik sekecil sepertujuh gram per ton uraninit. Radium tidak diperlukan untuk makhluk hidup, dan efek kesehatan yang merugikan mungkin terjadi ketika dimasukkan ke dalam proses biokimia karena radioaktivitas dan reaktivitas kimianya. Sejak tahun 2014, selain penggunaannya dalam kedokteran nuklir, radium tidak memiliki aplikasi komersial. Sebelumnya, sekitar tahun 1950-an, ia digunakan sebagai sumber radioaktif untuk perangkat radioluminesen dan juga dalam perdukunan radioaktif karena kekuatan penyembuhannya. Aplikasi ini tidak digunakan lagi karena toksisitas radium; hingga tahun 2020, isotop yang kurang berbahaya (dari unsur lain) malah digunakan dalam perangkat radioluminesen. Sifat fisikRadium adalah logam alkali tanah terberat yang diketahui dan merupakan satu-satunya anggota yang bersifat radioaktif dari golongannya. Sifat fisik dan kimianya paling mirip dengan kongenernya yang lebih ringan, barium.[3] Radium murni adalah logam volatil yang berwarna putih keperakan, meskipun kongenernya yang lebih ringan seperti kalsium, stronsium, dan barium memiliki sedikit warna kuning.[3] Rona ini dengan cepat menghilang saat terpapar udara, menghasilkan lapisan hitam yang mungkin merupakan radium nitrida (Ra3N2).[4] Titik leburnya adalah 700 °C (1.292 °F) atau 960 °C (1.760 °F)[a] dan titik didihnya adalah 1.737 °C (3.159 °F); namun, nilai ini belumlah mapan.[5] Kedua nilai ini sedikit lebih rendah daripada barium, membenarkan tren periodik ke bawah unsur-unsur golongan 2.[6] Seperti barium dan logam alkali, radium mengkristal dalam struktur kubus berpusat-badan pada temperatur dan tekanan standar: jarak ikatan radium–radium adalah 514,8 pikometer.[7] Radium memiliki massa jenis sebesar 5,5 g/cm3, lebih tinggi dari barium, sekali lagi membenarkan tren periodik; rasio massa jenis radium–barium sebanding dengan rasio massa atom radium–barium,[8] karena struktur kristal kedua unsur tersebut yang mirip.[8][9] Sifat kimiaRadium, seperti barium, adalah logam yang sangat reaktif dan selalu menunjukkan keadaan oksidasi +2 seperti unsur golongan 2 lainnya.[4] Ia membentuk kation Ra2+ yang nirwarna dalam larutan berair, yang sangat basa dan tidak mudah membentuk kompleks.[4] Sebagian besar senyawa radium merupakan senyawa ionik sederhana,[4] meskipun diperkirakan adanya partisipasi dari elektron 6s dan 6p (selain elektron valensi 7s) karena efek relativistik dan akan meningkatkan karakter kovalen senyawa radium seperti RaF2 dan RaAt2.[10] Untuk alasan ini, potensial elektroda standar untuk setengah reaksi Ra2+ (aq) + 2e− → Ra (s) adalah −2,916 V, bahkan sedikit lebih rendah dari nilai −2,92 V untuk barium, sedangkan nilai sebelumnya naik dengan halus ke bawah golongan (Ca: −2,84 V; Sr: −2,89 V; Ba: −2,92 V).[11] Nilai barium dan radium hampir persis sama dengan logam alkali yang lebih berat, kalium, rubidium, dan sesium.[11] SenyawaSenyawa radium padat berwarna putih karena ion radium tidak memberikan pewarnaan khusus, tetapi secara bertahap berubah menjadi kuning dan kemudian menjadi gelap seiring waktu karena radiolisis sendiri dari peluruhan alfa radium.[4] Senyawa radium yang tak larut berkopresipitasi dengan semua senyawa barium, sebagian besar stronsium, dan sebagian besar timbal.[12] Radium oksida (RaO) belum dicirikan jauh melewati keberadaannya, meskipun oksida menjadi senyawa umum untuk logam alkali tanah lainnya. Radium hidroksida (Ra(OH)2) adalah yang paling mudah larut di antara hidroksida alkali tanah dan merupakan basa yang lebih kuat daripada kongener bariumnya, barium hidroksida.[13] Ia juga lebih mudah larut daripada aktinium hidroksida dan torium hidroksida: ketiga hidroksida yang berdekatan ini dapat dipisahkan dengan mengendapkannya dengan amonia.[13] Radium klorida (RaCl2) adalah senyawa nirwarna dan bercahaya. Ia menjadi kuning setelah beberapa waktu karena pengrusakan diri akibat radiasi alfa yang dilepaskan oleh radium ketika meluruh. Sejumlah kecil pengotor barium memberikan warna mawar pada senyawa tersebut.[13] Ia larut dalam air, meskipun kurang dari barium klorida, dan kelarutannya menurun dengan meningkatnya konsentrasi asam klorida. Kristalisasi dari larutan encer menghasilkan dihidrat RaCl2·2H2O, isomorf dengan analog bariumnya.[13] Radium bromida (RaBr2) juga merupakan senyawa nirwarna dan bercahaya.[13] Dalam air, ia lebih larut daripada radium klorida. Seperti radium klorida, kristalisasi dari larutan encer menghasilkan dihidrat RaBr2·2H2O, isomorf dengan analog bariumnya. Radiasi pengion yang dipancarkan oleh radium bromida mengeksitasi molekul nitrogen di udara, membuatnya bercahaya. Partikel alfa yang dipancarkan oleh radium dengan cepat mendapatkan dua elektron untuk menjadi helium netral, yang menumpuk di dalam dan melemahkan kristal radium bromida. Efek ini terkadang menyebabkan kristal itu pecah atau bahkan meledak.[13] Radium nitrat (Ra(NO3)2) adalah senyawa berwarna putih yang dapat dibuat dengan melarutkan radium karbonat dalam asam nitrat. Dengan meningkatnya konsentrasi asam nitrat, kelarutan radium nitrat menurun, suatu sifat penting untuk pemurnian radium secara kimia.[13] Radium membentuk garam tak larut yang hampir sama dengan barium, kongenernya yang lebih ringan: ia membentuk sulfat (RaSO4, sulfat yang diketahui paling tak larut), kromat (RaCrO4), karbonat (RaCO3), iodat (Ra(IO3)2), tetrafluoroberilat (RaBeF4), dan nitrat (Ra(NO3)2). Dengan pengecualian karbonat, semua garam ini kurang larut dalam air dibandingkan dengan garam barium yang sesuai, tetapi semuanya bersifat isostruktural dibandingkan rekan bariumnya. Selain itu, radium fosfat, oksalat, dan sulfit mungkin juga tak larut, karena mereka berkopresipitasi dengan garam barium tak larut yang sesuai.[14] Ketidaklarutan radium sulfat yang tinggi (pada suhu 20 °C, hanya 2,1 mg yang akan larut dalam 1 kg air) mengartikan bahwa ia adalah salah satu senyawa radium yang kurang berbahaya secara biologis.[15] Jari-jari ionik Ra2+ yang besar (148 pm) menghasilkan kompleksasi yang lemah dan ekstraksi radium yang buruk dari larutan berair ketika pH-nya tidak tinggi.[16] Isotop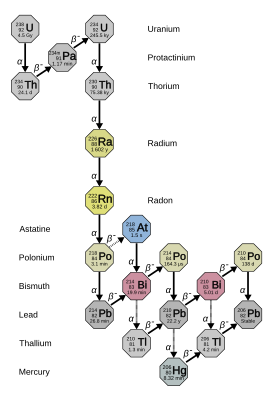 Radium memiliki 33 isotop yang diketahui, dengan nomor massa dari 202 hingga 234: semuanya bersifat radioaktif.[17] Empat di antaranya – 223Ra (waktu paruh 11,4 hari), 224Ra (3,64 hari), 226Ra (1600 tahun), dan 228Ra (5,75 tahun) – terjadi secara alami dalam rantai peluruhan torium-232, uranium-235, dan uranium-238 yang primordial (223Ra dari uranium-235, 226Ra dari uranium-238, dan dua lainnya dari torium-232). Namun, isotop-isotop ini masih memiliki waktu paruh yang terlalu pendek untuk menjadi radionuklida primordial dan hanya ada di alam dari rantai peluruhan ini.[18] Bersama dengan 225Ra yang sebagian besar dibuat oleh manusia (15 hari), yang terjadi di alam hanya sebagai produk peluruhan neptunium-237 dalam jumlah jejak,[19] mereka adalah lima isotop radium yang paling stabil.[20] Semua 27 isotop radium lainnya yang diketahui memiliki waktu paruh di bawah dua jam, dan sebagian besar memiliki waktu paruh di bawah satu menit.[17] Setidaknya 12 isomer nuklir telah dilaporkan; yang paling stabil adalah radium-205m, dengan waktu paruh antara 130 dan 230 milidetik; ini masih lebih pendek dari dua puluh empat isotop radium keadaan dasar.[17] Dalam sejarah awal studi radioaktivitas, berbagai isotop alami radium diberi nama yang berbeda. Dalam skema ini, 223Ra diberi nama aktinium X (AcX), 224Ra torium X (ThX), 226Ra radium (Ra), dan 228Ra mesotorium 1 (MsTh1).[18] Ketika diketahui bahwa semua ini adalah isotop dari unsur yang sama, banyak dari nama ini tidak digunakan lagi, dan "radium" merujuk pada semua isotop, bukan hanya 226Ra. Beberapa produk peluruhan radium-226 menerima nama historis termasuk "radium", mulai dari radium A hingga radium G, dengan huruf yang menunjukkan kira-kira seberapa jauh mereka menuruni rantai dari induknya 226Ra. Radium emanation = 222Rn, RaA = 218Po, RaB = 214Pb, RaC = 214Bi, RaC1 = 214Po, RaC2 = 210Tl, RaD = 210Pb, RaE = 210Bi, RaF = 210Po dan RaG = 206Pb.[20][21] 226Ra adalah isotop radium yang paling stabil dan merupakan isotop terakhir dalam rantai peluruhan uranium-238 (4n + 2) dengan waktu paruh lebih dari satu milenium: ia membentuk hampir semua radium alami. Produk peluruhan langsungnya adalah gas mulia radioaktif padat radon (secara spesifik isotop 222Rn), yang bertanggung jawab atas banyak bahaya radium lingkungan.[22] Ia 2,7 juta kali lebih radioaktif daripada jumlah molar uranium alami yang sama (kebanyakan uranium-238), karena waktu paruhnya yang secara proporsional lebih pendek.[23][24] Sampel logam radium mempertahankan dirinya pada suhu yang lebih tinggi daripada lingkungannya karena radiasi yang dipancarkannya – partikel alfa, partikel beta, dan sinar gama. Lebih spesifik lagi, radium alami (yang sebagian besar adalah 226Ra) sebagian besar memancarkan partikel alfa, tetapi langkah-langkah lain dalam rantai peluruhannya (deret uranium atau radium) memancarkan partikel alfa atau beta, dan hampir semua emisi partikel disertai dengan sinar gama.[25] Pada tahun 2013 di CERN, ditemukan bahwa inti radium-224 berbentuk buah pir menggunakan teknik yang disebut eksitasi Coulomb. Ini adalah penemuan pertama dari inti asimetris.[26] Ini adalah bukti kuat bahwa inti atom tertentu yang berat dan tidak stabil telah mengubah inti menjadi, dalam hal ini, berbentuk buah pir.[27] KeterjadianSemua isotop radium memiliki waktu paruh yang jauh lebih pendek daripada usia Bumi, sehingga setiap radium primordial telah meluruh sejak lama. Meskipun demikian, radium masih terdapat di lingkungan, karena isotop 223Ra, 224Ra, 226Ra, dan 228Ra merupakan bagian dari rantai peluruhan isotop torium dan uranium alami; karena torium dan uranium memiliki waktu paruh yang sangat panjang, produk-produk ini terus-menerus diregenerasi dari peluruhannya.[18] Dari keempat isotop ini, yang berumur paling panjang adalah 226Ra (waktu paruh 1600 tahun), sebuah produk peluruhan uranium alami. Karena umurnya yang relatif panjang, 226Ra adalah isotop yang paling umum dari unsur tersebut, membentuk sekitar satu bagian per triliun kerak Bumi; pada dasarnya semua radium alami adalah 226Ra.[28] Dengan demikian, radium ditemukan dalam jumlah kecil dalam bijih uranium uraninit dan berbagai mineral uranium lainnya, dan bahkan dalam jumlah yang lebih kecil dalam mineral torium. Satu ton uraninit biasanya menghasilkan sekitar sepertujuh gram radium.[29] Satu kilogram kerak Bumi mengandung sekitar 900 pikogram radium, dan satu liter air laut mengandung sekitar 89 femtogram radium.[30] Sejarah  Radium ditemukan oleh Marie Skłodowska-Curie dan suaminya Pierre Curie pada tanggal 21 Desember 1898, dalam sampel uraninit dari Jáchymov.[31] Saat mempelajari mineral sebelumnya, Curie mengeluarkan uranium darinya dan menemukan bahwa bahan yang tersisa masih bersifat radioaktif. Pada Juli 1898, saat mempelajari bijih-bijih uranium, mereka mengisolasi unsur yang mirip dengan bismut yang ternyata adalah polonium. Mereka kemudian mengisolasi campuran radioaktif yang terdiri dari dua komponen: senyawa barium, yang memberikan warna nyala api hijau cemerlang, dan senyawa radioaktif tak dikenal yang memberikan garis spektrum berwarna merah serah yang belum pernah didokumentasikan sebelumnya. Curie menemukan senyawa radioaktif yang sangat mirip dengan senyawa barium, hanya saja mereka kurang larut. Penemuan ini memungkinkan Curie mengisolasi senyawa radioaktif dan menemukan unsur baru di dalamnya. Curie mengumumkan penemuan mereka ke Akademi Sains Prancis pada 26 Desember 1898.[32][33] Penamaan radium berasal dari sekitar tahun 1899, dari kata dalam bahasa Prancis radium, terbentuk dalam bahasa Latin Modern dari radius (sinar): ini sebagai pengakuan atas kekuatan radium dalam memancarkan energi dalam bentuk sinar.[34][35][36] Pada bulan September 1910, Marie Curie dan André-Louis Debierne mengumumkan bahwa mereka telah mengisolasi radium sebagai logam murni melalui elektrolisis larutan radium klorida (RaCl2) murni menggunakan katoda raksa, menghasilkan amalgam radium–raksa.[37] Amalgam ini kemudian dipanaskan dalam atmosfer gas hidrogen untuk menghilangkan raksa, meninggalkan logam radium murni.[38] Kemudian pada tahun yang sama, E. Eoler mengisolasi radium dengan dekomposisi termal azidanya, Ra(N3)2.[18] Logam radium pertama kali diproduksi secara industri pada awal abad ke-20 oleh Biraco, anak perusahaan dari Union Minière du Haut Katanga (UMHK) di pabriknya yang berada di Olen, Belgia.[39] Satuan historis umum untuk radioaktivitas, curie, didasarkan pada radioaktivitas 226Ra: satuan ini awalnya didefinisikan sebagai radioaktivitas satu gram radium-226,[40] tetapi definisi tersebut kemudian sedikit disempurnakan menjadi 3,7×1010 disintegrasi per detik. Aplikasi historisCat bercahaya Radium sebelumnya digunakan dalam cat bercahaya sendiri untuk arloji, panel nuklir, saklar pesawat, jam, dan instrumen pelat jam. Arloji bercahaya sendiri biasa yang menggunakan cat radium mengandung sekitar 1 mikrogram radium.[41] Pada pertengahan 1920-an, gugatan diajukan terhadap United States Radium Corporation oleh lima "Gadis Radium" yang sekarat – pelukis pelat jam yang telah melukis cat bercahaya berbasis radium pada pelat arloji dan jam. Para pelukis pelat jam diinstruksikan untuk menjilat kuas mereka untuk memberi mereka titik halus, sehingga mereka menelan radium.[42] Paparan mereka terhadap radium menyebabkan efek kesehatan yang serius termasuk luka, anemia, dan kanker tulang.[22] Selama litigasi, ditentukan bahwa para ilmuwan dan manajemen perusahaan telah mengambil tindakan pencegahan yang cukup untuk melindungi diri dari efek radiasi, tetapi tampaknya tidak melindungi karyawan mereka. Selain itu, selama beberapa tahun perusahaan telah berusaha menutupi efek dan menghindari tanggung jawab dengan bersikeras bahwa Gadis Radium menderita sifilis. Pengabaian total terhadap kesejahteraan karyawan ini berdampak signifikan pada perumusan UU ketenagakerjaan penyakit akibat pekerjaan.[43] Sebagai hasil dari gugatan tersebut, efek merugikan dari radioaktivitas diketahui secara luas, dan pelukis pelat jam radium diinstruksikan untuk melakukan tindakan pencegahan keselamatan yang tepat dan dilengkapi dengan alat pelindung. Secara khusus, pelukis pelat jam tidak lagi menjilat kuas cat untuk membentuknya (yang menyebabkan beberapa garam radium tertelan). Radium masih digunakan pada pelat jam hingga tahun 1960-an, tetapi tidak ada cedera lebih lanjut pada pelukis pelat jam. Hal ini menyoroti bahwa bahaya yang dialami Gadis Radium dapat dengan mudah dihindari.[44] Sejak tahun 1960-an penggunaan cat radium dihentikan. Dalam banyak kasus, pelat jam bercahaya diimplementasikan dengan bahan fluoresen nonradioaktif yang dieksitasi oleh cahaya; perangkat seperti itu bersinar dalam gelap setelah terpapar cahaya, tetapi cahayanya memudar.[22] Di mana dibutuhkan luminositas sendiri yang tahan lama dalam kegelapan, cat radioaktif prometium-147 (waktu paruh 2,6 tahun) atau tritium (waktu paruh 12 tahun) lebih aman digunakan; keduanya terus digunakan hingga tahun 2004.[45] Keduanya memiliki keuntungan tambahan, yaitu tidak menurunkan fosfor dari waktu ke waktu, tidak seperti radium.[46] Tritium memancarkan radiasi beta berenergi sangat rendah (bahkan berenergi lebih rendah daripada radiasi beta yang dipancarkan oleh prometium)[17] yang tidak dapat menembus kulit,[47] dan bukan radiasi gama yang memenetrasi seperti radium, serta dianggap lebih aman.[48] Jam, arloji, dan instrumen yang berasal dari paruh pertama abad ke-20, seringkali dalam aplikasi militer, mungkin dicat dengan cat bercahaya radioaktif. Mereka biasanya tidak lagi bercahaya; namun, ini bukan karena peluruhan radioaktif radium (yang memiliki waktu paruh 1600 tahun) tetapi karena fluoresensi dari media fluoresen, seng sulfida, yang aus oleh radiasi dari radium.[49] Munculnya lapisan cat hijau atau coklat kekuningan yang seringkali tebal pada perangkat dari periode ini menunjukkan adanya bahaya radioaktif. Dosis radiasi dari perangkat yang utuh relatif rendah dan biasanya bukan merupakan risiko akut; namun cat tersebut akan menjadi berbahaya jika terlepas dan terhirup atau tertelan.[5][50] Penggunaan medis Radium (biasanya dalam bentuk radium klorida atau bromida) digunakan dalam pengobatan untuk menghasilkan gas radon, yang selanjutnya digunakan sebagai pengobatan kanker; misalnya, beberapa sumber radon ini digunakan di Kanada pada tahun 1920-an dan 1930-an.[5][51] Namun, banyak perawatan yang digunakan pada awal 1900-an tidak digunakan lagi karena efek berbahaya yang ditimbulkan oleh paparan radium bromida. Beberapa contoh efek ini adalah anemia, kanker, dan mutasi genetik.[52] Hingga tahun 2011, pemancar gama yang lebih aman seperti 60Co, yang lebih murah dan tersedia dalam jumlah yang lebih besar, biasanya digunakan untuk menggantikan penggunaan radium dalam aplikasi ini.[16] Di awal tahun 1900-an, ahli biologi menggunakan radium untuk menginduksi mutasi dan mempelajari genetika. Pada awal tahun 1904, Daniel MacDougal menggunakan radium dalam upaya untuk menentukan apakah radium dapat memicu mutasi besar secara tiba-tiba dan menyebabkan perubahan evolusi besar. Thomas Hunt Morgan menggunakan radium untuk menginduksi perubahan yang menghasilkan lalat buah bermata putih. Ahli biologi pemenang Nobel Hermann Muller secara singkat mempelajari efek radium pada mutasi lalat buah sebelum beralih ke eksperimen sinar-X yang lebih terjangkau.[53] Howard Atwood Kelly, salah satu dokter pendiri Rumah Sakit Johns Hopkins, adalah pelopor utama dalam penggunaan medis radium untuk mengobati kanker.[54] Pasien pertamanya adalah bibinya sendiri pada tahun 1904, yang meninggal tak lama setelah operasi.[55] Kelly diketahui menggunakan radium dalam jumlah berlebihan untuk mengobati berbagai jenis kanker dan tumor. Akibatnya, beberapa pasiennya meninggal akibat paparan radium.[56] Metode pengaplikasian radiumnya adalah memasukkan kapsul radium di dekat area yang terkena, lalu menjahit "titik" radium langsung ke tumor.[56] Ini adalah metode yang sama yang digunakan untuk mengobati Henrietta Lacks, inang dari sel HeLa asli, untuk kanker serviks.[57] Hingga tahun 2015, radioisotop yang lebih aman dan lebih tersedia digunakan sebagai gantinya.[22] Produksi Uranium tidak memiliki aplikasi skala besar pada akhir abad ke-19, dan oleh karena itu tidak ada tambang uranium besar. Pada awalnya, satu-satunya sumber bijih uranium yang besar adalah tambang perak di Jáchymov, Austria-Hungaria (sekarang Republik Ceko).[31] Bijih uranium hanya menjadi produk sampingan dari kegiatan penambangan.[58] Dalam ekstraksi radium pertama, Curie menggunakan residu setelah ekstraksi uranium dari bijih uranium. Uranium telah diekstraksi dengan pelarutan dalam asam sulfat meninggalkan radium sulfat, yang mirip dengan barium sulfat tetapi bahkan kurang larut dalam residu. Residu itu juga mengandung sejumlah besar barium sulfat yang dengan demikian bertindak sebagai pembawa radium sulfat. Langkah pertama dari proses ekstraksi radium melibatkan perebusan dengan natrium hidroksida, diikuti dengan penambahan asam klorida untuk meminimalkan pengotor dari senyawa lain. Residu yang tersisa kemudian diolah dengan natrium karbonat untuk mengubah barium sulfat menjadi barium karbonat (membawa radium), sehingga membuatnya larut dalam asam klorida. Setelah proses disolusi, barium dan radium diendapkan kembali sebagai sulfat; ini kemudian diulangi untuk lebih memurnikan campuran sulfat. Beberapa pengotor yang membentuk sulfida yang tidak larut dihilangkan dengan mengolah larutan klorida dengan hidrogen sulfida, diikuti dengan penyaringan. Ketika sulfat campuran itu cukup murni, mereka sekali lagi diubah menjadi klorida campuran; barium dan radium kemudian dipisahkan melalui kristalisasi fraksional sambil memantau perkembangannya menggunakan spektroskop (radium memberikan garis merah yang khas, berbeda dengan garis barium yang berwarna hijau), dan elektroskop.[59] Setelah isolasi radium oleh Marie dan Pierre Curie dari bijih uranium dari Jáchymov, beberapa ilmuwan mulai mengisolasi radium dalam jumlah kecil. Kemudian, beberapa perusahaan kecil membeli tailing tambang dari tambang Jáchymov dan mulai mengisolasi radium. Pada tahun 1904, pemerintah Austria menasionalisasi tambang itu dan berhenti mengekspor bijih mentah. Hingga tahun 1912 ketika produksi radium meningkat, ketersediaan radium menjadi rendah.[58] Pembentukan monopoli Austria dan desakan kuat dari negara lain untuk memiliki akses ke radium menyebabkan pencarian bijih uranium di seluruh dunia. Amerika Serikat mengambil alih sebagai produsen utama pada awal 1910-an. Pasir Carnotit di Colorado menyediakan beberapa uranium dan radium, tetapi bijih yang lebih kaya ditemukan di Kongo serta area Danau Beruang Besar dan Danau Budak Besar di barat laut Kanada. Tak satu pun dari deposit tersebut ditambang untuk radium, tetapi kandungan uraniumnya membuat penambangan itu menjadi menguntungkan.[31][60] Proses Curie masih digunakan untuk ekstraksi radium industri pada tahun 1940, tetapi campuran bromida kemudian digunakan untuk fraksionasi. Jika kandungan barium dari bijih uranium tidak cukup tinggi, maka mudah untuk menambahkan barium untuk membawa radium. Proses ini diterapkan pada bijih uranium tingkat tinggi tetapi mungkin tidak bekerja dengan baik dengan bijih tingkat rendah.[61] Sejumlah kecil radium masih diekstraksi dari bijih uranium dengan metode pengendapan campuran dan pertukaran ion hingga akhir tahun 1990-an,[28] tetapi pada tahun 2011, radium diekstraksi hanya dari bahan bakar nuklir bekas.[62] Pada tahun 1954, total pasokan radium murni di seluruh dunia berjumlah sekitar 5 pon (2,3 kg)[41] dan masih dalam kisaran ini pada tahun 2015, sedangkan produksi tahunan senyawa radium murni hanya sekitar 100 g secara total pada tahun 1984.[28] Negara penghasil radium utama adalah Belgia, Kanada, Republik Ceko, Slowakia, Britania Raya, dan Rusia.[28] Jumlah radium yang dihasilkan selalu relatif kecil; misalnya, pada tahun 1918, 13,6 g radium diproduksi di Amerika Serikat.[63] Logam radium diisolasi dengan mereduksi radium oksida dengan logam aluminium dalam ruang hampa pada suhu 1.200 °C.[16] Aplikasi modern Penggunaan radium mengalami peningkatan di bidang fisika atomik, molekul, dan optik. Skala gaya pemecah simetri sebanding dengan ,[64][65] yang membuat radium, unsur alkali tanah terberat, cocok untuk membatasi fisika baru di luar model standar. Beberapa isotop radium, seperti radium-225, memiliki doublet paritas terdeformasi oktupol yang meningkatkan sensitivitas terhadap pelanggaran paritas muatan fisika baru dengan dua hingga tiga kali lipat dibandingkan dengan 199Hg.[66][67][68] Radium juga merupakan kandidat yang menjanjikan untuk jam optis ion terperangkap. Ion radium memiliki dua transisi lebargaris-subhertz (subhertz-linewidth) dari keadaan dasar yang dapat berfungsi sebagai transisi jam dalam jam optis.[69] Jam atom ion 226Ra+ terperangkap telah didemonstrasikan pada transisi ke .[70] Selain itu, radium sangat cocok untuk jam optis yang dapat dipindahkan karena semua transisi yang diperlukan untuk pengoperasian jam dapat diatasi dengan laser dioda langsung pada panjang gelombang yang sama.[71] Meskipun radium tidak memiliki isotop stabil, ada sebelas isotop radium dengan waktu paruh lebih dari satu menit yang dapat dibandingkan dengan presisi tinggi pada plot King. Pergeseran isotop dapat diukur dengan presisi tinggi pada transisi ion radium lebargaris-subhertz dari keadaan dasar, atau pada ke garis interkombinasi dalam radium netral.[72] Tingkat nonlinear potensial apa pun dalam plot King semacam itu dapat membatasi fisika baru di luar model standar.[73] Beberapa penggunaan praktis radium berasal dari sifat radioaktifnya. Radioisotop yang baru ditemukan, seperti kobalt-60 dan sesium-137, menggantikan radium bahkan dalam penggunaan terbatas, karena isotop-isotop ini merupakan penghasil emisi yang lebih kuat, lebih aman untuk ditangani, dan tersedia dalam bentuk yang lebih terkonsentrasi.[74][75] Pada tahun 2013, isotop 223Ra (kloridanya berada di bawah nama dagang Xofigo)[76] disetujui oleh BPOM A.S. untuk digunakan dalam kedokteran sebagai pengobatan kanker metastasis tulang.[77][78] Indikasi utama pengobatan dengan Xofigo adalah terapi metastasis tulang dari kanker prostat yang resistan terhadap pengebirian karena karakteristik yang menguntungkan dari radiofarmasi pemancar alfa ini.[79] 225Ra juga telah digunakan dalam eksperimen mengenai iradiasi terapeutik, karena ia merupakan satu-satunya isotop radium yang berumur panjang yang tidak memiliki radon sebagai salah satu turunannya.[80] Radium masih digunakan pada tahun 2007 sebagai sumber radiasi di beberapa perangkat radiografi industri untuk memeriksa bagian logam yang cacat, serupa dengan pencitraan sinar-X.[22] Ketika dicampur dengan berilium, radium bertindak sebagai sumber neutron.[49][81] Pada tahun 2004, sumber neutron radium-berilium kadang-kadang masih digunakan,[22][82] tetapi bahan lain seperti polonium lebih umum: sekitar 1.500 sumber neutron polonium-berilium, dengan aktivitas individual sebesar 1.850 Ci (68 TBq), telah digunakan setiap tahun di Rusia. Sumber neutron berbasis RaBeF4 (α, n) ini telah ditinggalkan meskipun jumlah neutron yang dipancarkannya tinggi (1,84×106 neutron per detik) dan mendukung sumber 241Am–Be.[16] Pada tahun 2011, isotop 226Ra digunakan terutama untuk membentuk 227Ac melalui iradiasi neutron dalam reaktor nuklir.[16] BahayaRadium sangatlah radioaktif, dan turunan langsungnya, gas radon, juga radioaktif. Saat tertelan, 80% radium yang tertelan keluar dari tubuh melalui feses, sedangkan 20% lainnya masuk ke dalam aliran darah, sebagian besar terakumulasi di tulang. Hal ini dikarenakan tubuh memperlakukan radium sebagai kalsium dan menyimpannya di tulang, di mana radioaktivitas menurunkan sumsum dan dapat memutasi sel tulang. Paparan radium, internal atau eksternal, dapat menyebabkan kanker dan gangguan lainnya, karena radium dan radon memancarkan sinar alfa dan gama setelah peluruhannya, yang membunuh dan memutasi sel.[22] Pada saat Proyek Manhattan pada tahun 1944, "dosis toleransi" untuk pekerja ditetapkan sebesar 0,1 mikrogram radium yang tertelan.[83][84] Beberapa efek biologis radium ialah kasus pertama "dermatitis-radium", yang dilaporkan pada tahun 1900, dua tahun setelah penemuan unsur tersebut. Fisikawan Prancis Antoine Becquerel membawa ampul kecil radium di saku rompinya selama enam jam dan melaporkan bahwa kulitnya mengalami borok. Pierre dan Marie Curie begitu tertarik dengan radiasi sehingga mereka mengorbankan kesehatan mereka sendiri untuk mempelajarinya lebih lanjut. Pierre Curie menempelkan tabung berisi radium ke lengannya selama sepuluh jam, yang mengakibatkan munculnya lesi kulit, memperkirakan penggunaan radium untuk menyerang jaringan kanker karena telah menyerang jaringan sehat.[85] Penanganan radium dituding sebagai penyebab kematian Marie Curie akibat anemia aplastik. Sejumlah besar bahaya radium berasal dari turunannya, radon: sebagai gas, ia dapat memasuki tubuh jauh lebih mudah daripada induknya, radium.[22] Pada tahun 2015, 226Ra dianggap sebagai unsur radioaktif yang paling beracun, dan harus ditangani dalam kotak sarung tangan ketat dengan sirkulasi aliran udara yang signifikan yang kemudian dirawat untuk menghindari lepasnya turunannya, 222Rn ke lingkungan. Ampul lama yang mengandung larutan radium harus dibuka dengan hati-hati karena dekomposisi radiolitis air dapat menghasilkan gas hidrogen dan oksigen bertekanan berlebih.[16] Konsentrasi 226Ra 226Ra terbesar di dunia disimpan dalam Struktur Penahanan Limbah Sementara, sekitar 96 mi (154 km) di utara Kota Niagara Falls, New York.[86] Level Kontaminan Maksimum (MCL) untuk radium adalah 5pCi/L untuk air minum, namun OSHA tidak menetapkan batas paparan, karena ada batas radiasi yang telah ditetapkan.[87] Lihat pulaCatatanReferensi
Bibliografi
Bacaan lebih lanjut
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia







