|
Stronsium
Stronsium adalah sebuah unsur kimia dengan lambang Sr dan nomor atom 38. Strontium merupakan logam alkali tanah dengan tekstur yang lunak dan berwarna putih keperakan kekuningan yang sangat reaktif secara kimiawi. Logam stronsium membentuk lapisan oksida gelap ketika terkena udara. Stronsium memiliki sifat fisik dan kimia yang mirip dengan dua tetangga vertikalnya dalam tabel periodik, kalsium dan barium. Ia terjadi secara alami terutama dalam mineral selestin dan stronsianit, dan sebagian besar ditambang dari mereka berdua. Baik stronsium maupun stronsianit dinamai dari Strontian, sebuah desa di Skotlandia di mana mineral tersebut ditemukan pada tahun 1790 oleh Adair Crawford dan William Cruickshank; ia diidentifikasi sebagai unsur baru pada tahun berikutnya dari warna uji nyala merah lembayungnya. Stronsium pertama kali diisolasi sebagai logam pada tahun 1808 oleh Humphry Davy menggunakan proses elektrolisis yang baru ditemukan. Selama abad ke-19, stronsium banyak digunakan dalam produksi gula dari bit gula (lihat proses strontian). Pada puncak produksi tabung sinar katoda televisi, sebanyak 75% konsumsi stronsium di Amerika Serikat digunakan untuk kaca pelat muka.[5] Dengan penggantian tabung sinar katoda menjadi metode tampilan lainnya, konsumsi stronsium menurun drastis.[5] Walaupun stronsium alami (yang sebagian besar merupakan isotop stronsium-88) itu stabil, stronsium-90 sintetis bersifat radioaktif dan merupakan salah satu komponen paling berbahaya dari luruhan nuklir, karena stronsium diserap oleh tubuh dengan cara yang mirip dengan kalsium. Sebaliknya, stronsium stabil alami tidak berbahaya bagi kesehatan. Karakteristik Stronsium adalah logam keperakan divalen dengan semburat kuning pucat yang sifatnya sebagian besar mirip dengan tetangganya kalsium dan barium.[6] Ia lebih lembut dari kalsium dan lebih keras dari barium. Titik lebur (777 °C) dan didihnya (1377 °C) lebih rendah daripada kalsium (masing-masing 842 °C dan 1484 °C); barium melanjutkan tren penurunan ini pada titik lebur (727 °C), tetapi tidak pada titik didihnya (1900 °C). Massa jenis stronsium (2,64 g/cm3) berada di antara massa jenis kalsium (1,54 g/cm3) dan barium (3,594 g/cm3).[7] Ada tiga alotrop metalik stronsium, dengan titik transisi pada suhu 235 dan 540 °C.[8] Potensial elektroda standar untuk pasangan Sr2+/Sr adalah −2,89 V, kira-kira di tengah-tengah antara pasangan Ca2+/Ca (−2,84 V) dan Ba2+/Ba (−2,92 V), dan dekat dengan pasangan logam alkali tetangga.[9] Stronsium merupakan perantara antara kalsium dan barium dalam reaktivitasnya terhadap air, yang bereaksi pada kontak untuk menghasilkan stronsium hidroksida dan gas hidrogen. Logam stronsium terbakar di udara menghasilkan dan stronsium oksida serta stronsium nitrida, tetapi karena ia tidak bereaksi dengan nitrogen di bawah 380 °C, pada suhu kamar ia hanya membentuk oksida secara spontan.[7] Selain oksida SrO sederhana, peroksida SrO2 dapat dibuat dengan oksidasi langsung logam stronsium di bawah oksigen bertekanan tinggi, dan ada beberapa bukti untuk superoksida Sr(O2)2 kuning.[10] Stronsium hidroksida, Sr(OH)2, adalah basa kuat, meski tidak sekuat hidroksida barium atau logam alkali.[11] Keempat dihalida stronsium telah diketahui.[12] Karena ukuran besar dari unsur blok-s yang berat, termasuk strontium, rentang bilangan koordinasi yang luas telah diketahui, mulai dari 2, 3, atau 4 hingga 22 atau 24 pada SrCd11 dan SrZn13. Ion Sr2+ cukup besar, sehingga bilangan koordinasi yang tinggi adalah aturannya.[13] Ukuran stronsium dan barium yang besar berperan penting dalam menstabilkan kompleks stronsium dengan ligan makrosiklik polidentat seperti eter mahkota: misalnya, walaupun 18-mahkota-6 membentuk kompleks yang relatif lemah dengan kalsium dan logam alkali, kompleks stronsium dan bariumnya jauh lebih kuat.[14] Senyawa organostronsium mengandung satu atau lebih ikatan stronsium–karbon. Mereka telah dilaporkan sebagai perantara dalam reaksi jenis Barbier.[15][16][17] Meskipun stronsium berada dalam golongan yang sama dengan magnesium, dan senyawa organomagnesium sangat umum digunakan di seluruh kimia, senyawa organostronsium tidak tersebar luas karena lebih sulit dibuat dan lebih reaktif. Senyawa organostronsium cenderung lebih mirip dengan senyawa organoeuropium atau organosamarium karena kesamaan jari-jari ionik unsur-unsur tersebut (Sr2+ 118 pm; Eu2+ 117 pm; Sm2+ 122 pm). Sebagian besar senyawa ini hanya dapat dibuat pada suhu rendah; ligan besar cenderung mendukung stabilitas. Misalnya, stronsium disiklopentadienil, Sr(C5H5)2, harus dibuat dengan mereaksikan logam stronsium secara langsung dengan merkurosena atau siklopentadiena itu sendiri; menggantikan ligan C5H5 dengan ligan C5(CH3)5 yang lebih besar, di samping meningkatkan kelarutan, volatilitas, dan stabilitas kinetik senyawa tersebut.[18] Karena reaktivitas ekstremnya dengan oksigen dan air, stronsium terjadi secara alami hanya dalam bentuk senyawa dengan unsur lain, seperti dalam mineral stronsianit dan selestin. Ia disimpan di bawah hidrokarbon cair seperti minyak mineral atau kerosin untuk mencegah oksidasi; logam stronsium baru yang terpapar akan dengan cepat berubah menjadi warna kekuningan dengan pembentukan oksida. Bubuk logam stronsium halus bersifat piroforik, artinya ia akan menyala secara spontan di udara pada suhu kamar. Garam stronsium yang volatil memberikan warna merah terang pada nyala api, dan garam ini digunakan dalam kembang api dan produksi suar.[7] Seperti kalsium dan barium, serta logam alkali dan lantanida divalen europium dan iterbium, logam stronsium akan langsung larut dalam amonia cair dan menghasilkan larutan elektron terlarut berwarna biru tua.[6] IsotopStronsium alami adalah campuran dari empat isotop stabil: 84Sr, 86Sr, 87Sr, dan 88Sr.[7] Kelimpahan mereka meningkat seiring dengan meningkatnya nomor massa dan yang terberat, 88Sr, membentuk sekitar 82,6% dari semua stronsium alami, meskipun kelimpahannya bervariasi karena produksi 87Sr radiogenik sebagai turunan dari 87Rb yang meluruh melalui peluruhan beta dan berumur panjang.[19] Ini adalah dasar dari penanggalan rubidium–stronsium. Dari semua isotop stronsium yang tak stabil, mode peluruhan utama isotop yang lebih ringan dari 85Sr adalah penangkapan elektron atau emisi positron menjadi isotop rubidium, dan isotop yang lebih berat dari 88Sr adalah emisi elektron menjadi isotop itrium. Catatan khusus ditujukan kepada 89Sr dan 90Sr. Yang pertama memiliki waktu paruh 50,6 hari dan digunakan untuk mengobati kanker tulang karena kesamaan kimiawi stronsium dengan kalsium sehingga ia mampu menggantikannya.[20][21] Walaupun 90Sr (waktu paruh 28,90 tahun) telah digunakan dengan cara yang sama, ia juga merupakan isotop yang menjadi perhatian dalam luruhan dari senjata dan kecelakaan nuklir karena produksinya sebagai produk fisi. Kehadirannya di tulang dapat menyebabkan kanker tulang, kanker jaringan di sekitarnya, dan leukemia.[22] Kecelakaan nuklir Chernobyl tahun 1986 mengkontaminasi sekitar 30.000 km2 dengan lebih dari 10 kBq/m2 dengan 90Sr, yang menyumbang sekitar 5% dari 90Sr yang ada pada inti reaktor.[23] Sejarah Stronsium dinamai dari Strontian (Gaelik: Sròn an t-Sìthein), sebuah desa di Skotlandia, di mana ia ditemukan pada bijih dari tambang timbal.[24] Pada tahun 1790, Adair Crawford, seorang dokter yang terlibat dalam persiapan barium, dan rekannya William Cruickshank, menyadari bahwa bijih dari Strontian menunjukkan sifat yang berbeda dari sumber "spar berat" lainnya.[25] Hal ini memungkinkan Crawford untuk menyimpulkan pada halaman 355 "... sangat mungkin, bahwa mineral skoc adalah spesies tanah baru yang sampai saat ini belum diteliti secara memadai." Dokter dan pengumpul mineral Friedrich Gabriel Sulzer bersama dengan Johann Friedrich Blumenbach menganalisis mineral dari Strontian dan menamainya stronsianit. Dia juga sampai pada kesimpulan bahwa mineral itu berbeda dari witerit dan mengandung tanah baru (neue Grunderde).[26] Pada tahun 1793 Thomas Charles Hope, seorang profesor kimia di Universitas Glasgow mempelajari mineral tersebut[27][28] dan mengusulkan nama strontites.[29][30][31] Dia mengonfirmasi karya Crawford sebelumnya dan menceritakan: "... Mengingat itu adalah tanah yang aneh, saya pikir perlu memberinya nama. Saya menyebutnya Strontites, dari tempat dimana ia ditemukan; menurut pendapat saya, sebuah mode turunan, sepenuhnya sesuai dengan kualitas apa pun yang mungkin dimilikinya, yang merupakan fesyen saat ini." Unsur ini akhirnya diisolasi oleh Sir Humphry Davy pada tahun 1808 melalui elektrolisis campuran yang mengandung stronsium klorida dan merkurat oksida, dan diumumkan olehnya dalam sebuah lektur di Royal Society pada tanggal 30 Juni 1808.[32] Sesuai dengan penamaan alkali tanah lainnya, dia mengubah nama unsur ini menjadi strontium.[33][34][35][36][37] Aplikasi stronsium skala besar pertama adalah dalam produksi gula dari bit gula. Meskipun proses kristalisasi menggunakan stronsium hidroksida dipatenkan oleh Augustin-Pierre Dubrunfaut pada tahun 1849,[38] pengenalan skala besar datang dengan perbaikan proses pada awal tahun 1870-an. Industri gula Jerman menggunakan proses tersebut hingga abad ke-20. Sebelum Perang Dunia I, industri gula bit menggunakan 100.000 hingga 150.000 ton stronsium hidroksida untuk proses ini per tahun.[39] Stronsium hidroksida didaur ulang dalam prosesnya, tetapi permintaan untuk mengganti kerugian selama produksi cukup tinggi untuk menciptakan permintaan yang signifikan untuk memulai penambangan stronsianit di Münsterland. Penambangan stronsianit di Jerman berakhir ketika penambangan deposit selestin di Gloucestershire dimulai.[40] Tambang-tambang ini memasok sebagian besar pasokan stronsium dunia dari tahun 1884 hingga 1941. Meskipun endapan selestin di cekungan Granada telah dikenal selama beberapa waktu, penambangan skala besar tidak dimulai hingga tahun 1950-an.[41] Selama pengujian senjata nuklir atmosfer, telah diamati bahwa stronsium-90 adalah salah satu produk fisi nuklir dengan hasil yang relatif tinggi. Kesamaan dengan kalsium dan kemungkinan bahwa stronsium-90 dapat diperkaya dalam tulang membuat penelitian tentang metabolisme stronsium menjadi topik penting.[42][43] Keterjadian Stronsium umumnya terdapat di alam, menjadi unsur paling melimpah ke-15 di Bumi (kongenernya yang lebih berat, barium, berada di urutan ke-14), diperkirakan jumlah rata-ratanya sekitar 360 bagian per juta di kerak Bumi[44] dan ditemukan terutama sebagai mineral sulfat selestin (SrSO4) dan karbonat stronsianit (SrCO3). Dari keduanya, selestin lebih sering terjadi pada endapan dengan ukuran yang cukup untuk ditambang. Karena stronsium paling sering digunakan dalam bentuk karbonat, stronsianit akan lebih bermanfaat dari dua mineral umum, tetapi hanya sedikit endapan yang ditemukan yang cocok untuk dikembangkan.[45] Karena caranya dalam bereaksi dengan udara dan air, stronsium hanya ada di alam bila dikombinasikan untuk membentuk mineral. Stronsium yang terjadi secara alami stabil, tetapi isotop sintetisnya, 90Sr, hanya dihasilkan oleh luruhan nuklir. Dalam air tanah, stronsium berperilaku secara kimia seperti kalsium. Pada pH menengah hingga asam, Sr2+ merupakan spesies stronsium yang dominan. Dengan adanya ion kalsium, stronsium biasanya membentuk kopresipitat dengan mineral kalsium seperti kalsit dan anhidrit pada peningkatan pH. Pada pH menengah hingga asam, stronsium yay terlarut akan terikat pada partikel tanah melalui pertukaran kation.[46] Kandungan rata-rata stronsium air laut adalah 8 mg/L.[47][48] Pada konsentrasi antara 82 dan 90 μmol/L stronsium, konsentrasinya jauh lebih rendah daripada konsentrasi kalsium, yang biasanya antara 9,6 dan 11,6 mmol/L.[49][50] Namun demikian, ia jauh lebih tinggi dari barium, dengan konsentrasi yang hanya sebesar 13 μg/L.[7] Produksi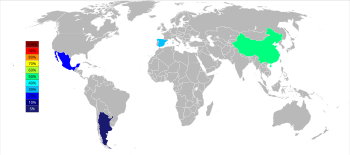 Tiga produsen utama stronsium sebagai selestin pada 2015 adalah Tiongkok (150.000 t), Spanyol (90.000 t), dan Meksiko (70.000 t); Argentina (10.000 t) dan Maroko (2.500 t) adalah produsen yang lebih kecil. Meskipun deposit stronsium terdapat secara luas di Amerika Serikat, mereka belum ditambang sejak tahun 1959.[51] Sebagian besar selestin (SrSO4) yang ditambang diubah menjadi karbonat melalui dua proses, baik selestin langsung dicuci dengan larutan natrium karbonat ataupun selestin dipanggang dengan batu bara untuk membentuk sulfida. Tahap kedua menghasilkan bahan berwarna gelap yang sebagian besar mengandung stronsium sulfida. Yang disebut "abu hitam" ini dilarutkan dalam air dan disaring. Stronsium karbonat diendapkan dari larutan stronsium sulfida dengan memasukkan karbon dioksida.[52] Stronsium sulfat direduksi menjadi stronsium sulfida melalui reduksi karbotermik:
Sekitar 300.000 ton diproses dengan cara ini setiap tahunnya.[53] Logam ini diproduksi secara komersial dengan mereduksi stronsium oksida dengan aluminium. Stronsium disuling dari campuran.[53] Logam stronsium juga dapat dibuat dalam skala kecil dengan elektrolisis larutan stronsium klorida dalam kalium klorida cair:[9]
Aplikasi Mengonsumsi 75% dari produksi, penggunaan utama stronsium adalah kaca untuk tabung sinar katoda televisi berwarna,[53] di mana ia mencegah emisi sinar-X.[54][55] Aplikasi untuk stronsium ini telah menurun karena CRT digantikan oleh metode tampilan lainnya. Penurunan ini memiliki pengaruh yang signifikan terhadap penambangan dan pemurnian stronsium.[45] Semua bagian CRT harus menyerap sinar-X. Di leher dan corong tabung, kaca timbal digunakan untuk tujuan ini, tetapi kaca jenis ini menunjukkan efek kecoklatan akibat interaksi sinar-X dengan kaca. Oleh karena itu, panel depan dibuat dari campuran kaca yang berbeda dengan stronsium dan barium untuk menyerap sinar-X. Nilai rata-rata campuran kaca yang ditentukan untuk studi daur ulang pada tahun 2005 adalah 8,5% stronsium oksida dan 10% barium oksida.[56] Karena strontium sangat mirip dengan kalsium, ia akan tergabung dalam tulang. Keempat isotop stronsium yang stabil digabungkan, dalam proporsi yang kira-kira sama dengan yang ditemukan di alam. Namun, distribusi sebenarnya dari isotop tersebut cenderung sangat bervariasi dari satu lokasi geografis ke lokasi lainnya. Jadi, menganalisis tulang seseorang dapat membantu menentukan daerah asalnya.[57][58] Pendekatan ini membantu mengidentifikasi pola migrasi kuno dan asal-usul sisa-sisa manusia yang bercampur di situs pemakaman medan perang.[59] Rasio 87Sr/86Sr umumnya digunakan untuk menentukan kemungkinan daerah asal sedimen dalam sistem alami, terutama pada lingkungan laut dan fluvial. Dasch (1969) menunjukkan bahwa sedimen permukaan Atlantik menampilkan rasio 87Sr/86Sr yang dapat dianggap sebagai rata-rata curah dari rasio 87Sr/86Sr medan geologis dari daratan yang berdekatan.[60] Sebuah contoh yang baik dari sistem fluvial-laut dimana studi sumber isotop Sr telah berhasil digunakan adalah sistem Sungai Nil-Mediterania.[61] Karena usia batuan yang berbeda yang merupakan mayoritas dari Nil Biru dan Putih, daerah tangkapan dari sumber perubahan sedimen mencapai Delta Sungai Nil dan Laut Mediterania Timur dapat dilihat melalui studi isotop strontium. Perubahan tersebut dikendalikan secara iklim pada Kuarter Akhir.[61] Baru-baru ini, rasio 87Sr/86Sr juga telah digunakan untuk menentukan sumber bahan arkeologi kuno seperti kayu dan jagung di Chaco Canyon, New Mexico.[62][63] Rasio 87Sr/86Sr pada gigi juga dapat digunakan untuk melacak migrasi hewan.[64][65] Stronsium aluminat sering digunakan dalam mainan yang dapat bersinar dalam kegelapan, karena bersifat lengai secara kimiawi dan biologis.[butuh rujukan]  Stronsium karbonat dan garam stronsium lainnya ditambahkan pada kembang api untuk memberikan warna merah tua.[66] Efek yang sama ini mengidentifikasi kation stronsium dalam uji nyala. Kembang api mengonsumsi sekitar 5% dari produksi dunia.[53] Stronsium karbonat digunakan dalam pembuatan magnet ferit keras.[67][68] Stronsium klorida kadang-kadang digunakan dalam pasta gigi untuk gigi sensitif. Satu merek populer mencakup 10% total stronsium klorida heksahidrat dari beratnya.[69] Sejumlah kecil digunakan dalam pemurnian seng untuk menghilangkan sejumlah kecil pengotor timbal.[7] Logam stronsium itu sendiri memiliki penggunaan terbatas sebagai penangkap, untuk menghilangkan gas yang tak diinginkan dalam ruang hampa dengan mereaksikannya, meskipun barium juga dapat digunakan untuk tujuan ini.[9] Transisi optik ultrasempit antara keadaan dasar elektronik [Kr]5s2 1S0 dan keadaan tereksitasi [Kr]5s5p 3P0 metastabil dari 87Sr adalah salah satu kandidat utama untuk definisi ulang detik di masa depan dalam hal transisi optik yang bertentangan dengan definisi saat ini yang berasal dari transisi gelombang mikro antara berbagai kondisi dasar hiperhalus dari 133Cs.[70] Jam atom optik saat ini yang beroperasi pada transisi ini telah melampaui presisi dan akurasi definisi detik saat ini. Stronsium radioaktif89Sr adalah bahan aktif dalam Metastron,[71] radiofarmasi yang digunakan untuk nyeri tulang akibat kanker tulang metastatis. Stronsium diproses seperti kalsium oleh tubuh, menggabungkannya ke dalam tulang di tempat peningkatan osteogenesis. Lokalisasi ini memfokuskan paparan radiasi pada lesi kanker.[21]  90Sr telah digunakan sebagai sumber daya untuk generator termoelektrik radioisotop (RTG). 90Sr menghasilkan sekitar 0,93 watt panas per gram (lebih rendah untuk bentuk 90Sr yang digunakan dalam RTG, yaitu stronsium fluorida).[72] Namun, 90Sr memiliki sepertiga masa pakai dan massa jenis lebih rendah dari 238Pu, bahan bakar RTG lainnya. Keuntungan utama dari 90Sr adalah ia lebih murah daripada 238Pu dan ditemukan dalam limbah nuklir. Uni Soviet mengerahkan hampir 1.000 RTG ini di pantai utaranya sebagai sumber listrik untuk mercusuar dan stasiun meteorologi.[73][74] Peran biologis
Akantaria, kelompok protozoa radiolaria laut yang relatif besar, menghasilkan kerangka mineral rumit yang terdiri dari stronsium sulfat.[76] Dalam sistem biologis, sebagian kecil kalsium tersubstitusi oleh stronsium.[77] Dalam tubuh manusia, sebagian besar stronsium yang diserap akan disimpan di tulang. Rasio stronsium terhadap kalsium dalam tulang manusia adalah antara 1:1000 dan 1:2000, kira-kira dalam kisaran yang sama seperti dalam serum darah.[78] Efek bagi tubuh manusiaTubuh manusia menyerap stronsium seolah-olah ia adalah kongenernya yang lebih ringan, kalsium. Karena kedua unsur tersebut secara kimia sangat mirip, isotop stronsium yang stabil tidak menimbulkan ancaman kesehatan yang signifikan. Rata-rata manusia memiliki asupan sekitar dua miligram stronsium sehari.[79] Pada orang dewasa, stronsium yang dikonsumsi cenderung menempel hanya pada permukaan tulang, namun pada anak-anak, stronsium dapat menggantikan kalsium dalam mineral tulang yang sedang tumbuh sehingga menyebabkan masalah pertumbuhan tulang.[80] Waktu paruh biologis stronsium pada manusia telah banyak dilaporkan mulai dari 14 hingga 600 hari,[81][82] 1.000 hari,[83] 18 tahun,[84] 30 tahun[85] dan, pada batas atas, 49 tahun.[86] Angka waktu paruh biologis yang dipublikasikan secara luas dijelaskan oleh metabolisme kompleks stronsium di dalam tubuh. Namun, dengan rata-rata semua jalur ekskresi, waktu paruh biologis secara keseluruhan diperkirakan sekitar 18 tahun.[87] Tingkat eliminasi stronsium sangat dipengaruhi oleh usia dan jenis kelamin, karena perbedaan metabolisme tulang.[88] Obat stronsium ranelat dapat membantu pertumbuhan tulang, meningkatkan kepadatan tulang, dan mengurangi kejadian patah tulang belakang, perifer, dan pinggul.[89][90] Namun, stronsium ranelat juga meningkatkan risiko tromboemboli vena, emboli paru, dan gangguan kardiovaskular serius, termasuk infark miokard. Oleh karena itu, penggunaannya sekarang telah dibatasi.[91] Efek menguntungkannya juga dipertanyakan, karena peningkatan kepadatan tulang sebagian disebabkan oleh peningkatan kepadatan stronsium di atas kalsium yang digantikannya. Stronsium juga terbioakumulasi dalam tubuh.[92] Meskipun pembatasan stronsium ranelat, stronsium masih terkandung dalam beberapa suplemen.[93][94] Tidak banyak bukti ilmiah tentang risiko stronsium klorida saat diminum. Mereka yang memiliki riwayat gangguan pembekuan darah pribadi atau keluarga disarankan untuk menghindari stronsium.[93][94] Stronsium telah terbukti menghambat iritasi sensorik saat dioleskan ke kulit.[95][96] Dioleskan secara topikal, stronsium telah terbukti mempercepat laju pemulihan penghalang permeabilitas epidermal (penghalang kulit).[97] Limbah nuklirStronsium-90 adalah produk fisi radioaktif yang dihasilkan oleh reaktor nuklir yang digunakan dalam tenaga nuklir. Ia adalah komponen utama dari radioaktivitas tingkat tinggi dari limbah nuklir dan bahan bakar nuklir bekas. Waktu paruh 29 tahunnya cukup singkat sehingga panas peluruhannya telah digunakan untuk menyalakan mercusuar Arktik, tetapi cukup lama sehingga perlu waktu ratusan tahun untuk meluruh ke tingkat yang aman. Paparan dari air dan makanan yang terkontaminasi dapat meningkatkan risiko leukemia, kanker tulang,[98] dan hiperparatiroidisme primer.[99] RemediasiAlga telah menunjukkan selektivitas untuk stronsium dalam penelitian, di mana sebagian besar tanaman yang digunakan dalam bioremediasi belum menunjukkan selektivitas antara kalsium dan stronsium, seringkali menjadi jenuh dengan kalsium, yang jumlahnya lebih besar dan juga terdapat dalam limbah nuklir.[98] Para peneliti telah melihat bioakumulasi stronsium oleh Scenedesmus spinosus (alga) dalam air limbah simulasi. Studi ini mengklaim kapasitas biosorpsi yang sangat selektif untuk stronsium dari S. spinosus, menunjukkan bahwa ia mungkin sesuai untuk penggunaan air limbah nuklir.[100] Sebuah studi tentang ganggang tambak Closterium moniliferum menggunakan stronsium nonradioaktif menemukan bahwa memvariasikan rasio barium terhadap stronsium dalam air akan meningkatkan selektivitas stronsium.[98] Lihat pulaReferensi
Bibliografi
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




