|
Unsur golongan 7
Golongan 7 atau VIIB adalah golongan unsur kimia di tabel periodik. Golongan ini juga dikenal sebagai golongan mangan. Golongan ini terdiri dari unsur mangan (Mn), unsur radioaktif teknesium (Tc), renium (Re), dan unsur sintetis yang radioaktif bohrium (Bh). Semuanya adalah logam transisi dengan rhenium adalah logam refraktori. Periode 8 dari golongan 7 adalah unpentseptium (Ups) atau unpentennium (Upe). Ini bisa jadi tidak mungkin; tetes ketidakstabilan mungkin menyiratkan bahwa tabel periodik berakhir pada unbihexium. Baik unpentseptium maupun unpentennium belum disintesis, dan tampaknya tidak akan terjadi dalam waktu dekat. KarakteristikSeperti golongan lainnya, anggota golongan ini menunjukkan pola dalam konfigurasi elektronnya, terutama kelopak terluar menghasilkan tren perilaku kimia:
SejarahManganAsal usul nama mangan cukup kompleks. Pada zaman dulu, dua mineral hitam dari Magnesia (terletak di Yunani modern) keduanya disebut magnes dari nama asal tempat ditemukannya, tetapi diduga berbeda gender. Magnes jantan menarik besi, dan merupakan bijih besi yang sekarang dikenal sebagai lodestone atau magnetit, dan yang mungkin memberi istilah magnet kepada kita. Bijih magnes betina tidak menarik besi, tetapi digunakan untuk mewarnai kaca. Magnes feminin ini kelak disebut magnesia, yang sekarang kita kenal sebagai pirolusit atau mangan dioksida. Baik mineral ini maupun unsur mangan tidak ada yang bersifat magnet. Pada abad ke-16, mangan dioksida disebut manganesum oleh perajin kaca, kemungkinan karena pemotongan dan penggabungan dua kata, karena alkimiawan dan perajin kaca akhirnya harus membedakan magnesia negra (bijih hitam) dari magnesia alba (bijih putih, juga dari Magnesia, dan berguna dalam karya gelas). Michele Mercati menyebut magnesia negra sebagai manganesa, dan akhirnya logam yang diisolasi darinya menjadi dikenal sebagai mangan (bahasa Inggris: manganese). Nama magnesia akhirnya hanya digunakan untuk merjuk pada magnesia alba putih (magnesium oksida), yang memberi nama magnesium untuk unsur bebas yang diisolasi darinya kelak.[1] Beberapa oksida mangan yang berwarna yang melimpah di alam, misalnya mangan dioksida, telah digunakan sebagai pigmen sejak Zaman Batu. Lukisan gua di Gargas yang berusia 24.000 sampai 30.000 tahun mengandung pigmen mangan.[2] Senyawa mangan digunakan oleh perajin kaca Mesir dan Romawi untuk mewarnai atau menghilangkan warna.[3] Penggunaannya sebagai "sabun perajin kaca" berlanjut hingga Abad Pertengahan sampai zaman modern dan buktinya adalah kaca abad ke-14 di Venesia.[4]  Pada pertengahan abad ke-18, kimiawan Swedia Carl Wilhelm Scheele menggunakan mangan dioksida untuk membuat klor. Produksi klor dan pemutih hipoklorit adalah konsumsi terbesar bijih mangan. Scheele dan kimiawan lain menyadari bahwa mangan dioksida mengandung unsur baru, tetapi mereka tidak mampu mengisolasinya. Johan Gottlieb Gahn adalah yang pertama mengisolasi sampel logam mangan tak murni pada tahun 1774, dengan mereduksi dioksidanya menggunakan karbon. TeknesiumPenemuan unsur 43 akhirnya dikonfirmasi pada percobaan bulan Desember 1936 di Universitas Palermo, Sisilia, oleh Carlo Perrier dan Emilio Segrè.[5] Pada pertengahan 1936, Segrè berkunjung ke Amerika Serikat, pertama ke Universitas Columbia di New York dan kemudian Laboratorium Nasional Lawrence Berkeley di California. Ia membujuk penemu siklotron Ernest Lawrence agar diizinkan membawa pulang bagian-bagian siklotron yang sudah tak terpakai dan radioaktif. Lawrence memaketkan lembaran molibdenum yang merupakan bekas bagian deflektor siklotron.[6] Segrè menunjuk koleganya Perrier untuk mencoba membuktikan, melalui kimia komparatif, bahwa aktivitas molibdenum memang berasal dari unsur dengan nomor atom 43. Pada tahun 1937, mereka berhasil mengisolasi isotop teknesium-95m dan teknesium-97.[7][8] Universitas Palermo secara resmi menginginkan mereka menamakan penemuannya dengan "panormium", sesuai nama Latin untuk Palermo, Panormus. Pada tahun 1947[7] unsur 43 dinamakan sesuai kata bahasa Yunani: τεχνητός, yang berarti "artifisial", karena itu adalah unsur pertama yang diproduksi secara artifisial.[9][10] Segrè kembali ke Berkeley dan bertemu dengan Glenn T. Seaborg. Mereka mengisolasi isotop metastabil teknesium-99m, yang sekarang digunakan dalam sekitar sepuluh juta prosedur diagnosis medis per tahunnya.[11] Pada tahun 1952, astronom Paul W. Merrill di California mendeteksi jejak spektrum teknesium (khususnya pada panjang gelombang 403,1 nm, 423,8 nm, 426,2 nm dan 429,7 nm) pada cahaya dari raksasa merah kelas S.[12] Bintang tersebut berada pada akhir hidupnya, dan juga kaya akan unsur berumur pendek ini, menandakan bahwa unsur tersebut dihasilkan dalam bintang melalui reaksi nuklir. Bukti ini mendukung hipotesis bahwa unsur-unsur yang lebih berat adalah produk nukleosintesis di dalam bintang.[8] Pengamatan semacam itu akhir-akhir ini memberikan bukti bahwa unsur terbentuk melalui tangkapan neutron pada proses s.[13] Sejak penemuan tersebut, telah banyak dilakukan pencarian materi terestrial untuk sumber alami teknesium. Pada tahun 1962, teknesium-99 diisolasi dan diidentifikasi dalam pitchblende dari Kongo Belgia dalam jumlah yang sangat sedikit (sekitar 0,2 ng/kg);[13] yang dihasilkan sebagai produk fisi spontan uranium-238. Reaktor fisi nuklir alami Oklo mendapat bukti bahwa jumlah teknesium-99 yang signifikan telah diproduksi dan meluruh menjadi rutenium-99.[13] ReniumRenium (bahasa Latin: Rhenus artinya: "Rhine")[14] adalah unsur terakhir yang ditemukan yang memiliki isotop stabil (unsur baru lainnya yang ditemukan di alam setelahnya, seperti fransium, bersifat radioaktif).[15] Eksistensi unsur yang belum ditemukan pada posisi ini dalam tabel periodik telah diprediksi sejak awal oleh Dmitri Mendeleev. Informasi lain yang sudah diperhitungkan juga dilakukan oleh Henry Moseley pada tahun 1914.[16] Ini umumnya dianggap telah ditemukan oleh Walter Noddack, Ida Tacke, dan Otto Berg di Jerman. Pada tahun 1925 mereka melaporkan bahwa mereka telah mendeteksi unsur dalam bijih platina dan dalam mineral kolumbit. Mereka juga menemukan renium dalam gadolinit dan molibdenit.[17] Pada tahun 1928 mereka berhasil mengekstraksi 1 g unsur ini melalui pengolahan 660 kg molibdenit.[18] Diperkirakan pada tahun 1968 bahwa 75% dari logam rhenium di Amerika Serikat digunakan untuk penelitian dan pengembangan paduan logam refraktori. Memerlukan waktu beberapa tahun sejak itu sebelum akhirnya superaloy digunakan secara luas.[19][20] Pada tahun 1908, kimiawan Jepang Masataka Ogawa mengumumkan bahwa ia telah menemukan unsur ke-43 dan diberi nama nipponium (Np) merujuk pada Jepang (Nippon dalam bahasa Jepang). Namun, analisis terkini menunjukkan adanya renium (unsur 75), bukan unsur 43,[21] meskipun interpretasi ulang ini kontroversial.[22] Lambang Np akhirnya digunakan untuk unsur neptunium, dan nama "nihonium", juga merujuk nama negara Jepang, dengan lambang Nh, akhirnya digunakan untuk unsur 113. Unsur 113 juga ditemukan oleh regu ilmuwan Jepang dan dinamakan untuk menghormati hasil karya Ogawa.[23] Bohrium Dua kelompok mengklaim penemuan unsur ini. Bukti bohrium pertama kali dilaporkan pada tahun 1976 oleh kelompok peneliti Rusia yang dikomandani Yuri Oganessian, yang memborbardir bismut-209 dan timbal-208 dengan inti kromium-54 dan mangan-55 yang dipercepat.[24] Teramati dua aktivitas, pertama dengan waktu paruh satu hingga dua milidetik, dan lainnya dengan waktu paruh lima detik. Oleh karena rasio intensitas kedua aktivitas ini konstant sepanjang eksperimen, maka diusulkan bahwa yang pertama berasal dari isotop bohrium-261 dan yang kedua adalah anaknya dubnium-257. Kemudian, isotop dubnium dikoreksi menjadi dubnium-258, yang memang memiliki waktu paruh lima detik (dubnium-257 memiliki waktu paruh satu detik); namun waktu paruh yang teramati untuk induknya jauh lebih pendek daripada waktu paruh yang teramati kemudian dalam penemuan definitif bohrium di Darmstadt, Jerman pada tahun 1981. IUPAC/IUPAP Transfermium Working Group (TWG) menyimpulkan bahwa meskipun dubnium-258 mungkin teramati pada percobaan ini, bukti produksi induknya bohrium-262 tidak cukup meyakinkan.[25] Pada tahun 1981, kelompok peneliti Jerman yang dipimpin oleh Peter Armbruster dan Gottfried Münzenberg di GSI Helmholtz Centre for Heavy Ion Research (GSI Helmholtzzentrum für Schwerionenforschung) di Darmstadt memborbardir target bismut-209 dengan inti kromium-54 yang dipercepat untuk menghasilkan 5 atom isotop bohrium-262:[26] Penemuan ini diperkuat lebih lanjut oleh pengukuran detail mereka atas rantai peluruhan alfa atom bohrium yang dihasilkan menjadi isotop fermium dan kalifornium yang telah dikenali sebelumnya. IUPAC/IUPAP Transfermium Working Group (TWG) mengakui kolaborasi GSI sebagai penemu resmi dalam laporannya tahun 1992.[25] Sifat kimia dan fisikaMangan adalah logam berwarna abu-abu keperakan yang menyerupai besi. Ia keras dan sangat rapuh, sulit dilebur, tetapi mudah teroksidasi.[27] Logam mangan dan ionnya bersifat paramagnetik.[28] Mangan memudar perlahan di udara dan teroksidasi ("berkarat") seperti besi dalam air yang mengandung oksigen terlarut. Tingkat oksidasi mangan yang paling umum adalah +2, +3, +4, +6, dan +7, meskipun semua tingkat oksidasi dari -3 sampai +7 telah diamati. Mn2+ sering berkompetisi dengan Mg2+ dalam sistem biologis. Senyawa mangan dengan tingkat oksidasi mangan +7, yang paling banyak terdapat sebagai oksida tak stabil Mn, senyawa dari anion permanganat MnO yang berwarna ungu tajam, dan beberapa oksihalida (MnO3F dan MnO3Cl) adalah oksidator kuat.[27] Senyawa dengan tingkat oksidasi +5 (biru) dan +6 (hijau) adalah oksidator kuat dan rentan terhadap disproporsionasi. Teknesium adalah logam radioaktif abu-abu keperakan dengan penampilan mirip platina, yang biasa didapati sebagai serbuk abu-abu.[29] Struktur kristal logam murninya adalah heksagonal kemasan tertutup. Teknesium atom memiliki karakteristik garis emisi pada cahaya dengan panjang gelombang berikut: 363,3 nm, 403,1 nm, 426,2 nm, 429,7 nm, dan 485,3 nm.[30] Bentuk logamnya sedikit paramagnetik, yang berarti dipol magnetiknya selaras dengan medan magnet eksternal, tetapi mungkin akan mengalami orientasi acak ketika medannya dihilangkan.[31] Teknesium metalik, kristal tunggal, menjadi superkonduktor tipe-II pada suhu di bawah 7,46 K.[note 1][32] Di bawah suhu ini, teknesium memiliki kedalaman penembusan magnetik (London penetration depth) yang sangat tinggi, lebih besar daripada semua unsur lainnya kecuali niobium.[33] Teknesium terletak dalam golongan ketujuh tabel periodik, antara rhenium dan mangan. Sebagaimana diperkirakan oleh hukum periodik, sifat kimianya berada di antara kedua unsur tersebut. Di antara keduanya, teknesium lebih mirip rhenium, terutama kelembaman kimianya dan kecenderungan membentuk ikatan kovalen.[34] Tidak seperti mangan, teknesium tidak mudah membentuk kation (ion bermuatan positif). Teknesium menunjukkan sembilan tingkat oksidasi dari −1 sampai +7, dengan +4, +5, dan +7 adalah yang paling umum.[35] Teknesium larut dalam air raja, asam nitrat, dan asam sulfat pekat, tetapi tidak larut dalam asam klorida dengan konsentrasi berapapun.[29] Teknesium logam menjadi kusam (tarnish) dalam udara lembap[35] dan, dalam bentuk serbuk, terbakar dalam oksigen. Rhenium adalah logam putih keperakan dan salah satu dengan titik leleh tertinggi di antara semua unsur, hanya dilampaui oleh wolfram dan karbon. Ia juga salah satu dengan titik didih tertinggi di antara semua unsur. Ia juga salah satu dengan massa jenis tertinggi, hanya dilampaui oleh platina, iridium dan osmium. Rhenium memiliki struktur kristal kemasan tertutup heksagonal, dengan parameter kisi a = 276,1 pm dan c = 445,6 pm.[36] Bentuk komersial umumnya adalah serbuk, tetapi unsur ini dapat dibuat kompak dengan pengempaan dan sintering dalam vakum atau atmosfer hidrogen. Prosedur ini menghasilkan padatan kompak yang memiliki densitas 90% di atas densitas logam. Jika dianil logam ini sangat lentur dan dapat dibengkokkan, dibuat spiral, atau digulung.[29] Logam paduan rhenium-molibdenum bersifat superkonduktif pada 10 K; paduan wolfram-rhenium juga bersifat superkonduktif[37] di kisaran 4–8 K, tergantung pada paduannya. Logam rhenium bersifat superkonduktif pada 1,697 ± 0,006 K.[38][39] Dalam bentuk curah dan pada suhu kamar serta tekanan atmosfer, unsur ini tahan terhadap alkali, asam sulfat, asam klorida, asam nitrat encer (tetapi tidak untuk yang pekat), dan air raja. Bohrium adalah anggota kelima dari deret 6d logam transisi dan anggota terberat dari golongan 7 pada tabel periodik, di bawah mangan, teknesium dan rhenium. Semua anggota golongan dengan mudah menggambarkan keadaan oksidasi golongan mereka pada +7 dan keadaan menjadi lebih stabil menuruni golongan tersebut. Jadi bohrium diperkirakan akan membentuk keadaan stabil +7. Teknesium juga menunjukkan keadaan stabil +4 sementara renium menunjukkan keadaan stabil +4 dan +3. Oleh karena itu bohrium juga dapat menunjukkan keadaan rendah ini.[40] Status oksidasi yang lebih tinggi dari +7 lebih cenderung ada pada oksianion, seperti perbohriat, BhO, analog dengan permanganat, perteknetat, dan perhenat yang lebih ringan. Meskipun demikian, bohrium(VII) cenderung tidak stabil dalam larutan berair, dan mungkin akan mudah direduksi menjadi bohrium(IV) yang lebih stabil.[41] Bohrium diperkirakan berupa padatan dalam kondisi normal dan diasumsikan memiliki struktur kristal heksagonal kemasan tertutup (c/a = 1,62), mirip dengan kongenernya yang lebih ringan, renium.[42] Ia seharusnya merupakan logam yang sangat berat dengan densitas sekitar 37,1 g/cm3, yang berarti tertinggi ketiga di antara 118 unsur yang diketahui, hanya lebih ringan daripada meitnerium (37.4 g/cm3) dan hasium (41 g/cm3), dua unsur berikutnya dalam tabel periodik. Sebagai perbandingan, unsur yang paling padat yang densitasnya telah diukur, osmium, memiliki densitas hanya 22,61 g/cm3. Hasil ini berasal dari berat atom bohrium yang tinggi, kontraksi lantanida dan aktinida, serta efek relativistik, meskipun produksi bohrium yang mencukupi untuk mengukur kuantitas ini akan tidak praktis, dan sampel akan cepat meluruh.[41] KeterjadianMangan adalah satu-satunya unsur golongan 7 yang umum. Pada tahun 2007, 11 juta metrik ton mangan ditambang. Semua unsur lainnya sangat langka di bumi (teknesium, rhenium) atau yang sepenuhnya sintetis (bohrium). Berbeda dengan mangan, hanya 40 atau 50 metrik ton rhenium yang ditambang. Teknesium hanya ditemukan dalam jumlah renik di alam sebagai produk fisi spontan; hampir semuanya diproduksi di laboratorium. Bohrium hanya diproduksi di reaktor nuklir dan tidak pernah diisolasi dalam bentuk murni. Mangan menyusun sekitar 1000 ppm (0,1%) dari kerak bumi, unsur yang paling melimpah ke-12 dalam kerak bumi.[43] Tanah mengandung 7–9000 ppm mangan dengan rata-rata 440 ppm.[43] Air laut hanya memiliki 10 ppm mangan dan atmosfer mengandung 0,01 μg/m3.[43] Mangan terjadi terutama sebagai pirolusit (MnO2), braunit, (Mn''";,[44] psilomelan (Ba,H''";, dan pada tingkat yang lebih rendah sebagai rodokrosit (MnCO3).
 Bijih mangan yang paling penting adalah pirolusit (MnO2). Bijih mangan lainnya yang penting secara ekonomi biasanya menunjukkan hubungan spasial yang erat dengan bijih besi.[27] Sumber daya di darat sangat besar namun tidak terdistribusi secara teratur. Sekitar 80% sumber daya mangan dunia yang dikenal berada di Afrika Selatan; deposit mangan penting lainnya ada di Ukraina, Australia, India, China, Gabon dan Brazil.[45] Menurut estimasi 1978, dasar laut memiliki 500 miliar ton nodul mangan.[46] Upaya untuk menemukan metode memanen nodul mangan yang layak secara ekonomi ditinggalkan pada tahun 1970an.[47] Sangat sedikit teknesium alami dalam kerak bumi, hanya dalam tingkat renik. Hal ini karena waktu paruh teknesium-98 hanya 4,2 juta tahun. Lebih dari ribuan periode semacam ini yang telah dilalui untuk pembentukan bumi, sehingga probabilitas keberlangsungan hidup teknesium primordial efektif adalah nol, meski satu atom sekalipun. Namun, sejumlah kecil tetap ada sebagai produk fisi spontan dalam bijih uranium. Satu kilogram uranium mengandung sekitar 1 nanogram (10-9 g) teknesium.[8][48][49] Beberapa bintang raksasa merah dengan spektrum jenis S, M, dan N mengandung garis absorpsi spektrum yang menandakan keberadaan teknesium.[29][50] Raksasa merah ini secara informal dikenal sebagai bintang teknesium.  Rhenium adalah salah satu unsur paling langka dalam kerak bumi dengan konsentrasi rata-rata 1 ppb;[51] sumber lain menyebut angka 0,5 ppg, membuatnya berada pada urutan ke-77 unsur paling melimpah dalam kerak bumi.[52] Rhenium mungkin tidak ditemukan bebas di alam (tidak ada kepastian keterjadian alaminya), tetapi terdapat dalam jumlah sampai dengan 0,2%[51] dalam mineral molibdenit (yang kandungan utamanya adalah molibdenum disulfida), sumber komersial utama, meskipun telah ditemukan sampel molibdenit tunggal dengan kandungan rhenium sampai dengan 1,88%.[53] Chile memiliki cadangan rhenium terbesar di dunia, bagian dari deposit bijih tembaga, dan produsen utama sampai dengan 2005.[54] Baru akhir-akhir ini ditemukan dan dijabarkan mineral rhenium pertama (pada tahun 1994), suatu mineral sulfida rhenium (ReS2) hasil kondensasi dari fumarol di gunung berapi Kudriavy, pulau Iturup, kepulauan Kuril, Rusia.[55] Limpasan Kudryavy mencapai 20–60 kg rhenium per tahun yang mayoritas dalam bentuk rhenium disulfida.[56][57] Mineral langka ini, yang diberi nama rheniit, memiliki nilai tinggi di kalangan kolektor.[58] Bohrium adalah unsur sintetis (unsur yang dibuat di laboratorium tetapi tidak ditemukan di alam) dan radioaktif; isotop paling stabil yang diketahui, 270Bh, memiliki waktu paruh sekitar 61 detik, meskipun 278Bh yang belum dikonfirmasi mungkin memiliki waktu paruh yang lebih lama yaitu sekitar 690 detik. Bohrium tidak memiliki isotop stabil atau yang terjadi secara alami. Beberapa isotop radioaktif telah disintesis di laboratorium, baik melalui fusi dua atom atau mengamati peluruhan unsur yang lebih berat. Duabelas isotop bohrium yang berbeda telah dilaporkan dengan massa atom 260-262, 264-267, 270-272, 274, dan 278, salah satunya, bohrium-262, telah diketahui memiliki keadaan metastabil. Seluruh isotop ini, kecuali 278Bh yang belum dikonfirmasi, meluruh hanya melalui peluruhan alfa, meskipun beberapa isotop bohrium yang tidak diketahui diperkirakan mengalami fisi spontan.[59] ProduksiDi Afrika Selatan, mayoritas deposit mangan yang telah diidentifikasi berlokasi di dekat Hotazel di propinsi Northern Cape, diperkirakan 15 miliar ton pada tahun 2011. Afrika Selatan memproduksi 3,4 juta ton pada tahun 2011, mengungguli negara-negara lainnya.[60] Mangan ditambang di Afrika Selatan, Australia, China, Brazil, Gabon, Ukraina, India, Fiji, Ghana, dan Kazakhstan. Sumber impor Amerika Serikat (1998-2001):
Untuk produksi feromangan, bijih mangan dicampur dengan bijih besi dan karbon, kemudian direduksi dalam tanur tinggi maupun tanur busur listrik.[62] Feromangan yang dihasilkan memiliki kandungan mangan antara 30 sampai 80%.[27] Mangan murni yang digunakan untuk produksi logam paduan bebas-besi dibuat melalui pelindian (leaching) bijih mangan dengan asam sulfat dan dilanjutkan dengan proses electrowinning.[63] 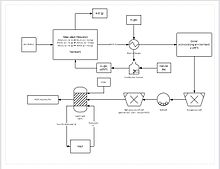 Proses ekstraksi yang lebih progresif melibatkan reduksi langsung bijih mangan dalam pelindian tumpuk (bahasa Inggris: heap leach). Ini dilakukan dengan perkolasi gas alam melalui bagian dasar heap; gas alam menyediakan panas (diperlukan minimal 850 °C) dan reduktor (karbon monoksida). Ini mereduksi seluruh bijih mangan menjadi mangan oksida (MnO), yang berupakan bentuk dapat-lindinya. Bijih kemudian ditransport melalui sirkuit penggilingan untuk mengurangi ukuran partikel bijih menjadi antara 150-250 μm, meningkatkan area permukaan yang dapat dilindi. Bijih kemudian dimasukkan ke dalam tangki pelindi yang berisi asam sulfat dan besi fero (Fe2+) dengan perbandingan 8:5. Besi bereaksi dengan mangan dioksida membentuk besi hidroksida dan unsur mangan. Proses ini menghasilkan rendemen mangan 92%. Untuk pemurnian lebih lanjut, mangan dapat diolah lebih lanjut di fasilitas electrowinning.[64]  Hampir dua pertiga pasokan dunia berasal dari dua reaktor; National Research Universal Reactor di Chalk River Laboratories di Ontario, Canada, dan High Flux Reactor di Nuclear Research and Consultancy Group di Petten, Belanda. Seluruh reaktor utama yang memproduksi teknesium-99m dibangun di era 1960an dan ditutup karena sudah habis masa hidupnya. Dua reaktor Canada baru, Multipurpose Applied Physics Lattice Experiment direncanakan dan dibangun untuk menghasilkan 200% kebutuhan teknesium-99m sehingga produsen lain tidak perlu membangun bangunan reaktor sendiri. Dengan dibatalkannya reaktor yang telah teruji pada tahun 2008, akan timbul masalah pasokan teknesium-99m di masa mendatang.[65] Hal yang meredam issue ini adalah pengumuman dari reaktor riset Maria di Polandia bahwa mereka telah mengembangkan teknik untuk mengisolasi teknesium. Reaktor Chalk River berhenti beroperasi pada Agustus 2009 dalam rangka pemeliharaan, dan beroperasi kembali pada tahun 2010. Reaktor Petten yang memiliki pemeliharaan terjadwal setiap 6 bulan berhenti beroperasi pada 19 Februari 2010 dan kembali beroperasi pada September 2010.[66] Dengan jutaan prosedur yang bersandar pada teknesium-99m setiap tahunnya, rendahnya pasokan telah meninggalkan kesenjangan, dan beberapa praktisi terpaksa kembali kepada teknik yang sudah tidak digunakan lagi selama 20 tahun.[67]  Rhenium komersial diekstraksi dari gas buang pemanggangan molibdenum yang diperoleh dari bijih tembaga-sulfida. Beberapa bijih molibdenum mengandung 0,001% sampai 0,2% rhenium.[51][53] Rhenium(IV) oksida dan asam perrhenat mudah larut dalam air; mereka dilindi dari debu dan gas buangan dan diekstraksi dengan cara presipitasi menggunakan kalium atau amonium klorida sebagai garam perrhenat, dan dimurnikan melalui rekristalisasi.[51] Produksi total dunia antara 40 sampai 50 ton/tahun; produsen utamanya adalah Chile, Amerika Serikat, Peru, dan Polandia.[68] Daur ulang katalis Pt-Re bekas dan logam paduan khusus memungkinkan perolehan kembali tambahan 10 ton per tahun. Harga logam ini meningkat tajam pada awal 2008, dari $1000-$2000 per kg pada tahun 2003-2006 menjadi $10.000 pada Februari 2008.[69][70] Bentuk logamnya disiapkan melalui reduksi amonium perrhenat dengan hidrogen pada suhu tinggi:[71] Saat ini, bohrium hanya untuk keperluan penelitian.[72] Oleh karena itu belum diproduksi secara massal untuk tujuan komersial. AplikasiMangan tidak memiliki pengganti yang memuaskan untuk aplikasi utamanya di bidang metalurgi.[45] Pada aplikasi minor, misalnya fosfasi mangan (manganese phosphating), seng dan kadang-kadang vanadium adalah pengganti yang layak.  Mangan penting untuk produksi baja dan besi dengan meningkatkan belerang-fixingnya, awaoksidasi dan sifat keterpaduannya, seperti yang diakui oleh metalurgis Inggris Robert Forester Mushet (1811 – 1891), yang, pada tahun 1856, mengintroduksi unsur ini, dalam bentuk Spiegeleisen, ke dalam baja dengan tujuan khusus menghilangkan kelebihan oksigen, belerang, dan fosfor terlarut dalam rangka meningkatkan ketertempaannya. Karya baja (bahasa Inggris: steelmaking),[73] termasuk komponen karya besinya, telah dianggap sebagai penyebab tingginya permintaan mangan, saat ini dalam kisaran 85% sampai 90% dari total permintaan.[63] Mangan adalah komponen kunci untuk baja nirkarat ekonomis.[61][74] Aplikasi mangan terbesar kedua adalah dalam paduan aluminium. Kandungan mangan 1,5% dalam paduan aluminium telah meningkatkan ketahanan terhadap korosi melalui butiran yang menyerap kotoran penyebab korosi galvanik.[75] Logam paduan aluminium (alloy aluminiu) tahan korosi 3004 dan 3104 (kandungan mangan 0,8% s/d 1,5%) digunakan untuk mayoritas kaleng minuman yang beredar.[76] Sebelum tahun 2000, lebih dari 1,6 juta ton logam paduan ini digunakan; pada konsentrasi mangan 1% berarti ini mengkonsumsi mangan sebanyak 16.000 ton.[76] Teknesium-99m ("m" menandakan bahwa ini adalah isomer nuklir metastabil) digunakan dalam uji medis isotop radioaktif. Misalnya teknesium-99m adalah pelacak radioaktif yang digunakan oleh peralatan pencitra medis untuk pelacakan di dalam tubuh manusia.[8][77] Isotop ini cocok dengan manfaat ini karena ia memancarkan sinar gamma 140 keV yang mudah dideteksi, dan waktu paruhnya sekitar 6,01 jam (artinya sekitar 94%nya meluruh menjadi teknesium-99 dalam 24 jam).[31] Kimia teknesium memungkinkannya terikat pada beragam senyawa biokimia, yang masing-masing menentukan jalur metabolisme dan cara penumpukan di dalam tubuh, dan isotop tunggal ini dapat digunakan untuk beragam uji diagnostik. Lebih dari 50 radiofarmasi didasarkan pada teknesium-99m untuk studi pencitraan dan fungsional otak, otot jantung, tiroid, paru-paru, liver, kantong empedu, ginjal, kerangka, darah, dan tumor.[78] Teknesium-99 meluruh hampir seluruhnya melalui peluruhan beta, memancarkan partikel beta dengan energi rendah yang konstan dan tanpa disertai sinar gamma. Selain itu, waktu paruhnya yang panjang berarti bahwa penurunan emisi ini sangat lambat seiring berjalannya waktu. Tc-99 dapat pula diekstraksi ke kemurnian dan isotopik tinggi dari limbah radioaktif. Berdasarkan alasan ini, ia merupakan emiter beta standar versi National Institute of Standards and Technology (NIST), dan digunakan untuk kalibrasi peralatan.[79] Teknesium-99 juga telah diusulkan untuk peralatan optoelektronik dan baterai nuklir skala nano.[80]  Rhenium ditambahkan ke dalam superaloy bersuhu tinggi yang digunakan untuk membuat bagian mesin jet, mengkonsumsi 70% dari produksi rhenium dunia.[81] Aplikasi utama lainnya adalah dalam katalis platina-rhenium, yang utamanya digunakan dalam pembuatan bensin beroktan tinggi bebas timbal.[82] Bohrium saat ini hanya digunakan untuk penelitian.[72] Peran biologisHanya mangan yang memiliki peran dalam tubuh manusia. Ia merupakan nutrisi renik esensial, dengan kandungan dalam tubuh sekitar 10 mg, terkonsentrasi di dalam liver dan ginjal. Banyak enzim mengandung mangan, membuatnya penting untuk kehidupan, dan juga ditemukan dalam kloroplas. Teknesium, rhenium, dan bohrium tidak memiliki peran biologis. Namun, teknesium digunakan untuk pencitraan radioaktif.  Mangan adalah unsur penting untuk kesehatan manusia, esensial untuk perkembangan, metabolisme, dan sistem antioksidan. Namun, paparan atau asupan berlebih dapat menyebabkan suatu kondisi yang dikenal sebagai manganisme, suatu gangguan neurodegeneratif yang menyebabkan kematian neuron dopaminergik dan gejala yang mirip dengan penyakit Parkinson.[43][83] Kelompok enzim yang memiliki kofaktor mangan cukup banyak dan meliputi oksidoreduktase, transferase, hidrolase, lyase, isomerase, ligase, lektin, dan integrin. Transkriptase balik dari banyak retrovirus (meski bukan lentivirus seperti HIV) mengandung mangan. Polipeptida terkenal yang mengandung mangan antara lain arginase, toksin difteri, dan superoksida dismutase yang mengandung Mn (Mn-SOD).[84] PencegahanMeskipun merupakan unsur renik esensial dalam tubuh manusia, mangan dapat bersifat toksik jika tertelan dalam jumlah di atas normal. Teknesium harus ditangani dengan hati-hati karena radioaktivitasnya. Senyawa mangan kurang beracun dibandingkan logam lainnya yang tersebar luas, seperti nikel dan tembaga.[85] Namun, paparan debu dan uap mangan sebaiknya tidak melebihi nilai batas atas 5 mg/m3 bahkan untuk jangka pendek karena tingkat toksisitasnya.[86] Keracunan mangan dikaitkan dengan gangguan keterampilan motorik dan gangguan kognitif.[87] Teknesium tidak memiliki peran biologis alami dan biasanya tidak ditemukan dalam tubuh manusia.[29] Teknesium diproduksi secara melalui fisi nuklir, dan lebih banyak didistribusikan daripada umumnya radionuklida. Ia tampaknya memiliki toksisitas kimia yang rendah. Misalnya, tidak ada perubahan signifikan dalam formula darah, berat badan dan organ, serta konsumsi makanan yang dapat dideteksi untuk tikus yang mengkonsumsi sampai 15g/ μg teknetium-99 per gram makanan selama beberapa minggu.[88] Toksisitas radiologis teknesium (per satuan massa) adalah fungsi senyawa, jenis radiasi isotop yang bersangkutan, dan waktu paruh isotop.[89] Sangat sedikit yang diketahui tentang toksisitas renium dan senyawanya karena penggunaannya dalam jumlah yang sangat kecil. Garam tetlarutnya, seperti rhenium halida atau perrhenat, bisa berbahaya karena unsur selain renium atau karena renium itu sendiri.[90] Hanya beberapa senyawa renium yang telah diuji toksisitas akutnya; dua contohnya adalah kalium perrhenat dan rhenium triklorida, yang disuntikkan sebagai larutan ke dalam tikus. Perrhenat memiliki LD50 2800 mg/kg setelah tujuh hari (ini adalah toksisitas yang sangat rendah, sama dengan garam meja) dan rhenium triklorida menunjukkan LD50 280 mg/kg.[91] Lihat Juga
Catatan
Referensi
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||








