|
Tabel periodik
 Tabel periodik, juga dikenal sebagai tabel periodik unsur (kimia), adalah tampilan tabular dari unsur-unsur kimia. Tabel ini banyak digunakan dalam kimia, fisika, dan ilmu-ilmu lainnya, dan umumnya dipandang sebagai ikon dari kimia. Tabel ini merupakan rumusan grafik dari hukum periodik, yang menyatakan bahwa sifat-sifat unsur kimia menunjukkan ketergantungan periodik pada nomor atomnya. Tabel ini dibagi menjadi empat area persegi panjang yang disebut blok. Baris-baris tabel disebut periode, dan kolom-kolomnya disebut golongan. Unsur-unsur dari golongan yang sama dari tabel periodik menunjukkan karakteristik kimia yang serupa. Tren berjalan melalui tabel periodik, dengan karakter nonlogam (menjaga elektronnya sendiri) meningkat dari kiri ke kanan dalam satu periode, dan dari bawah ke atas melintasi satu golongan, dan karakter logam (menyerahkan elektron ke atom lain) meningkat ke arah yang berlawanan. Alasan yang mendasari tren ini adalah konfigurasi elektron atom. Tabel periodik pertama yang diterima secara umum adalah tabel kimiawan Rusia Dmitri Mendeleev pada tahun 1869: ia merumuskan hukum periodik sebagai ketergantungan sifat kimia pada massa atom. Karena dahulu tidak semua unsur diketahui, ada celah dalam tabel periodiknya, dan Mendeleev berhasil menggunakan hukum periodik untuk memprediksi sifat beberapa unsur yang hilang. Hukum periodik diakui sebagai penemuan mendasar pada akhir abad ke-19, dan dijelaskan dengan penemuan nomor atom dan karya perintis dalam mekanika kuantum pada awal abad ke-20 yang menerangi struktur internal atom. Dengan penemuan Glenn T. Seaborg pada tahun 1945 bahwa aktinida sebenarnya adalah unsur blok-f dan bukannya unsur blok-d, bentuk tabel yang dikenali dapat dicapai. Tabel periodik dan hukum sekarang menjadi bagian sentral dan tak terpisahkan dari kimia modern. Tabel periodik terus berkembang seiring dengan kemajuan ilmu pengetahuan. Di alam, hanya unsur sampai nomor atom 94 yang ada; untuk melangkah lebih jauh, perlu untuk menyintesis unsur baru di laboratorium. Saat ini, semua 118 unsur pertama telah diketahui, melengkapi tujuh baris pertama tabel, tetapi karakterisasi kimia masih diperlukan untuk elemen terberat untuk memastikan bahwa sifat mereka cocok dengan posisinya. Belum diketahui seberapa jauh tabel akan terbentang di luar tujuh baris ini dan apakah pola bagian tabel yang diketahui akan berlanjut ke wilayah yang tidak diketahui ini. Beberapa diskusi ilmiah juga berlanjut mengenai apakah beberapa elemen diposisikan dengan benar dalam tabel hari ini. Ada banyak representasi alternatif dari hukum periodik, dan ada beberapa diskusi mengenai apakah ada bentuk optimal dari tabel periodik. IkhtisarStruktur atom Konstituen terkecil dari semua materi normal dikenal sebagai atom. Atom sangat kecil, berukuran sekitar sepersepuluh miliar meter; sehingga struktur internal mereka diatur oleh mekanika kuantum.[1] Atom terdiri dari nukleus bermuatan positif, terbuat dari proton bermuatan positif dan neutron tidak bermuatan, dikelilingi oleh awan elektron bermuatan negatif; muatannya hilang, sehingga atom bersifat netral.[2] Elektron berpartisipasi dalam reaksi kimia, tetapi nukleus tidak.[2] Ketika atom berpartisipasi dalam reaksi kimia, mereka dapat memperoleh atau kehilangan elektron untuk membentuk ion bermuatan positif atau negatif; atau mereka mungkin berbagi elektron satu sama lain sebagai gantinya.[3] Atom dapat dibagi lagi menjadi berbagai jenis berdasarkan jumlah proton (dan juga elektron) yang mereka miliki.[2] Ini disebut nomor atom, sering dilambangkan dengan Z[4] karena dalam bahasa Jerman nomor adalah Zahl. Setiap nomor atom berbeda karena itu sesuai dengan kelas atom: kelas ini disebut unsur kimia.[5] Unsur-unsur kimia diklasifikasikan dan diatur oleh tabel periodik. Hidrogen adalah unsur dengan nomor atom 1; helium, nomor atom 2; litium, nomor atom 3; dan seterusnya. Masing-masing nama ini selanjutnya dapat disingkat menjadi satu atau dua huruf, yang disebut dengan lambang unsur; untuk hidrogen, helium, dan litium berturut-turut adalah H, He, dan Li.[6] Neutron tidak mempengaruhi identitas kimia atom, tetapi mempengaruhi beratnya. Atom dengan jumlah proton yang sama tetapi jumlah neutron yang berbeda disebut isotop dari unsur kimia yang sama.[6] Unsur-unsur alami biasanya terjadi sebagai campuran isotop yang berbeda; karena setiap isotop biasanya muncul dengan kelimpahan yang berkarakter, unsur-unsur yang terbentuk secara alami memiliki massa atom yang terdefinisi dengan baik, yang didefinisikan sebagai massa rata-rata atom yang terbentuk secara alami dari unsur tersebut.[7] Saat ini, 118 unsur telah diketahui, dengan 94 unsur pertama diketahui terjadi secara alami di Bumi saat ini. Dari 94 unsur alami, 80 diantaranya memiliki isotop stabil; tiga lagi (bismut, torium, dan uranium) mengalami peluruhan radioaktif, tetapi sangat lambat sehingga sejumlah besar dapat bertahan dari pembentukan Bumi; dan sebelas peluruhan lainnya cukup cepat sehingga jejak mereka hanya bertumpu pada regenerasi konstan sebagai produk peluruhan thorium dan uranium. Ke-83 unsur yang bertahan dari pembentukan Bumi disebut primordial. Semua 24 unsur buatan yang diketahui adalah radioaktif.[6] Konfigurasi elektronTabel periodik adalah deskripsi grafis dari hukum periodik[8] yang menyatakan bahwa sifat dan struktur atom unsur kimia adalah fungsi periodik dari nomor atomnya.[9] Unsur-unsur ditempatkan dalam tabel periodik berdasarkan konfigurasi elektronnya,[10] yang menunjukkan pengulangan periodik yang menjelaskan tren periodik di seluruh tabel periodik.[11] Sebuah elektron dapat dianggap menghuni orbital atom, yang mencirikan bahwa kemungkinan ia dapat ditemukan di wilayah atom tertentu. Energi mereka terkuantisasi, yang mengatakan bahwa mereka hanya dapat mengambil nilai diskrit. Selanjutnya, elektron mematuhi asas larangan Pauli: elektron yang berbeda harus selalu berada dalam keadaan yang berbeda. Hal ini memungkinkan klasifikasi keadaan yang memungkinkan elektron dapat mengambil berbagai tingkat energi yang dikenal sebagai kulit, dibagi menjadi subkulit individu, yang masing-masing berisi jenis orbital tertentu. Setiap orbital dapat berisi hingga dua elektron: mereka dibedakan oleh kuantitas yang dikenal sebagai spin, yang dapat naik atau turun.[12] Elektron mengatur dirinya sendiri dalam atom sedemikian rupa sehingga energi total yang dimilikinya diminimalkan, lalu mereka menempati orbital dengan energi terendah yang tersedia kecuali jika energi telah disuplai.[13] Hanya elektron terluar (disebut elektron valensi) yang memiliki energi yang cukup untuk melepaskan diri dari inti dan berpartisipasi dalam reaksi kimia dengan atom lain. Yang lainnya disebut elektron inti.[14]
Unsur-unsur diketahui dapat memiliki hingga tujuh kulit pertama. Kulit pertama hanya berisi satu orbital, orbital s berbentuk bola. Karena sebagai kulit pertama, orbital ini disebut orbital 1s. Orbital ini dapat menampung hingga dua elektron. Kulit kedua juga berisi orbital 2s, tetapi juga mengandung tiga orbital p berbentuk seperti dumbbell, dan dengan demikian dapat mengisi hingga delapan elektron (2×1 + 2×3 = 8). Kulit ketiga berisi satu orbital 3s, tiga orbital 3p, dan lima orbital 3d, sehingga memiliki kapasitas 2×1 + 2×3 + 2×5 = 18. Kulit keempat berisi satu orbital 4s, tiga orbital 4p, lima orbital 4d, dan tujuh orbital 4f, sehingga menghasilkan kapasitas 2×1 + 2×3 + 2×5 + 2×7 = 32.[16] Kulit yang lebih tinggi mengandung lebih banyak jenis orbital yang melanjutkan polanya, tetapi jenis orbital seperti itu tidak diisi dengan unsur-unsur yang diketahui.[17] Jenis subkulit dicirikan oleh bilangan kuantum. Empat angka menggambarkan elektron dalam atom secara lengkap: bilangan kuantum utama n (kulit), bilangan kuantum azimut ℓ (jenis orbital), bilangan kuantum magnetik mℓ (di mana dari orbital jenis tertentu ia berada), dan bilangan kuantum spin s.[11] Urutan pengisian kulit Urutan pengisian orbital diberikan oleh prinsip Aufbau, juga dikenal sebagai aturan Madelung atau Klechkovsky. Kulitnya tumpang tindih dalam energi, menciptakan urutan yang kira-kira sebagai berikut:[18]
Di sini tanda ≪ berarti "jauh lebih sedikit dari" sebagai lawan dari < yang berarti hanya "kurang dari".[18] Dengan kata lain, elektron memasuki orbital dalam urutan peningkatan n + ℓ, dan jika dua orbital tersedia dengan nilai n + ℓ yang sama, n yang lebih rendah akan ditempati terlebih dahulu.[17][19] Tumpang tindih menjadi cukup dekat pada titik di mana orbital d memasuki gambar,[20] dan urutannya dapat sedikit bergeser dengan nomor atom[21] dan muatan atom.[22] Mulai dari atom yang paling sederhana, ini memungkinkan kita menyusun tabel periodik satu per satu sesuai urutan nomor atom, dengan mempertimbangkan kasus atom tunggal. Dalam hidrogen, hanya ada satu elektron, yang harus berada di orbital 1s dengan energi terendah. Konfigurasi hidrogen ditulis dengan 1s1. Helium menambahkan elektron kedua, yang juga masuk ke 1s dan mengisi kulit pertama sepenuhnya.[11] Unsur ketiga, litium, tidak memiliki ruang lagi di kulit pertama. Oleh karena itu, elektron ketiganya harus masuk ke subkulit 2s, memberikan konfigurasi 1s2 2s1. Elektron 2s adalah satu-satunya elektron valensi litium, karena orbital 1s sekarang terlalu dekat dengan nukleus untuk berpartisipasi secara kimia. Subkulit 2s dilengkapi dengan oleh unsur berikutnya, berilium (1s2 2s2). Unsur-unsur berikutnya kemudian melanjutkan mengisi orbital p. Boron (1s2 2s2 2p1) menempatkan elektron barunya pada orbital 2p; karbon (1s2 2s2 2p2) mengisi orbital 2p kedua; dan dengan nitrogen (1s2 2s2 2p3) ketiga orbital 2p menjadi terisi tunggal. Hal ini sesuai dengan aturan Hund, yang menyatakan bahwa atom akan lebih suka menempati sendiri setiap orbital dari jenis yang sama sebelum mengisinya dengan elektron kedua. Oksigen (1s2 2s2 2p4), fluorin (1s2 2s2 2p5), dan neon (1s2 2s2 2p6) kemudian melengkapi orbital 2p yang sudah terisi tunggal; dengan neon mengisi kulit kedua sepenuhnya.[11] Mulai dari unsur 11, natrium, tidak ada lagi ruang di kulit kedua, yang mulai sekarang adalah kulit inti seperti yang pertama. Jadi elektron kesebelas memasuki orbital 3s sebagai gantinya. Inti 1s2 2s2 2p6 disingkat [Ne], karena identik dengan konfigurasi elektron neon: jadi konfigurasi natrium ditulis [Ne] 3s1. Magnesium ([Ne] 3s2) menyelesaikan orbital 3s ini, dan sejak itu enam unsur aluminium, silikon, fosforus, belerang, klorin, dan argon mengisi tiga orbital 3p ([Ne] 3s2 3p1 hingga [Ne] 3s2 3p6). Hal ini menciptakan rangkaian analog di mana struktur kulit terluar natrium melalui argon persis sejalan dengan litium hingga neon, dan merupakan dasar untuk periodisitas kimia yang diilustrasikan oleh tabel periodik:[11] pada interval nomor atom yang teratur tetapi berubah, sifat-sifat unsur kimia kira-kira berulang.[8] 18 unsur pertama dengan demikian dapat diatur sebagai awal dari tabel periodik. Unsur-unsur dalam kolom yang sama memiliki jumlah elektron terluar dan konfigurasi elektron terluar yang sama: kolom-kolom ini disebut golongan. Pengecualian tunggal adalah helium, yang memiliki dua elektron terluar seperti berilium dan magnesium, tetapi ditempatkan dengan neon dan argon untuk menekankan bahwa kulit terluarnya penuh. Ada delapan kolom dalam fragmen tabel periodik ini, sesuai dengan paling banyak delapan elektron terluar.[3] Sebuah baris dimulai ketika kulit baru mulai terisi; baris-baris ini disebut periode.[16] Terakhir, pewarnaan menggambarkan blok: unsur-unsur di blok-s (berwarna merah) mengisi orbital s, sedangkan di blok-p (berwarna kuning) mengisi orbital p.[16]
Mulai baris berikutnya, untuk kalium dan kalsium, orbital 4s memiliki energi terendah, dan karena itu mereka mengisinya. Kalium menambahkan satu elektron ke kulit 4s ([Ar] 4s1), dan kalsium kemudian melengkapinya ([Ar] 4s2). Namun, mulai dari skandium, orbital 3d menjadi energi tertinggi berikutnya. Orbital 4s dan 3d memiliki energi yang kira-kira sama dan mereka bersaing untuk mengisi elektron, sehingga pendudukan tidak cukup konsisten mengisi orbital 3d satu per satu. Urutan energi yang tepat dari 3d dan 4s berubah sepanjang baris, dan juga berubah tergantung pada berapa banyak elektron yang dilepaskan dari atom. Misalnya, karena adanya gaya tolak menolak antara elektron 3d dan elektron 4s, pada kromium tingkat energi 4s menjadi sedikit lebih tinggi daripada 3d, sehingga menjadi lebih menguntungkan untuk memiliki konfigurasi [Ar] 3d5 4s1 daripada konfigurasi [Ar] 3d4 4s2. Anomali serupa terjadi pada tembaga.[11] Ini adalah pelanggaran aturan Madelung. Anomali semacam ini tidak memiliki signifikansi kimia,[22] karena berbagai konfigurasi memiliki energi yang sangat dekat satu sama lain[20] sehingga keberadaan atom di dekatnya dapat menggeser keseimbangan.[11] Oleh karena itu, tabel periodik mengabaikan ini dan hanya mempertimbangkan konfigurasi yang diidealkan.[10] Pada seng, orbital 3d terisi penuh dengan total sepuluh elektron. Berikutnya adalah orbital 4p yang melengkapi baris, yang diisi secara bertahap dari galium hingga kripton, dengan cara yang sama sekali mirip dengan elemen blok-p sebelumnya.[11] Dari galium dan seterusnya, orbital 3d membentuk bagian dari inti elektronik, dan tidak lagi berpartisipasi dalam kimia. Elemen blok s dan p, yang mengisi kulit terluarnya, disebut unsur golongan utama; elemen blok-d (berwarna biru di bawah), yang mengisi kulit bagian dalam, disebut unsur transisi (atau logam transisi, karena semuanya adalah logam).[23] Karena 5s terisi sebelum 4d, yang terisi sebelum 5p, baris kelima memiliki struktur yang persis sama dengan baris keempat (meskipun sekali lagi ada beberapa anomali saat mengisi orbital 4d).[16]
Baris keenam tabel juga dimulai dengan dua elemen blok-s: sesium dan barium. Setelah ini, elemen blok-f pertama (berwarna hijau di bawah) mulai muncul, dimulai dengan lantanum. Golongan ini kadang-kadang disebut unsur transisi dalam.[23] Karena sekarang tidak hanya terdapat subkulit 4f tetapi juga 5d dan 6s pada energi yang sama, persaingan terjadi sekali lagi dengan banyak konfigurasi yang tidak beraturan;[20] hal ini mengakibatkan beberapa perselisihan tentang di mana tepatnya blok-f seharusnya dimulai, tetapi kebanyakan yang mempelajari masalah ini setuju bahwa itu dimulai di lantanum sesuai dengan prinsip Aufbau.[24] Meskipun lantanum sendiri tidak mengisi orbital 4f karena gaya tolak menolak antar elektron,[22] orbital 4f-nya memiliki energi yang cukup rendah untuk berpartisipasi dalam kimia.[25] Pada iterbium, tujuh orbital 4f terisi penuh dengan empat belas elektron; setelah itu diikuti oleh serangkaian sepuluh unsur transisi (lutesium hingga raksa),[26][27][28] dan akhirnya enam unsur golongan utama (talium hingga radon) melengkapi periode tersebut.[29] Baris ketujuh juga sejalan dengan baris keenam: 7s mengisi, lalu 5f, lalu 6d, dan akhirnya 7p, dengan beberapa anomali di sepanjang jalan.[16] Untuk waktu yang sangat lama, baris ketujuh tidak lengkap karena sebagian besar elemennya tidak terjadi di alam. Unsur-unsur yang hilang setelah uranium mulai disintesis di laboratorium pada tahun 1940, ketika neptunium dibuat.[30] Baris ini selesai dengan penyintetisan tenesin pada tahun 2010[31] (elemen terakhir, oganeson, telah dibuat pada tahun 2002),[32] dan elemen terakhir pada baris ketujuh ini divalidasi dan diberi nama pada tahun 2016.[33]
Ini melengkapi tabel periodik modern, dengan ketujuh baris terisi penuh.[33] Tabel berikut menunjukkan konfigurasi elektron atom netral fase gas dari setiap unsur. Konfigurasi yang berbeda dapat disetujui di lingkungan kimia yang berbeda.[22] Unsur-unsur golongan utama memiliki konfigurasi elektron yang sepenuhnya teratur; elemen transisi dan transisi dalam menunjukkan dua puluh ketidakteraturan karena kompetisi yang disebutkan di atas antara subkulit yang dekat dalam tingkat energi. Untuk sepuluh unsur terakhir (109–118), data eksperimen yang diperoleh kurang[34] dan oleh karena itu konfigurasi yang dihitung telah ditampilkan sebagai gantinya.[35] Subkulit yang terisi penuh telah berwarna abu-abu.
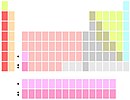
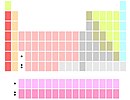
Bentuk penyajianUntuk alasan ruang, tabel periodik biasanya disajikan dengan elemen blok-f yang dipotong dan ditempatkan sebagai catatan kaki di bawah bagian utama tabel, seperti di bawah ini.[3][16][36]
Kedua bentuk tersebut mewakili tabel periodik yang sama.[6] Bentuk dengan blok-f yang termasuk dalam bagian utama kadang-kadang disebut bentuk 32-kolom[6] atau bentuk panjang;[37] bentuk dengan potongan blok-f kadang-kadang disebut bentuk 18-kolom[6] atau bentuk sedang-panjang.[37] Bentuk 32-kolom memiliki keuntungan menampilkan semua elemen dalam urutan yang benar, tetapi memiliki kelemahan membutuhkan lebih banyak ruang.[38] Semua tabel periodik menunjukkan simbol unsur; banyak juga yang memberikan informasi tambahan tentang elemen, baik melalui kode warna atau sebagai data dalam sel. Tabel di atas menunjukkan nama dan nomor atom unsur, klasifikasi unsur yang berbeda, dan kejadian alami. Tabel lain dapat mencakup sifat-sifat seperti keadaan materi, titik leleh dan titik didih, massa jenis, massa atom relatif, pengelompokan bloknya, serta memberikan. Untuk unsur-unsur berumur pendek tanpa massa atom relatif, nomor massa dari isotop yang diketahui paling stabil digunakan sebagai gantinya. Di bawah konvensi penamaan internasional, golongan-golongan diberi nomor numerik dari 1 sampai 18 dari kolom paling kiri (logam alkali) ke kolom paling kanan (gas mulia). Grup blok-f diabaikan dalam penomoran ini.[39] Golongan juga dapat diberi nama berdasarkan elemen pertamanya, misalnya "golongan skandium" untuk golongan 3.[39] Sebelumnya, golongan dikenal dengan menggunakan angka Romawi. Di Amerika, angka Romawi diikuti oleh "A" jika golongan berada di blok-s atau -p, atau "B" jika golongan berada di blok-d. Angka Romawi yang digunakan sesuai dengan digit terakhir dari konvensi penamaan hari ini (misalnya, unsur golongan 4 adalah golongan IVB, dan unsur golongan 14 adalah golongan IVA). Di Eropa, hurufnya serupa, hanya terdapat perbedaan letaknya, "A" digunakan jika golongan itu sebelum golongan 10, dan "B" digunakan untuk golongan yang termasuk dan setelah golongan 10. Selain itu, golongan 8, 9 dan 10 dulu diperlakukan sebagai satu golongan berukuran tiga kali lipat, yang dikenal secara kolektif di kedua notasi sebagai golongan VIII. Pada tahun 1988, sistem penamaan IUPAC baru mulai digunakan, dan nama grup lama tidak digunakan lagi.[36]
Metode pengelompokanGolonganGolongan atau famili adalah kolom vertikal dalam tabel periodik. Golongan biasanya mempunyai tren periodik yang lebih bermakna daripada periode dan blok, yang akan dijelaskan kemudian. Teori mekanika kuantum modern dari struktur atom menjelaskan bahwa unsur-unsur yang berada dalam golongan yang sama memiliki konfigurasi elektron yang sama pada kulit valensinya.[40] Akibatnya, unsur-unsur dalam golongan yang sama cenderung memiliki sifat serta tren yang jelas seiring dengan kenaikan nomor atom.[41] Namun, dalam beberapa bagian tabel periodik, seperti blok-d dan blok-f, kesamaan horisontal lebih penting, atau lebih jelas daripada kesamaan vertikalnya.[42][43][44] Pada konvensi tatanama internasional, golongan diberi angka numerik dari 1 hingga 18 dari kolom paling kiri (logam alkali) hingga kolom paling kanan (gas mulia).[45] Sebelumnya, dikenal penomoran menggunakan angka Romawi. Di Amerika, angka Romawi diikuti dengan huruf "A" jika golongan berada dalam blok-s atau blok-p, atau "B" jika berada pada blok-d. Angka Romawi digunakan merujuk pada angka terakhir konvensi penamaan terkini (misal: unsur golongan 4 sebelumnya adalah IVB, dan golongan 14 sebelumnya adalah golongan IVA). Di Eropa, penggunaan abjad juga sama, kecuali: "A" digunakan jika golongan berada sebelum golongan 10, dan "B" digunakan untuk golongan 10 dan seterusnya. Selain itu, golongan 8, 9, dan 10 diperlakukan sebagai satu golongan berukuran tiga, telah diketahui secara umum yang diberi tanda golongan VIII. Pada tahun 1988, digunakan sistem penamaan IUPAC baru, dan nama golongan lama telah dianggap usang.[46] Beberapa golongan ini telah memiliki nama trivial (non-sistematis), seperti terlihat pada tabel di bawah, meskipun jarang digunakan. Golongan 3–10 tidak memiliki nama trivial dan hanya merujuk pada nomor golongannya atau nama unsur teratas dalam golongan tersebut (misalnya, "golongan skandium" untuk Golongan 3), karena hanya memiliki sedikit kesamaan tren vertikal.[45] Unsur-unsur dalam golongan yang sama cenderung menunjukkan pola tertentu dalam hal jari-jari atom, energi ionisasi, dan elektronegativitas. Dari atas ke bawah dalam satu golongan, jari-jari atom bertambah. Oleh karena lebih banyak tingkat energi yang terisi, elektron valensi ditemukan lebih jauh dari inti atom. Dari atas ke bawah, masing-masing unsur yang berurutan memiliki energi ionisasi yang lebih rendah karena lebih mudah melepaskan elektron akibat ikatan atom yang kurang kuat. Demikian pula, dari atas ke bawah elektronegativitasnya juga semakin kecil akibat penambahan jarak antara elektron valensi dengan inti atom.[47] Terdapat perkecualian terhadap tren ini, misalnya yang terjadi pada golongan 11 di mana elektronegativitas meningkat dalam satu golongan dari atas ke bawah.[48]
PeriodePeriode adalah baris horizontal dalam tabel periodik. Meskipun golongan lebih menggambarkan tren periodik, tetapi ada beberapa bagian di mana tren horizontal lebih signifikan daripada tren vertikal. Seperti pada blok-f, di mana lantanida dan aktinida membentuk dua seri unsur horizontal yang substansial.[49] Unsur-unsur dalam periode yang sama menunjukkan tren jari-jari atom, energi ionisasi, afinitas elektron, dan elektronegativitas. Dari kiri ke kanan dalam periode yang sama, jari-jari atom biasanya menyusut. Hal ini terjadi karena masing-masing unsur yang berurutan menambah proton dan elektron, yang menyebabkan elektron tertarik lebih dekat ke inti atom.[50] Penurunan jari-jari atom ini juga menyebabkan energi ionisasi meningkat dari kiri ke kanan dalam satu periode. Semakin kuat ikatan suatu unsur, semakin banyak energi yang diperlukan untuk melepas elektron. Elektronegativitas meningkat sesuai kenaikan energi ionisasi karena elektron tertarik ke inti atom.[47] Afinitas elektron juga menunjukkan kecenderungan serupa dalam periode yang sama. Logam (periode sebelah kiri) umumnya memiliki afinitas elektron yang lebih rendah daripada non logam (periode sebelah kanan), dengan pengecualian pada gas mulia.[51] Blok Bagian tertentu pada tabel periodik dapat dirujuk sebagai blok sesuai dengan urutan pengisian kulit elektron unsur-unsurnya. Masing-masing blok diberi nama sesuai dengan sub kulit tempat elektron terakhir berada.[52][n 1] Blok-s terdiri dari dua golongan pertama (logam alkali dan alkalil tanah) ditambah hidrogen dan helium. Blok-p terdiri dari enam golongan terakhir, yaitu golongan 13 hingga 18 sesuai IUPAC (3A hingga 8A sesuai penamaan Amerika), dan mengandung, sebagian besar, metaloid. Blok-d terdiri dari golongan 3 hingga 12 (atau golongan 3B hingga 2B dalam penggolongan sistem Amerika) dan seluruhnya merupakan logam transisi. Blok-f, sering kali diletakkan di bawah tabel utama, tidak mempunyai nomor golongan dan terdiri dari lantanida dan aktinida.[53] Logam, metaloid, dan nonlogam Sesuai dengan sifat fisika dan kimianya, unsur dapat diklasifikasikan ke dalam tiga kategori besar yaitu logam, metaloid dan nonlogam. Logam umumnya berkilau, padatan dengan konduktivitas tinggi, dapat membentuk aloy dengan logam lainnya dan membentuk senyawa ion serupa garam dengan nonlogam (selain gas mulia). Sebagian besar nonlogam berupa gas berwarna atau tak berwarna; nonlogam yang membentuk senyawa dengan nonlogam lainnya berikatan secara kovalen. Di antara logam dan nonlogam ada metaloid, yang mempunyai sifat di antara logam dan nonlogam atau campuran keduanya.[54] Logam dan nonlogam dapat diklasifikasikan lebih lanjut ke dalam subkategori yang menunjukkan gradasi sifat dari logam ke nonlogam, untuk unsur-unsur dalam periode yang sama. Logam terbagi ke dalam logam alkali yang reaktif, logam alkali tanah yang kurang reaktif, lantanida dan aktinida, logam transisi, dan terakhir logam pasca-transisi dengan sifat fisika dan kimia paling lemah. Nonlogam dibagi menjadi nonlogam poliatomik, yang lebih mirip dengan metaloid; nonlogam diatomik, yang merupakan nonlogam esensial; dan gas mulia monoatomik, yang merupakan nonlogam dan hampir inert sempurna. Penggolongan terspesialisasi seperti logam refraktori dan logam mulia, yang merupakan (dalam kasus ini) logam transisi, juga diketahui[55] dan terkadang dicantumkan.[56] Mengelompokkan unsur ke dalam kategori dan subkategori berdasarkan kesamaan sifat tidaklah sempurna. Terdapat suatu spektrum sifat di dalam masing-masing kategori dan tidaklah sulit untuk menentukan tumpangsuh pada perbatasan, seperti dalam kasus kebanyakan skema klasifikasi.[57] Berilium, misalnya, diklasifikasikan sebaga logam alkali tanah, meskipun memiliki kecenderungan amfoter secara kimia dan kebanyakan membentuk senyawa kovalen adalah dua hal yang melemahkan posisinya sebagai logam. Radon dikelompokkan sebagai nonlogam dan merupakan gas mulia tetapi mempunyai kecenderungan membentuk kation seperti logam. Dimungkinkan ada klasifikasi lainnya seperti pembagian unsur ke dalam kategori kelimpahan mineraloginya, atau struktur kristalnya. Pengkategorian unsur dimulasi sejak Hinrichs,[58] pada tahun 1869 menulis bahwa garis batas sederhana dapat digambarkan pada tabel periodik untuk menunjukkan unsur dengan kesamaan sifat, seperti logam dan nonlogam, atau unsur-unsur gas. Tren periodik Karena reaksi kimia melibatkan elektron valensi,[3] unsur-unsur dengan konfigurasi elektron terluar yang serupa mungkin dapat bereaksi serupa dan membentuk senyawa dengan proporsi unsur-unsur yang serupa di dalamnya.[59] Unsur-unsur tersebut ditempatkan dalam golongan yang sama, dan dengan demikian cenderung ada kesamaan dan kecenderungan yang jelas dalam sifat kimia saat sebuah unsur bergerak satu golongan ke bawah.[60] Karena konfigurasi yang mirip kembali secara berkala, sifat-sifat unsur menunjukkan pengulangan periodik. These periodic recurrences were Pengulangan periodik ini telah diketahui jauh sebelum teori dasar yang menjelaskannya dikembangkan.[61][62] Misalnya, valensi suatu unsur dapat didefinisikan baik sebagai jumlah atom hidrogen yang dapat bergabung dengannya untuk membentuk hidrida biner sederhana, atau sebagai dua kali jumlah atom oksigen yang dapat bergabung dengannya untuk membentuk oksida biner sederhana (yaitu, bukan peroksida atau superoksida). Valensi unsur golongan utama berhubungan langsung dengan nomor golongan: hidrida dalam golongan utama 1–2 dan 13–17 mengikuti rumus MH, MH2, MH3, MH4, MH3, MH2, dan terakhir MH. Oksida tertinggi malah meningkatkan valensi, mengikuti rumus M2O, MO, M2O3, MO2, M2O5, MO3, M2O7.[a] Konfigurasi elektron menunjukkan penjelasan yang siap dari jumlah elektron yang tersedia untuk ikatan,[59] meskipun penjelasan penuh memerlukan pertimbangan energi yang akan dilepaskan dalam membentuk senyawa dengan valensi yang berbeda daripada hanya mempertimbangkan konfigurasi elektronnya saja.[63] Saat ini gagasan valensi telah diperluas dengan bilangan oksidasi, yang merupakan muatan formal yang tersisa pada suatu unsur ketika semua unsur lain dalam suatu senyawa telah dihilangkan menjadi ionnya.[59] Karena unsur-unsur dalam golongan yang sama memiliki konfigurasi valensi yang sama, mereka biasanya menunjukkan perilaku kimia yang serupa. Misalnya, semua logam alkali di golongan pertama memiliki satu elektron valensi, dan membentuk kelas unsur yang sangat homogen: semuanya adalah logam lunak dan reaktif. Namun, ada banyak faktor yang terlibat, dan suatu golongan seringkali bisa agak heterogen. Misalnya, unsur stabil golongan 14 terdiri dari nonlogam (karbon), dua semikonductor (silikon dan germanium), dan dua logam (timah dan timbal). Mereka tetap bersatu dengan memiliki empat elektron valensi.[64] Jari-jari atom Jari-jari atom dalam tabel periodik bervariasi dalam cara yang dapat diperkirakan dan dijelaskan. Misalnya, jari-jari atom menurun untuk unsur-unsur yang terdapat dalam satu periode, dari logam alkali hingga gas mulia; dan jari-jari atom naik untuk unsur-unsur dalam satu golongan dari atas ke bawah. Jari-jari atom naik tajam antara gas mulia di akhir periode dan logam alkali di awal periode berikutnya. Kecenderungan jari-jari atom ini (dan berbagai sifat fisika dan kimia unsur-unsur lainnya) dapat dijelaskan menggunakan teori kulit elektron atom. Teori tersebut menyajikan bukti-bukti penting untuk pengembangan dan penegasan teori kuantum.[65] Elektron pada subkulit-4f, mulai dari cerium (unsur 58) hingga iterbium (unsur 70), tidak terlalu efektif melindungi kenaikan muatan inti karena subkulit-4f terlalu jauh dari inti atom. Unsur-unsur tepat setelah lantanida memiliki jari-jari atom yang lebih kecil daripada yang diperkirakan dan hampir sama dengan jari-jari atom unsur-unsur tepat di atasnya.[66] Oleh karena itu, hafnium secara virtual memiliki jari-jari atom dan (sifat kimia) seperti zirkonium, dan tantalum memiliki jari-jari atom yang sama dengan niobium, dan selanjutnya. Hal ini dikenal sebagai kontraksi lantanida. Pengaruh kontraksi lantanida terpantau hingga platina (unsur 78), setelah ditutupi oleh efek relativistik yang dikenal sebagai efek pasangan inert.[67] Kontraksi blok-d, yang memiliki pengaruh sama antara blok-d dan blok-p, kurang begitu dikenal dibandingkan kontraksi lantanida, tetapi menimbulkan akibat yang serupa.[66] Energi ionisasi  Energi ionisasi pertama adalah energi yang diserap untuk melepas satu elektron dari sebuah atom. Energi ionisasi kedua adalah energi yang diserap untuk melepas elektron kedua dari sebuah atom, dan seterusnya. Untuk sebuah atom, energi ionisasi yang berurutan meningkat sesuai dengan kenaikan derajat ionisasi. Magnesium, misalnya, memiliki energi ionisasi pertama 738 kJ/mol dan yang kedua sebesar 1.450 kj/mol. Elektron pad orbital yang lebih dekat mengalami gaya tarik elektrostatik yang lebih besar, sehingga untuk melepaskannya diperlukan energi yang lebih banyak. Energi ionisasi meningkat dari bawah ke atas (dalam satu golongan) dan dari kiri ke kanan (dalam satu periode) tabel periodik.[67] Lonjakan besar energi ionisasi terjadi saat melepaskan satu elektron dari konfigurasi gas mulia (kulit elektron lengkap). Magnesium, misalnya, dua energi ionisasi pertama yang sudah dijelaskan di atas digunakan untuk melepaskan dua elektron 3s, dan energi ionisasi ketiga jauh lebih besar yaitu 7.730 kj/mol, untuk menghilangkan sebuah elektron 2p dari konfigurasi Mg2+ yang mirip neon. Lonjakan serupa juga terjadi pada energi ionisasi atom-atom baris ketiga lainnya.[67] Elektronegativitas Elektronegativitas adalah kecenderungan suatu atom untuk menarik elektron.[68] Elektronegativitas suatu atom dipengaruhi oleh nomor atom dan jarak antara elektron valensi dengan inti atom. Semakin besar elektronegativitasnya, semakin kuat unsur menarik elektron. Ini pertama kali dikemukakan oleh Linus Pauling pada tahun 1932.[69] Secara umum, elektronegativitas meningkat dari kiri ke kanan dalam periode yang sama, dan menurun dari atas ke bawah dalam golongan yang sama. Oleh karena itu, fluorin adalah unsur yang paling elektronegatif,[n 3] sementara sesium adalah yang paling lemah elektronegativitasnya.[48] Terdapat beberapa pengecualian dari aturan umum ini. Galium dan germanium memiliki elektronegativitas yang lebih tinggi daripada aluminium dan silikon karena kontraksi blok-d. Unsur-unsur periode empat tepat setelah baris pertama logam transisi memiliki jari-jari atom yang lebih kecil karena elektron-3d tidak efektif melindungi kenaikan muatan inti, dan ukuran atam yang lebih kecil berkorelasi dengan elektronegativitas yang lebih tinggi.[48] Anomali elektronegativitas timbal yang lebih besar daripada talium dan bismut tampaknya lebih disebabkan pada pengumpulan data (dan ketersediaan data)—termasuk metode kalkulasi—karena metode Pauling tidak menunjukkan kejanggalan tren untuk unsur-unsur tersebut.[70] Afinitas elektron Afinitas elektron suatu atom adalah jumlah energi yang dilepaskan ketika sebuah elektron ditambahkan ke dalam atom netral untuk membentuk ion negatif. Meskipun afinitas elektron sangat bervariasi, tetapi ada pola yang dapat ditarik. Secara umum, nonlogam memiliki nilai afinitas elektron yang lebih positif daripada logam. Klorin adalah yang paling kuat dalam menarik elektron. Afinitas elektron gas mulia belum sepenuhnya terukur, oleh karenanya mungkin memiliki nilai yang sedikit negatif.[73] Afinitas elektron umumnya meningkat sepanjang periode. Hal ini disebabkan oleh terisinya kulit valensi atom; sebuah atom golongan 17 membebaskan energi lebih besar daripada atom golongan 1 untuk menarik elektron karena atom-atom golongan 17 memiliki kulit valensi yang hampir penuh sehingga lebih stabil.[73] Kecenderungan afinitas elektron menurun sepanjang golongan dari atas ke bawah sudah diperkirakan. Elektron tambahan akan memasuki orbital yang lebih jauh dari inti atom. Oleh karena elektron ini kurang tertarik oleh inti atom, maka pelepasan energinya juga lebih kecil ketika ditambahkan. Meski demikian, dalam satu golongan dari atas ke bawah, sekitar sepertiga unsur mengalami anomali, yaitu unsur-unsur yang lebih berat memiliki afinitas elektron yang lebih tinggi daripada unsur-unsur yang lebih ringan. Sebagian besar, hal ini akibat dari kurangnya perlindungan dari elektron-elektron d dan f. Penurunan seragan afinitas elektron hanya berlaku pada atom-atom golongan 1.[74] Sifat logamZat sederhana adalah zat yang terbentuk dari atom-atom dari satu unsur kimia. Zat sederhana dari atom yang lebih elektronegatif cenderung berbagi elektron (membentuk ikatan kovalen) satu sama lain. Mereka membentuk molekul kecil (seperti hidrogen atau oksigen, yang atom-atomnya berpasangan) atau struktur raksasa yang membentang tanpa batas (seperti karbon atau silikon). Gas mulia tetap sebagai atom tunggal, karena mereka sudah memiliki kulit yang terisi penuh.[3] Zat yang terdiri dari molekul diskrit atau atom tunggal disatukan oleh gaya tarik menarik yang lebih lemah antara molekul, seperti gaya dispersi London: ketika elektron bergerak di dalam molekul, mereka menciptakan ketidakseimbangan muatan listrik sesaat, yang menginduksi ketidakseimbangan serupa pada molekul di dekatnya dan menciptakan pergerakan elektron yang tersinkronisasi melintasi banyak molekul tetangga.[75] Namun, atom yang lebih elektropositif cenderung kehilangan elektron, menciptakan "lautan" elektron yang menelan kation.[3] Orbital terluar dari satu atom tumpang tindih untuk berbagi elektron dengan semua tetangganya, menciptakan sebuah struktur orbital molekul raksasa yang memanjang di seluruh bagian struktur.[76] "Laut" bermuatan negatif ini menarik semua ion dan menyatukannya dalam ikatan logam. Unsur-unsur yang membentuk ikatan semacam itu disebut logam; mereka yang tidak disebut nonlogam.[3] Beberapa elemen dapat membentuk beberapa zat sederhana dengan struktur yang berbeda: ini disebut alotrop. Misalnya, berlian dan grafit adalah dua alotrop karbon.[64] Sifat logam suatu unsur dapat diprediksi dari sifat-sifat elektronik. Ketika orbital atom tumpang tindih selama ikatan logam atau kovalen, mereka menciptakan orbital molekul ikatan dan antiikatan dengan kapasitas yang sama, dengan orbital antiikatan berenergi lebih tinggi. Karakter ikatan bersih terjadi ketika elektron pada orbital ikatan lebih banyak daripada jumlah elektron pada orbital antiikatan. Ikatan logam dengan demikian dimungkinkan ketika jumlah elektron yang terdelokalisasi oleh setiap atom kurang dari dua kali jumlah orbital yang berkontribusi saat tumpang tindih. Ini adalah situasi untuk unsur-unsur dalam golongan 1 sampai 13; mereka juga memiliki terlalu sedikit elektron valensi untuk membentuk struktur kovalen raksasa di mana semua atom mengambil posisi yang setara, dan hampir semuanya menjadi logam. Pengecualiannya adalah hidrogen dan boron, yang memiliki energi ionisasi yang terlalu tinggi. Hidrogen dengan demikian membentuk molekul kovalen H2, dan boron membentuk struktur kovalen raksasa berdasarkan kluster B12 ikosahedral. Dalam sebuah logam, orbital ikatan dan antiikatan memiliki energi yang tumpang tindih, menciptakan pita tunggal yang dapat dilalui elektron dengan bebas, memungkinkan terjadinya konduksi listrik.[77] Di golongan 14, ikatan logam dan kovalen menjadi mungkin. Dalam kristal berlian, ikatan kovalen antara atom karbon kuat, karena mereka memiliki jari-jari atom kecil dan dengan demikian nukleus lebih banyak menahan elektron. Oleh karena itu, orbital ikatan yang dihasilkan memiliki energi yang jauh lebih rendah daripada orbital antiikatan, dan tidak ada tumpang tindih, sehingga konduksi listrik menjadi tidak mungkin: karbon adalah nonlogam. Namun, ikatan kovalen menjadi lebih lemah untuk atom yang lebih besar, sehingga silikon dan germanium memiliki celah pita yang lebih kecil dan merupakan semikonduktor: elektron dapat melewati celah saat tereksitasi secara termal. Akhirnya celah pita menghilang dalam timah, sehingga timah dan timbal menjadi logam.[77] Unsur-unsur dalam golongan 15 sampai 17 memiliki terlalu banyak elektron untuk membentuk molekul kovalen raksasa yang membentang di seluruh dimensi. Untuk unsur yang lebih ringan, ikatan dalam molekul diatomik kecil begitu kuat sehingga fase terkondensasi tidak dapat terjadi: dengan demikian nitrogen (N2), oksigen (O2), fosforus putih (P4), belerang (S8), dan halogen stabil (F2, Cl2, Br2, and I2) dapat membentuk molekul kovalen dengan sedikit atom. Unsur yang lebih berat cenderung membentuk rantai panjang (misalnya fosforus merah, selenium abu-abu, telurium) atau struktur berlapis (misalnya karbon sebagai grafit, fosforus hitam, arsen abu-abu, antimon abu-abu, bismut) yang hanya memanjang dalam satu atau dua daripada tiga dimensi. Karena struktur ini tidak menggunakan semua orbitalnya untuk ikatan, mereka berakhir dengan pita ikatan, nonikatan, dan antiikatan dengan urutan peningkatan energi. Sama halnya dengan golongan 14, celah pita menyusut untuk unsur yang lebih berat dan pergerakan bebas elektron antara rantai atau lapisan menjadi mungkin. Jadi misalnya fosforus hitam, arsen hitam, selenium abu-abu, telurium, dan iodin adalah semikonduktor; arsen abu-abu, antimon abu-abu, dan bismut adalah semilogam (memperlihatkan konduksi kuasi-logam, dengan tumpang tindih pita yang sangat kecil); dan polonium dan mungkin astatin adalah logam sejati.[77] Akhirnya, semua unsur golongan 18 alami tetap sebagai atom individu.[77][b] Garis pemisah antara logam dan nonlogam kira-kira diagonal dari kiri atas ke kanan bawah, dengan deret transisi muncul di sebelah kiri diagonal ini (karena mereka memiliki banyak orbital yang tersedia untuk tumpang tindih). Hal ini sudah diperkirakan, karena sifat logam cenderung berkorelasi dengan elektropositivitas dan kesediaan untuk kehilangan elektron, yang meningkat dari kanan ke kiri dan dari atas ke bawah. Dengan demikian, jumlah logam jauh lebih banyak daripada nonlogam. Unsur-unsur yang berada di dekat garis batas sulit untuk diklasifikasikan: mereka cenderung memiliki sifat-sifat yang berada di antara sifat-sifat logam dan nonlogam, dan mungkin memiliki beberapa sifat yang khas dari keduanya. Mereka sering disebut semilogam atau metaloid.[3] Istilah "semilogam" yang digunakan dalam pengertian ini tidak boleh dikacaukan dengan pengertian fisik yang ketat yang berkaitan dengan struktur pita: bismut secara fisik adalah semilogam, tetapi umumnya dianggap sebagai logam oleh ahli kimia.[79]    Umumnya, logam terlihat mengkilap dan padat.[3] Mereka biasanya memiliki titik lebur dan titik didih yang tinggi karena kekuatan ikatan logam, dan sering kali dapat ditempa dan ulet (mudah diregangkan dan dibentuk) karena atom dapat bergerak relatif satu sama lain tanpa memutuskan ikatan logam.[80] Mereka dapat menghantarkan listrik karena elektron mereka bebas bergerak di ketiga dimensi. Demikian pula, mereka dapat menghantarkan panas, yang ditransfer oleh elektron sebagai energi kinetik ekstra: mereka bergerak lebih cepat. Sifat-sifat ini bertahan dalam keadaan cair, seolah-olah struktur kristal hancur saat meleleh, atom-atom masih bersentuhan dan ikatan logam tetap ada, meskipun melemah.[80] Logam cenderung reaktif terhadap nonlogam.[3] Beberapa pengecualian dapat ditemukan untuk generalisasi ini: misalnya, mangan,[81] arsen, antimon,[82] dan bismut cenderung rapuh;[83] kromium sangat keras;[84] galium, rubidium, sesium, dan raksa berbentuk cair pada atau mendekati suhu kamar;[c] dan logam mulia seperti emas secara kimiawi sangat inert.[85][86] Nonlogam menunjukkan sifat yang berbeda. Mereka yang membentuk kristal kovalen raksasa memiliki titik lebur dan titik didih yang tinggi, karena dibutuhkan energi yang cukup besar untuk mengatasi ikatan kovalen yang kuat. Molekul-molekul diskrit yang membentuk sebagian besar disatukan oleh gaya dispersi, yang lebih mudah diatasi; sehingga mereka cenderung memiliki titik leleh dan titik didih yang lebih rendah,[87] dan banyak yang berbentuk cair atau gas pada suhu kamar.[3] Nonlogam sering kali tampak kusam. Mereka cenderung reaktif terhadap logam, kecuali untuk gas mulia, yang inert terhadap sebagian besar zat.[3] Mereka rapuh ketika berbentuk padat karena atom mereka dipegang erat di tempatnya. Mereka kurang rapat dan menghantarkan listrik dengan buruk,[3] karena tidak ada elektron yang bergerak.[88] Di dekat garis batas, celah pita kecil dan oleh karena itu banyak elemen di wilayah itu merupakan semikonduktor.[88] Sekali lagi ada pengecualian; misalnya, berlian memiliki konduktivitas termal tertinggi dari semua bahan yang diketahui, lebih besar dari logam apa pun.[89] Hal yang umum untuk menetapkan kelas metaloid yang melintasi batas antara logam dan nonlogam, karena unsur-unsur di wilayah itu adalah perantara dalam sifat fisik dan kimia.[3] Namun, tidak ada konsensus dalam literatur untuk elemen mana yang harus ditunjuk. Bila kategori seperti itu digunakan, boron, silikon, germanium, arsen, antimon, dan telurium biasanya disertakan; tetapi kebanyakan sumber memasukkan unsur-unsur lain juga, tanpa kesepakatan tentang unsur-unsur tambahan mana yang harus ditambahkan, dan beberapa lainnya mengurangi dari daftar ini sebagai gantinya.[d] Misalnya, tabel periodik yang digunakan oleh American Chemical Society memasukkan polonium sebagai metaloid,[90] tetapi yang digunakan oleh Royal Society of Chemistry tidak,[91] dan yang termasuk dalam Encyclopædia Britannica tidak mengacu pada metaloid atau semilogam sama sekali.[92][e] Manifestasi lebih lanjut dari periodisitasAda beberapa hubungan lain di seluruh tabel periodik antara unsur-unsur yang tidak berada dalam golongan yang sama, seperti hubungan diagonal antara unsur-unsur yang bersebelahan secara diagonal (misalnya litium dan magnesium).[94] Beberapa kesamaan juga dapat ditemukan antara kelompok utama dan kelompok logam transisi, atau antara aktinida awal dan logam transisi awal, ketika unsur-unsur memiliki jumlah elektron valensi yang sama. Jadi, uranium agak menyerupai kromium dan wolfram dalam golongan 6,[94] karena ketiganya memiliki enam elektron valensi.[95] Baris pertama dari setiap blok cenderung menunjukkan sifat yang agak berbeda dari baris lainnya, karena orbital pertama dari setiap jenis (1s, 2p, 3d, 4f, 5g, dll.) secara signifikan lebih kecil daripada yang diperkirakan.[96] Derajat anomali tertinggi untuk blok-s, sedang untuk blok-p, dan kurang jelas untuk blok-d dan -f.[94] Ada juga perbedaan genap ganjil antara periode (kecuali pada blok-s) yang kadang-kadang dikenal sebagai periodisitas sekunder: unsur-unsur pada periode genap memiliki jari-jari atom yang lebih kecil dan lebih suka kehilangan elektron lebih sedikit, sedangkan unsur-unsur pada periode ganjil (kecuali periode pertama) berbeda dalam arah yang berlawanan. Jadi, banyak sifat di blok-p menunjukkan tren zigzag daripada tren mulus di sepanjang grup. Misalnya, fosforus dan antimon dalam periode ganjil dari grup 15 mudah mencapai bilangan oksidasi +5, sedangkan nitrogen, arsen, dan bismut dalam periode genap lebih suka tetap pada +3.[94][97]  Ketika inti atom menjadi bermuatan tinggi, relativitas khusus diperlukan untuk mengukur efek inti atom pada awan elektron. Efek relativistik ini mengakibatkan unsur-unsur berat semakin memiliki sifat yang berbeda dibandingkan dengan homolognya yang lebih ringan dalam tabel periodik. Misalnya, efek relativistik menjelaskan mengapa emas berwarna keemasan dan raksa adalah cairan.[98][99] Efek ini diperkirakan akan menjadi sangat kuat pada akhir periode ketujuh, berpotensi menyebabkan runtuhnya periodisitas.[100] Konfigurasi elektron dan sifat kimia hanya diketahui dengan jelas sampai unsur 108 (hasium), sehingga karakterisasi kimia dari unsur terberat tetap menjadi topik penelitian saat ini.[101] Banyak sifat fisik lain dari unsur-unsur menunjukkan variasi periodik sesuai dengan hukum periodik, seperti titik lebur, titik didih, kalor peleburan, entalpi penguapan, entalpi atomisasi, dan sebagainya. Variasi periodik serupa muncul untuk senyawa unsur, yang dapat diamati dengan membandingkan hidrida, oksida, sulfida, halida, dan sebagainya.[102] Sifat kimia lebih sulit untuk dijelaskan secara kuantitatif, tetapi juga menunjukkan periodisitasnya sendiri. Contohnya termasuk bagaimana bilangan oksidasi cenderung bervariasi dalam langkah 2 dalam unsur golongan utama, tetapi dalam langkah 1 untuk unsur transisi; variasi sifat asam dan basa dari unsur dan senyawanya; stabilitas senyawa; dan metode mengisolasi unsur.[59] Periodisitas telah digunakan secara luas untuk memprediksi sifat-sifat unsur baru dan senyawa baru yang tidak diketahui, dan merupakan pusat dari kimia modern.[103] SejarahPercobaan sistematisasi pertama Pada tahun 1789, Antoine Lavoisier mempublikasikan daftar 33 unsur kimia. Ia mengelompokkannya menjadi gas, logam, nonlogam, dan tanah.[104] Kimiawan menghabiskan waktu satu abad mencari skema klasifikasi yang lebih memadai. Pada tahun 1829, Johann Wolfgang Döbereiner mengamati bahwa banyak unsur yang dapat dikelompokkan ke dalam triad berdasarkan sifat-sifat kimianya. Litium, natrium, dan kalium, misalnya, dikelompokkan ke dalam satu triad sebagai logam lunak dan reaktif. Döbereiner juga mengamati bahwa, jika disusun berdasarkan berat atom, anggota kedua masing-masing triad memiiliki berat atom rata-rata anggota pertama dan ketiga.[105] Ini kemudian dikenal sebagai Hukum Triad.[106] Kimiawan Jerman Leopold Gmelin meneliti sistem ini, dan pada tahun 1843 mengidentifikasi sepuluh triad, tiga kelompok empat dan satu kelompok lima. Jean-Baptiste Dumas mempublikasikan penelitiannya pada tahun 1857 yang menjelaskan hubungan antara berbagai kelompok logam. Meskipun banyak kimiawan mencoba untuk mengidentifikasi hubungan antar kelompok kecil unsur, mereka belum berhasil membangun suatu skema yang dapat menampung semuanya.[105] Pada tahun 1858, kimiawan Jerman August Kekulé mengamati bahwa karbon sering kali menggandeng empat atom karbon lain. Metana, misalnya, mempunyai satu atom karbon dan empat atom hidrogen. Konsep ini kelak dikenal sebagai valensi; unsur yang berbeda berikatan dengan sejumlah atom yang berbeda.[107] Pada tahun 1862, Alexandre-Emile Béguyer de Chancourtois, geolog Prancis, mempublikasikan bentuk awal tabel periodik, yang disebutnya telluric helix atau sekrup. Ia adalah orang pertama yang mencatat periodisitas unsur-unsur. Dengan menyusun unsur dalam suatu spiral pada silinder menurut kenaikan berat atom, de Chancourtois menunjukkan bahwa unsur-unsur dengan kesamaan sifat terlihat muncul pada interval tertentu. Diagramnya mencantumkan pula beberapa ion dan senyawa sebagai tambahan, selain unsur-unsur. Makalahnya juga lebih banyak menggunakan istilah-istilah geologi daripada kimia, dan tidak menampilkan gambar; alhasil penelitiannya tidak menarik banyak pihak hingga diteruskan oleh Dmitri Mendeleev.[108] Pada tahun 1864, Julius Lothar Meyer, kimiawan Jerman, mempublikasikan tabel berisi 44 unsur yang disusun berdasarkan valensi. Tabel tersebut menunjukkan bahwa unsur-unsur dengan kesamaan sifat kimia sering kali memiliki valensi yang sama.[109] Di tempat terpisah, William Odling (kimiawan Inggris) mempublikasikan suatu penyusunan 57 unsur, yang disusun berdasarkan berat atomnya. Dengan beberapa ketakteraturan dan kesenjangan, ia melihat apa yang tampaknya menjadi periodisitas berat atom antara unsur-unsur dan bahwa ini sesuai dengan 'pengelompokan yang sudah pernah diterima.'[110] Odling menyinggung ide hukum periodik tapi ia tidak mengembangkannya.[111] Ia kemudian mengusulkan (pada tahun 1870) klasifikasi unsur-unsur berbasis valensi.[112]  Kimiawan Inggris John Newlands menerbitkan serangkaian makalah dari tahun 1863 hingga 1866 yang mencatat bahwa ketika unsur-unsur disusun berdasarkan kenaikan berat atom, sifat kimia dan fisika yang sama akan berulang pada interval delapan; tampaknya ia menyamakan periodisitas dengan oktaf musik.[113][114] Oleh karenanya disebut Hukum Oktaf. Bagaimanapun, idenya ini menyebabkan Newlands dicemooh oleh para koleganya, dan Chemical Society menolak mempublikasikan hasil karyanya.[115] Namun Newlands mampu merancang sebuah tabel unsur dan menggunakannya untuk memperkirakan keberadaan unsur-unsur yang belum ditemukan, seperti germanium.[116] Chemical Society akhirnya mengakui arti penting penemuan Newlands lima tahun setelah pengakuan terhadap Mendeleev.[117] Pada tahun 1867, Gustavus Hinrichs, kimiawan akademisi kelahiran Denmark yang menetap di Amerika, mempublikasikan sistem periodik spiral berdasarkan spektrum atom, berat atom dan kemiripan sifat kimia. Hasil karyanya dianggap idiosinkratis, tidak membumi dan berbelit-belit.[118][119] Tabel Mendeleev  Profesor kimia Rusia Dmitri Mendeleev dan kimiawan Jerman Julius Lothar Meyer secara terpisah mempublikasikan tabel periodik mereka pada tahun 1869 dan 1870.[120] Tabel Mendeleev merupakan versi pertamanya yang dipublikasikan, sementara Meyer merupakan versi pengembangan dari tabel Meyer versi 1864.[121] Keduanya membangun tabelnya dengan menyusun unsur-unsur dalam baris atau kolom sesuai berat atomnya dan memulai baris atau kolom baru ketika karakteristik unsur-unsurnya mulai berulang.[122] Pengakuan dan penerimaan yang diperoleh tabel Mendeleev berasal dari dua keputusan yang dibuatnya. Pertama ia meninggalkan beberapa lubang dalam tabel ketika ia menganggap bahwa unsur terkait belum diketemukan.[123] Mendeleev bukan kimiawan pertama yang melakukan ini, tetapi ia adalah yang pertama diakui menggunakan tren dalam tabel periodiknya untuk memprediksi sifat-sifat unsur yang hilang, seperti galium dan germanium.[124] Keputusan kedua adalah terkadang mengabaikan urutan yang dibuat berdasarkan berat atom dan mengganti dengan unsur di sebelahnya, seperti telurium dan iodin, agar tercapai klasifikasi yang lebih baik ke dalam famili kimianya. Akhirnya, pada tahun 1913, Henry Moseley menemukan nilai eksperimental muatan inti atau nomor atom masing-masing unsur, dan menunjukkan bahwa pengurutan model Mendeleev sebenarnya merujuk kepada kenaikan nomor atom.[125] Pentingnya nomor atom pada penyusunan tabel periodik tidak diapresiasi hingga eksistensi dan sifat-sifat proton dan netron dipahami. Tabel periodik Mendeleev menggunakan berat atom dan bukan nomor atom untuk menyusun unsur-unsurnya. Informasi yang terukur presisi pada zaman Mendeleev. Berat atom sejauh ini cocok bagi sebagian besar kasus, mampu menyajikan prediksi sifat-sifat unsur-unsur yang hilang secara lebih akurat dibandingkan metode-metode lain yang telah diketahui. Penggantian metode ke nomor atom, memberikan urutan unsur berdasarkan bilangan bulat, dan Moseley memperkirakan bahwa unsur yang hilang (tahun 1913) antara aluminium (Z=13) dan emas (Z=79) adalah Z = 43, 61, 72 dan 75, yang akhirnya diketemukan. Urutan nomor atom masih digunakan hingga sekarang, bahkan sebagai dasar penelitian dan pembuatan produk sintetis baru.[126] Versi kedua beserta pengembangannyaTabel periodik Mendeleev 1871 dengan delapan golongan unsur. Garis putus-putus menandakan unsur yang belum diketahui tahun 1871. Tabel periodik model delapan kolom, sudah diperbarui dengan seluruh unsur hingga yang ditemukan tahun 2015. Pada tahun 1871, Mendeleev mempublikasikan tabel periodiknya dalam bentuk baru, dengan mengelompokkan unsur-unsur yang memiliki kesamaan dalam kolom, tidak lagi dalam baris, dan kolom-kolom ini diberi angka I hingga VIII sesuai dengan tingkat oksidasi unsur-unsurnya. Ia juga memberikan prakiraan detail sifat-sifat unsur yang telah disebutkan sebelumnya sebagai hilang, tetapi sebetulnya menurut dia ada.[127] Sela ini perlahan-lahan terisi ketika para kimiawan menemukan unsur-unsur tambahan yang ada secara alami.[128] Sering dinyatakan bahwa unsur alami terakhir yang ditemukan adalah fransium (merujuk pada Mendeleev sebaga eka-sesium) pada tahun 1939.[129] Namun, plutonium, yang diproduksi secara sintetis pada 1940, teridentifikasi ada di alam dalam jumlah renik sebagai unsur primordial pada tahun 1971.[130][n 4] Tampilan tabel periodik yang populer,[131] juga dikenal sebagai bentuk umum atau bentuk standar (seperti ditunjukkan dalam artikel ini), merupakan hasil karya Horace Groves Deming. Pada tahun 1923, Deming, kimiawan Amerika, mempublikasikan tabel periodik bentuk pendek dan sedang.[132][n 5] Merck & Co. menyiapkan selebaran berisi tabel 18-kolom versi Deming pada tahun 1928, yang kemudian banyak beredar di sekolah-sekolah di Amerika. Pada tahun 1930-an, tabel Deming muncul di buku penuntun dan ensiklopedia kimia. Ini juga didistribusikan selama beberapa tahun oleh Sargent-Welch Scientific Company.[133][134][135] Seiring perkembangan teori mekanika kuantum modern tentang konfigurasi elektron dalam atom, semakin jelas bahwa masing-masing periode (baris) dalam tabel sesuai dengan pengisian elektron pada kulit kuantum. Semakin besar atom, semakin banyak sub kulit elektron yang dimiliki, akhirnya, semakin panjang periode yang harus dicantumkan pada tabel.[136]  Pada tahun 1945, Glenn Seaborg, ilmuwan Amerika, memberikan saran agar unsur-unsur aktinida, seperti halnya lantanida, mengisi sub-level f. Sebelumnya, aktinida dimasukkan ke dalam baris keempat blok-d. Kolega Seaborg menyarankan agar tidak mempublikasikan usulan radikal semacam ini karena dapat berdampak buruk pada kariernya. Setelah mempertimbangkan masak-masak hal tersebut tidak membawa dampak buruk pada reputasi maupun kariernya, akhirnya Seaborg mempublikasikan usulannya. Usulan Seaborg dinyatakan benar dan Seaborg memenangkan Hadiah Nobel bidang kimia pada tahun 1951 atas penelitiannya sintesis unsur-unsur aktinida.[137][138][n 6] Meskipun ada sejumlah kecil unsur-unsur transuranium terdapat secara alami,[139] tetapi kesemuanya pertama kali ditemukan di laboratorium. Produksinya telah memperluas tabel periodik secara signifikan. Transuranium pertama yang disintesis adalah neptunium (1939).[140] Oleh karena kebanyakan unsur-unsur transuranium sangat tidak stabil dan meluruh dengan cepat, tantangannya adalah mendeteksi dan melakukan karakterisasi segera setelah diproduksi. Ada kontroversi mengenai persaingan klaim penemuan untuk beberapa elemen. Hal ini membutuhkan tinjauan independen untuk menentukan pihak mana yang memiliki prioritas, dan berhak atas klaim tersebut. Unsur paling terkini yang diterima adalah flerovium (unsur 114) dan livermorium (unsur 116), keduanya diresmikan pada 31 Mei 2012.[141] Pada tahun 2010, kolaborasi Rusia–AS di Dubna, Oblast Moskwa, Rusia, mengaku telah mensintesis enam atom ununseptium (unsur 117), membuatnya sebagai pengakuan terkini.[142] Pada 30 Desember 2015, unsur nomor 113, 115, 117, dan 118 diakui secara resmi oleh IUPAC, sehingga melengkapi baris ke-7 tabel periodik.[143] Nama dan simbol resmi untuk masing-masing unsur ini, yang akan menggantikan nama dan simbol sementara seperti ununpentium (Uup) untuk unsur nomor 115, diperkirakan akan diumumkan kemudian tahun 2016. Tabel periodik yang berbedaVariasi bentuk umum
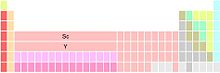
Ada tiga varian utama tabel periodik bentuk umum atau 18-kolom. Mereka berbeda dalam penggambarannya pada kolom golongan 3.[144] Untuk keperluan artikel ini tiga variasi dinyatakan sebagai tipe I, tipe II dan tipe III. Tipe I: Sc, Y, La dan Ac. Lantanum dan aktinium berada dalam tabel utama, pada golongan 3, di bawah skandium dan itrium. Empat belas unsur golongan lantanida dan aktinida yang mengikutinya ditulis sebagai catatan kaki, untuk menghemat tempat. Ada dua baris berisi empat belas unsur, baris pertama dimulai dengan Ce dan diakhiri dengan Lu, baris kedua dimulai dengan torium dan diakhiri dengan lawrensium. Ini adalah varian yang paling umum.[145][n 7] Ini menekankan kesamaan dalam tren periodik turun menurun pada golongan 1, 2 dan 3, dengan memecah lantanida dan aktinida.[n 8]
Tipe II: Sc, Y, Lu dan Lr. Lutesium dan lawrensium berada pada tabel utama, dalam golongan 3, di bawah skandium dan itrium. Catatan kaki adalah 14 unsur golongan lantanida dan aktinida berikutnya dimulai dengan lantanum dan aktinium serta diakhiri dengan iterbium dan nobelium. Varian ini didasarkan pada argumen alternatif dengan memperhatikan kecenderungan periodik sifat-sifat fisika dan kimia lantanum dan lutesium, serta mempertahankan lebar blok-f tetap 14 kolom, dengan tetap memecah lantanida dan aktinida. Ini menekankan kesamaan tren periodik antara golongan 3 dan golongan berikutnya dengan mengorbankan diskontinuitas dalam tren periodik antara golongan 2 dan 3.[n 9]
Tipe III: Sc, Y, dan penanda. Dua posisi di bawah skandium dikosongkan atau diberi tanda catatan kaki dalam beberapa cara. Catatan kaki lantanida dan aktinida dimulai dengan lantanum dan aktinium serta diakhiri dengan lutesium dan lawrensium, membentuk dua baris lima belas unsur. Varian ini menekankan kesamaan kimiawi 15 unsur lantanida (La–Lu), dengan mengorbankan ambiguitas untuk unsur yang menempati golongan 3 pada dua posisi di bawah skandium dan itrium, dan terlihat lebar blok f menjadi 15 kolom (kenyataannya hanya 14 unsur per baris yang dapat ditampung dalam blok-f).[n 10] Ketiga varian berasal dari kesulitan bersejarah dalam menempatkan lantanida dalam tabel periodik, dan argumen posisi awal dan akhir unsur blok-f.[146] Telah dinyatakan bahwa argumen semacam itu adalah bukti bahwa, "adalah suatu kesalahan memecah sistem [periodik] menjadi blok-blok dengan pembatasan yang tajam."[147] Sama halnya, beberapa versi tabel tipe III telah dikritik karena menyiratkan bahwa kesemua 15 lantanida menempati kotak tunggal atau menempatkannya di bawah itrium,[n 11] melanggar prinsip dasar satu tempat, satu unsur.[148][n 12] Kontroversi tentang unsur yang layak menempati posisi Golongan 3 di bawah skandium dan itrium dibahas lebih lanjut dalam seksi Pertanyaan terbuka dan kontroversi artikel ini. Tabel tipe II, sebagai varian umum, ditunjukkan bagian ikhtisar artikel ini. Jika dibandingkan dengan varian tipe I, "terdapat lebih sedikit pengecualian yang nyata pada pengisian seri orbital 4f reguler di antara anggota berikutnya."[149][n 13] Berbeda dengan varian tipe III, tidak ada ambiguitas pada komposisi golongan 3. Struktur alternatif Terdapat banyak tabel periodik dengan struktur yang lain daripada bentuk standarnya. Selama 100 tahun kehadiran tabel Mendeleev sejak 1869, ia telah memperkirakan bahwa sekitar 700 versi tabel periodik yang berbeda akan dipublikasikan.[150] Sama seperti variasi segi empatnya, format tabel periodik lainnya juga bermunculan, misalnya,[n 14] bentuk sirkuler, kubus, silinder, edifisial (seperti gedung), heliks, lemniscate, prisma oktagonal, piramida, terpisah, sferis, spiral, dan segitiga. Alternatif-alternatif semacam ini sering kali dikembangkan untuk menyoroti atau menekankan sifat-sifat fisika atau kimia unsur-unsur yang tidak dapat disajikan dalam tabel periodik tradisional.[150] Struktur alternatif yang populer[151] adalah versi Theodor Benfey (1960). Unsur-unsur disusun dalam spiral kontinu, dengan hidrogen berada di pusat spiral dan logam transisi, lantanida, serta aktinida berada pada semenanjungnya.[152]  Kebanyakan tabel periodik adalah dua dimensi;[139] namun, tabel tiga dimensi telah dikenal setidaknya sejak 1862 (sebelum tabel dua dimensi Mandeleev tahun 1869). Contoh terkini antara lain Klasifikasi Periodik versi Courtines (1925),[153] Sistem Lamina Wringley (1949),[154] Heliks Periodik Giguère (1965)[155][n 15] dan Pohon Periodik Dufour (1996).[156] Selangkah lebih maju, Tabel Periodik Fisikawan Stowe (1989)[157] telah dijelaskan sebagai tabel empat dimensi (mempunyai tiga dimensi spasial dan satu dimensi warna).[158] Beragam bentuk tabel periodik dapat dianggap sebagai peletakan dasar kontinum kimia-fisika.[159] Menjelang akhir kontinum kimia, dapat dijumpai, misalnya, Tabel Periodik versi kimiawan anorganik 'bandel'[160] Rayner-Canham (2002),[161] yang menekankan kecenderungan dan pola, serta sifat dan hubungan kimia yang tidak umum. Menjelang akhir kontinum fisika, muncul Tabel Periodik Kidal Janet (1928). Versi ini memiliki struktur yang menunjukkan hubungan erat dengan urutan pengisian kulit elektron dengan mekanika kuantum.[162] Di tengah-tengah kontinum adalah berbagai variasi bentuk umum atau standar tabel periodik. Hal ini dianggap sebagai ungkapan tren empiris yang lebih baik dalam hal keadaan fisik, konduktivitas listrik dan termal, serta bilangan oksidasi, dan sifat-sifat lainnya dengan mudah disimpulkan dari teknik tradisional laboratorium kimia.[163]
Pertanyaan terbuka dan kontroversiUnsur yang tidak diketahui sifat kimianyaMeskipun semua unsur hingga oganesson telah ditemukan, untuk unsur-unsur di atas hassium (unsur 108), hanya copernicium (unsur 112) dan flerovium (unsur 114) yang telah diketahui sifat kimianya. Unsur lainnya dapat berperilaku secara berbeda dari apa yang diprediksi secara ekstrapolasi, karena efek relativistik. Misalnya, flerovium diprediksi menunjukkan sifat-sifat seperti gas mulia, meskipun terletak dalam golongan karbon.[164] Percobaan terkini telah membuktikan bahwa, flerovium memiliki sifat kimia seperti timbal, sebagaimana diperkirakan dari posisinya dalam tabel periodik.[165] Pengembangan tabel periodik
Belum jelas apakah unsur-unsur baru akan mengikuti pola yang telah ada pada tabel periodik saat ini sebagai periode 8, atau memerlukan penyesuaian lebih lanjut. Seaborg memperkirakan periode kedelapan untuk mengikuti pola yang telah ada, sehingga: (1) akan memasukkan dua unsur blok-s untuk unsur 119 (Ununnonium/Uun) dan 120 (Ununbibium/Ubb), (2) ada blok baru yaitu blok-g untuk 18 unsur berikutnya, dan (3) 30 unsur tambahan melanjutkan blok-f, -d, dan -p saat ini.[167] Berita terkini, fisikawan seperti Pekka Pyykkö telah membuat teori bahwa unsur-unsur tambahan ini tidak mengikuti aturan atau kaidah Madelung, yang memprediksikan bagaimana kulit elektron diisi dan oleh sebab itu akan mempengaruhi tampilan tabel periodik saat ini.[168] Prediksi unsur dengan nomor atom terbesarJumlah unsur yang mungkin belum diketahui. Perkiraan awal yang dibuat oleh Elliot Adams pada tahun 1911, berdasarkan penyusunan unsur-unsur dalam masing-masing baris tabel periodik adalah: unsur dengan berat atom lebih besar daripada 256± (yang mungkin terletak di antara unsur 99 dan 100 untuk istilah saat ini) tidak mungkin ada.[169] Perkiraan teranyar adalah tabel periodik mungkin segera berakhir setelah pulau stabilitas,[170] yang diperkirakan berpusat di sekitar unsur 126, karena pengembangan tabel nuklida dan periodik dibatasi oleh garis tetes proton dan neutron.[171] Prediksi lain berakhirnya tabel periodik berkisar pada unsur 128 oleh John Emsley,[139] pada unsur 137 oleh Richard Feynman,[172] dan pada unsur 155 oleh Albert Khazan.[139][n 16] Model BohrModel Bohr menunjukkan kesulitan untuk atom-atom dengan nomor atom lebih besar daripada 137, karena unsur apapun dengan nomor atom lebih dari 137 akan membutuhkan elektron-elektron 1s nya untuk bergerak melebihi kecepatan cahaya, c.[173] Oleh karena itu, model non-relativistik Bohr tidak akurat jika diterapkan untuk unsur-unsur semacam ini. Persamaan relativistik DiracPersamaan relativistik Dirac menghadapi masalah untuk unsur-unsur lebih dari 137 proton. Untuk unsur semacam ini, fungsi gelombang kondisi dasar Dirac adalah berosilasi, dan tidak ada celah antara spektra energi positif dan negatif, seperti dalam paradoks Klein.[174] Kalkulasi yang lebih akurat memperhitungkan pengaruh ukuran terbatas pada inti atom yang menandakan bahwa ikatan energi pertama melebihi batasan yang dimungkinkan untuk unsur-unsur lebih dari 173 proton. Untuk unsur-unsur yang lebih berat, jika orbital terdalam (1s) tidak terisi, medan listrik inti akan menarik elektron keluar ruang hampa, yang menghasilkan emisi positron spontan.[175] Meski demikian, hal ini tidak terjadi jika orbital terdalam terisi, sehingga unsur 173 bukanlah akhir dari tabel periodik.[176] Penempatan hidrogen dan heliumJika mengikuti konfigurasi elektron, hidrogen (konfigurasi elektron 1s1) dan helium (1s2) seharusnya terletak di golongan 1 dan 2, di atas litium ([He]2s1) dan berilium ([He]2s2).[52] Namun, penempatan tersebut jarang digunakan di luar konteks konfigurasi elektron: Ketika gas mulia (yang kemudian disebut "gas inert") pertama kali diketemukan sekitar tahun 1900, mereka dikenal sebagai "golongan 0", merefleksikan tidak adanya reaktivitas kimia unsur-unsur ini yang diketahui pada saat itu, dan helium diletakkan di puncak golongan, karena memiliki ke-inert-an yang sama dengan seluruh golongan tersebut. Oleh karena golongan berubah penomoran formalnya, kebanyakan penulis tetap meletakkan helium tepat di atas neon, dalam golongan 18; salah satunya adalah tabel IUPAC yang berlaku saat ini.[177] Sifat-sifat kimia hidrogen tidak terlalu dekat dengan logam-logam alkali, yang menempati golongan 1, dan berdasarkan hal tersebut, terkadang hidrogen diletakkan di tempat lain: alternatif yang paling umum adalah di golongan 17; salah satu faktor pertimbangannya adalah sifat hidrogen yang nonlogam monovalen, dan bahwa fluorin (unsur yang terletak di puncak golongan 17) juga nonlogam monovalen. Terkadang, untuk menunjukkan bahwa hidrogen memiliki sifat-sifat baik seperti logam alkali maupun halogen, hidrogen ditampilkan dalam dua kolom sekaligus.[178] Cara penyajian lain adalah meletakkan hidrogen di atsa karbon dalam golongan 14: dengan meletakkannya sedemikian, sangat cocok dengan kecenderungan kenaikan nilai potensial ionisasi dan afinitas elektron, dan tidak terlalu menyimpang dari tren elektronegativitas.[179] Terakhir, hidrogen kadang diletakkan terpisah dari golongan manapun; hal ini berdasarkan sifat-sifat hidrogen yang sangat berbeda dari golongan manapun: tidak seperti hidrogen, unsur golongan 1 lainnya menunjukkan sifat yang sangat logam; unsur-unsur golongan 17 umumnya membentuk garam (oleh sebab itu ada istilah "halogen"); unsur-unsur golongan lainnya menunjukkan sifat kimia multivalen. Unsur periode 1 lainnya, helium, terkadang juga diletakkan terpisah dari golongan manapun.[180] Sifat-sifat yang membedakan helium dengan gas mulia lainnya (meskipun sifat inert helium sangat dekat dengan neon dan argon[181]) adalah bahwa dalam kulit elektron tertutupnya, helium hanya memiliki dua elektron pada orbital terluarnya, sementara gas mulia lainnya memiliki delapan elektron. Golongan yang termasuk dalam logam transisiDefinisi logam transisi, seperti diberikan oleh IUPAC, adalah unsur yang atomnya mempunyai sub-kulit d tak lengkap, atau yang dapat mengalami kenaikan tingkat oksidasi menjadi kation sehingga sub-kulit d menjadi tak lengkap.[182] Berdasarkan definisi ini, seluruh unsur dalam golongan 3–11 adalah logam transisi. Definisi IUPAC menyebabkan golongan 12, antara lain seng, kadmium dan raksa, harus keluar dari kategori logam transisi. Beberapa kimiawan memperlakukan kategori "unsur blok-d" dan "logam transisi" secara bergantian, sehingga golongan 3–12 termasuk dalam logam transisi. Dalam hal ini, unsur-unsur golongan 12 diperlakukan sebagai kasus khusus dari logam transisi yang mana elektron-elektron d nya tidak biasa terlibat dalam ikatan kimia. Penemuan baru-baru ini yang mengungkapkan raksa dapat menggunakan elektron d nya dalam pembentukan raksa(IV) fluorida (HgF4) telah mendorong beberapa komentator untuk menyarankan agar raksa dapat diterima sebagai logam transisi.[183] Komentator lain, seperti Jensen,[184] telah berargumentasi bahwa pembentukan senyawa seperti HgF4 hanya dapat terjadi di bawah kondisi abnormal. Oleh karenanya, raksa tidak dapat diterima sebagai logam transisi berdasarkan interpretasi apapun dalam istilah makna ilmiah umum.[184] Kimiawan lainnya lebih jauh mengeluarkan unsur-unsur golongan 3 dari definisi logam transisi. Mereka melakukannya berdasarkan bahwa unsur-unsur golongan 3 tidak membentuk ion apapun dengan kulit d sebagian terisi, dan oleh karenanya tidak menunjukkan karakteristik kimia logam transisi.[185] Dalam kasus ini, hanya golongan 4–11 yang diterima sebagai logam transisi. Unsur-unsur periode 6 dan 7 pada golongan 3Meskipun skandium dan itrium adalah dua unsur pertama pada golongan 3 identitas dua unsur berikutnya belum dituntaskan. Mereka adalah lantanum dan aktinium; atau lutetium dan lawrencium. Ada argumen kimia dan fisika yang kuat yang mendukung penyusunan terakhir[186][187] tetapi tidak semua penulis telah diyakinkan.[148] Kebanyakan kimiawan tidak menyadari bahwa ada kontroversi.[188] Lantanum dan aktinium secara tradisional digambarkan sebagai anggota golongan 3.[189][190] Telah dikemukakan bahwa tata letak ini berasal dari tahun 1940-an, dengan munculnya tabel periodik berdasarkan konfigurasi elektron unsur-unsurnya dan gagasan elektron pembeda. Konfigurasi sesium, barium dan lantanum adalah [Xe]6s1, [Xe]6s2 dan [Xe]5d16s2. Lantanum memiliki elektron pembeda 5d dan ini memapankannya "pantas berada dalam golongan 3 sebagai anggota pertama blok-d untuk periode 6."[191] Satu set konfigurasi elektron yang konsisten selanjutnya terlihat dalam golongan 3: skandium [Ar] 3d14s2, itrium [Kr] 4d15s2 dan lantanum [Xe] 5d16s2. Masih dalam periode 6, iterbium memiliki konfigurasi elektron [Xe]4f135d16s2 dan lutetium [Xe]4f145d16s2, "menghasilkan elektron pembeda 4f untuk lutetium dan menegaskan ia sebagai anggota terakhir blok-f untuk periode 6."[191] Pada tabel lain, lutetium dan lawrencium adalah anggota terakhir dari golongan 3.[192] Telah diketahui sejak awal abad ke-20 bahwa, "itrium dan (untuk tingkat yang lebih rendah) skandium memiliki sifat kimia yang lebih mendekati lutetium dan unsur tanah jarang lainnya [yaitu lantanida] daripada ke lantanum."[191] Dengan alasan itu, beberapa ahli kimia pada tahun 1920 dan 1930-an lebih meimilih lutetium untuk dimasukkan ke dalam golongan 3 daripada lantanum. Penelitian spektroskopik terkini menemukan bahwa konfigurasi elektron iterbium ternyata [Xe]4f146s2. Ini berarti bahwa iterbium dan lutetium—dengan konfigurasi [Xe]4f145d16s2—keduanya memiliki 14 elektron f, "memiliki elektron pembeda d dan bukan f" untuk lutetium dan membuatnya "kandidat yang setara" dengan [Xe]5d16s2 lantanum, untuk golongan 3 tabel periodik pada posisi di bawah itrium.[191] Beberapa fisikawan pada tahun 1950-an dan 60-an lebih memilih lutetium, dalam hal perbandingan beberapa sifat fisika dengan yang dimiliki oleh lantanum.[191] Pengaturan ini, di mana lantanum adalah anggota pertama dari blok-f, dibantah oleh beberapa penulis karena lantanum tidak memiliki satupun elektron f. Namun, telah ada bantahan bahwa ini tidak perlu dikhawatirkan mengingat adanya anomali lain dalam tabel periodik—torium, misalnya, tidak memiliki elektron f tetapi merupakan bagian dari blok-f.[193] Adapun lawrencium, konfigurasi elektron yang dikonfirmasi pada tahun 2015 adalah [Rn]5f147s27p1. Konfigurasi yang mewakili anomali lain tabel periodik, terlepas dari apakah lawrensium terletak blok-f atau blok-d, karena posisi posisi blok-p yang paling memungkinkan telah "dipesan" untuk ununtrium dengan perkiraan konfigurasi elektron [Rn]5f146d107s27p1.[194] Beberapa tabel, termasuk tabel pada web IUPAC,[195][n 17] menambahkan catatan kaki untuk dua posisi di bawah skandium dan itrium, dan menampilkan keduanya, lantanum dan lutetium, serta aktinium dan lawrencium sebagai bagian dari unsur deret lantanida dan aktinida. Pengaturan ini menekankan kesamaan sifat-sifat kimia 15 unsur lantanida (La-Lu) lebih penting daripada argumentasi konfigurasi elektron. Unsur-unsur dalam deret aktinida memiliki perilaku yang lebih beragam. Unsur-unsur di awal deret menunjukkan beberapa kesamaan dengan logam transisi; aktinium dan selanjutnya lebih mirip lantanida.[196] Bentuk optimalBanyaknya bentuk tabel periodik yang berbeda memicu pertanyaan: adakah bentuk tabel periodik yang optimal atau definitif (pasti)? Jawaban atas pertanyaan ini adalah bergantung pada bagaimana melihat kebenaran periodisitas kimia yang muncul pada unsur-unsur tersebut, apakah kebenaran mutlak, atau hanya interpretasi manusia yang disesuaikan dengan kebutuhan, keyakinan dan selera pengamat. Dasar obyektif periodisitas kimia akan menjawab pertanyaan tentang lokasi hidrogen dan helium, serta komposisi golongan 3. Kebenaran mendasar semacam ini, jika ada, kemungkinan belum ditemukan. Tanpa kebenaran mendasar tersebut, banyaknya perbedaan bentuk tabel periodik dapat dianggap sebagai variasi tema periodisitas kimia, yang masing-masing mengeksplorasi dan memberikan penekanan pada aspek, sifat, perspektif dan hubungan antar unsur yang berbeda.[n 18] Adanya tabel periodik resmi versi standard atau menengah dan panjang diperkirakan adalah hasil dari pengaturan tata letak dengan keseimbangan fitur yang baik dalam arti mudah dibuat dan berukuran layak, serta dapat menggambarkan urutan atom dan tren periodik.[111][197] Perluasan setelah periode ketujuh Unsur yang paling baru dinamai–nihonium (113), moskovium (115), tenesin (117), dan oganeson (118)–menyelesaikan baris ketujuh tabel periodik.[6] Unsur berikutnya harus memulai periode kedelapan. Unsur-unsur ini dapat disebut baik dengan nomor atomnya (misalnya "unsur 119"), atau dengan nama unsur sistematik IUPAC yang secara langsung berhubungan dengan nomor atom (misalnya "ununennium" untuk unsur 119, berasal dari bahasa Latin unus "satu", Yunani ennea "sembilan", dan akhiran -ium untuk elemen logam).[6] Semua upaya untuk mensintesis unsur-unsur tersebut sejauh ini telah gagal. Upaya untuk membuat unsur 119 telah berlangsung sejak 2018 di lembaga penelitian Riken di Jepang. Joint Institute for Nuclear Research di Rusia juga berencana untuk melakukan upayanya sendiri dalam menyintesis beberapa unsur periode 8 pertama.[200][201][202] Saat ini, diskusi terus berlanjut apakah periode kedelapan yang akan datang ini harus mengikuti pola yang ditetapkan oleh periode sebelumnya atau tidak, karena perhitungan memperkirakan bahwa pada titik ini efek relativistik akan menghasilkan penyimpangan yang signifikan dari aturan Madelung. Berbagai model yang berbeda telah diusulkan. Semua setuju bahwa periode kedelapan harus dimulai seperti periode sebelumnya dengan dua elemen 8s, dan kemudian harus ada seri baru elemen blok-g yang mengisi orbital 5g, tetapi konfigurasi tepat yang dihitung untuk elemen 5g ini sangat bervariasi antar sumber. Di luar seri 5g ini, perhitungan tidak menyetujui apa yang sebenarnya harus diikuti. Pengisian kulit 5g, 6f, 7d, dan 8p diperkirakan terjadi dalam urutan yang kira-kira seperti itu, tetapi mereka cenderung bercampur satu sama lain dan dengan subkulit 9s dan 9p, sehingga tidak jelas elemen mana yang harus masuk kelompok mana lagi.[198][199][203][204][205] Scerri telah mengajukan pertanyaan apakah tabel periodik yang diperpanjang harus memperhitungkan kegagalan aturan Madelung di wilayah ini, atau jika pengecualian tersebut harus diabaikan.[199] Struktur kulit mungkin juga cukup formal pada titik ini: distribusi elektron dalam atom oganeson diharapkan agak seragam, tanpa struktur kulit yang terlihat.[206] Stabilitas nuklir kemungkinan akan membuktikan faktor penentu yang membatasi jumlah unsur yang mungkin. Namun, argumen ini menganggap bahwa inti atom berbentuk seperti titik. Perhitungan yang lebih akurat harus memperhitungkan ukuran nukleus yang kecil, tetapi bukan nol, yang mendorong batas ke Z = 173. Selain itu, ternyata larangan itu bukan terhadap atom netral, tetapi terhadap inti telanjang: unsur-unsur dengan atom bilangan di luar 173 tidak dapat terionisasi seluruhnya karena kulit 1snya akan terisi oleh produksi pasangan elektron-positron spontan, tetapi tidak menemui kesulitan jika kulit 1snya sudah terisi.[207] Ini tergantung pada keseimbangan antara tolakan listrik antara proton dan gaya kuat yang mengikat proton dan neutron bersama-sama.[208] Proton dan neutron tersusun dalam kulit, sama seperti elektron, sehingga kulit tertutup dapat secara signifikan meningkatkan stabilitas: inti superberat yang diketahui ada karena penutupan kulit seperti itu. Mereka mungkin dekat dengan pulau stabilitas yang diprediksi, di mana nuklida superberat seharusnya memiliki waktu paruh yang jauh lebih lama: prediksi berkisar dari menit atau hari, hingga jutaan atau miliaran tahun.[209][210] Namun, karena jumlah proton meningkat melebihi sekitar 126, efek stabilisasi ini akan hilang saat kulit tertutup dilewatkan. Tidak jelas apakah ada penutupan kulit yang lebih jauh, karena diharapkan adanya noda dari kulit nuklir yang berbeda (seperti yang sudah diperkirakan untuk kulit elektron di oganeson).[211] Lebih jauh lagi, bahkan jika penutupan kulit kemudian ada, tidak jelas apakah mereka akan memungkinkan unsur berat seperti itu ada.[92][212][213][214] Dengan demikian, mungkin tabel periodik secara praktis berakhir di sekitar unsur 120, karena elemen menjadi terlalu pendek untuk diamati; era penemuan unsur baru akan segera berakhir.[92][215] Sebagai alternatif, zat kuark dapat menjadi stabil pada jumlah massa yang tinggi, di mana nukleus terdiri dari kuark yang mengalir bebas ke atas dan ke bawah alih-alih mengikatnya menjadi proton dan neutron; ini akan menciptakan benua stabilitas dan bukannya sebuah pulau.[216][217] Efek lain mungkin ikut bermain: misalnya, dalam unsur yang sangat berat, elektron 1s cenderung menghabiskan banyak waktu begitu dekat dengan nukleus sehingga mereka benar-benar berada di dalamnya, yang akan membuat mereka rentan terhadap penangkapan elektron.[218] Bahkan jika unsur periode kedelapan dapat eksis, kemungkinan memproduksinya akan sulit, dan itu akan menjadi lebih sulit saat nomor atom naik.[219] Meskipun unsur 8s diperkirakan dapat dicapai dengan cara sekarang, beberapa elemen 5g pertama diperkirakan membutuhkan teknologi baru,[220] jika mereka dapat diproduksi sama sekali.[221] Eksperimen mengkarakterisasi unsur-unsur ini secara kimia juga akan menimbulkan tantangan besar.[200] Lihat pula
Catatan kaki
Referensi
Daftar pustaka
Pranala luar
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||