|
Kadmium
Kadmium adalah unsur kimia dengan lambang Cd dan nomor atom 48. Logam lunak dan putih kebiruan ini secara kimiawi serupa dengan dua logam stabil lainnya pada golongan 12, seng dan raksa. Seperti halnya seng, Cd lebih menyukai tingkat oksidasi +2 dalam sebagian besar senyawa dan, seperti raksa, ia menunjukkan titik lebur yang rendah dibandingkan dengan logam transisi pada umumnya. Kadmium dan kongenernya tidak selalu dianggap sebagai logam transisi, karena logam tersebut tidak memiliki kulit elektron d atau f yang terisi sebagian atau seluruhnya, baik dalam bentuk unsur maupun dalam tingkat oksidasi umumnya. Konsentrasi kadmium rata-rata dalam kerak bumi adalah antara 0,1 dan 0,5 bagian per juta (ppm). Cd ditemukan pada tahun 1817 secara simultan oleh Stromeyer dan Karl Samuel Leberecht Hermann, keduanya di Jerman, sebagai ketakmurnian dalam seng karbonat. Kadmium terdapat sebagai komponen minor di sebagian besar bijih seng dan oleh karena itu merupakan hasil sampingan dari produksi seng. Kadmium telah digunakan sejak lama sebagai lapisan tahan korosi pada baja, sementara senyawa kadmium digunakan sebagai pigmen merah, oranye dan kuning, untuk mewarnai kaca dan untuk menstabilkan plastik. Penggunaan kadmium umumnya menurun karena toksisitasnya. (Hal ini secara khusus tercantum dalam Pembatasan Bahan Berbahaya Eropa[4]) dan penggantian baterai nikel-kadmium dengan baterai nikel-metal hidrida dan ion lithium. Salah satu dari sedikit manfaat barunya adalah panel surya kadmium telurida. Meskipun kadmium tidak diketahui memiliki fungsi biologis pada organisme yang lebih tinggi, karbonat anhidrase yang tergantung pada kadmium telah ditemukan di diatom laut. KarakteristikSifat fisikaKadmium adalah sebuah logam bivalen yang lunak, dapat ditempa, elastis, dan berwarna putih kebiruan. Ia serupa dalam banyak hal seperti seng kecuali dalam hal pembentukan senyawa kompleks.[5] Tidak seperti kebanyakan logam lainnya, kadmium tahan terhadap korosi, oleh karena itu digunakan sebagai lapisan pelindung ketik diendapkan pada logam lain. Dalam bentuk logam curah, kadmium bersifat tak larut dalam air dan tidak mudah terbakar; namun, dalam bentuk serbuknya, ia dapat terbakar dan melepaskan asap beracun.[6] Sifat kimiaLihat juga: Kategori:Senyawa kadmium.
Meskipun kadmium biasanya memiliki tingkat oksidasi +2, ia juga hadir dengan tingkat oksidasi +1. Kadmium dan kongenernya tidak selalu dianggap logam transisi, karena ia tidak memiliki kulit elektron d atau f yang terisi sebagian atau seluruhnya, baik dalam bentuk unsur maupun dalam tingkat oksidasi umumnya.[7] Kadmium terbakar di udara membentuk kadmium oksida (CdO) yang amorf dan berwarna coklat; kristal yang terbentuk dari senyawa ini berwarna merah tua yang berubah warna saat dipanaskan, sama seperti seng oksida. Asam klorida, asam sulfat dan asam nitrat melarutkan kadmium dengan membentuk kadmium klorida (CdCl2), kadmium sulfat (CdSO4), atau kadmium nitrat (Cd(NO3)2). Tingkat oksidasi +1 dapat diperoleh dengan melarutkan kadmium dalam campuran kadmium klorida dan aluminium klorida, membentuk kation Cd2+2, mirip seperti kation Hg2+2 dalam raksa(I) klorida.[5]
Kebanyakan Struktur kompleks kadmium dengan nukleobase, asam amino dan vitamin telah ditentukan.[8] Isotop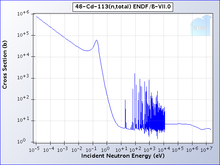 Kadmium yang terjadi secara alami terdiri dari 8 isotop. Dua di antaranya bersifat radioaktif, dan tiga di antaranya diperkirakan mengalami peluruhan namun kebenarannya belum dikonfirmasi secara eksperimental. Dua isotop radioaktif alami adalah 113Cd (peluruhan beta, dengan waktu paruh 7,7 × 1015 tahun) dan 116Cd (dua neutrino peluruhan beta ganda, dengan waktu paruh 2,9 × 1019 tahun). Tiga lainnya adalah 106Cd, 108Cd (keduanya penangkapan elektron ganda), dan 114Cd (peluruhan beta ganda); hanya batas bawah waktu paruh mereka telah ditetapkan. Setidaknya ada tiga isotop stabil – 110Cd, 111Cd, dan 112Cd . Di antara isotop yang tidak terjadi secara alami, yang paling berumur panjang adalah 109Cd dengan waktu paruh 462,6 hari, dan 115Cd dengan waktu paruh 53,46 jam. Semua isotop radioaktif yang tersisa memiliki waktu paruh kurang dari 2,5 jam, dan sebagian besar memiliki waktu paruh kurang dari 5 menit. Kadmium memiliki 8 isomer nuklir yang diketahui, yang paling stabil adalah 113mCd (t1/2 = 14,1 tahun), 115mCd (t1/2 = 44,6 hari), dan 117mCd (t1/2 = 3,36 jam).[9] Isotop kadmium yang dikenal berada dalam rentang massa atom antara 94,950 u (95Cd) dan 131,946 u (132Cd). Untuk isotop yang lebih ringan dari 112 u, mode peluruhan utama adalah tangkapan elektron dan produk peluruhan dominan adalah unsur 47 (perak). Isotop yang lebih berat sebagian besar meluruh melalui emisi beta yang menghasilkan unsur 49 (indium).[9] Satu isotop kadmium, 113Cd, Menyerap neutron dengan probabilitas sangat tinggi jika mereka memiliki energi di bawah kadmium cut-off dan mentransmisikannya sebaliknya. Kadmium cut-off sekitar 0,5 eV. Neutron dengan energi di bawah cut-off dianggap neutron lambat, membedakannya dari neutron menengah dan cepat.[10] Kadmium dibuat melalui proses s yang panjang di bintang bermassa rendah-sedang dengan massa 0,6 sampai 10 kali massa matahari, yang berlangsung selama ribuan tahun. Ini membutuhkan atom perak untuk menangkap neutron dan kemudian mengalami peluruhan beta.[11] Sejarah Kadmium (Latin cadmia, Yunani καδμεία berarti "kalamin", suatu mineral yang mengandung kadmium, yang dinamai menurut karakter mitologi Yunani Κάδμος, Cadmus, pendiri Thebes), ditemukan secara simultan pada tahun 1817 oleh Friedrich Stromeyer[12] dan Karl Samuel Leberecht Hermann, keduanya di Jerman, sebagai ketakmurnian dalam seng karbonat.[4] Stromeyer menemukan unsur baru sebagai pengotor pada seng karbonat (kalamin), dan, selama 100 tahun, Jerman menjadi satu-satunya produsen logam penting ini. Logam itu dinamai menurut kata Latin untuk kalamin, karena ditemukan di senyawa seng ini. Stromeyer mencatat bahwa beberapa sampel kalamin yang tidak murni berubah warna saat dipanaskan, tetapi tidak untuk kalamin murni. Dia gigih dalam mempelajari hasil ini dan akhirnya mengisolasi logam kadmium dengan cara pembakaran dan reduksi sulfidanya. Kemungkinan untuk menggunakan kadmium kuning seperti pigmen mulai dikenali pada tahun 1840-an namun kekurangan kadmium membatasi aplikasi ini.[13][14][15] Meskipun kadmium dan senyawanya mungkin beracun dalam bentuk dan konsentrasi tertentu, British Pharmaceutical Codex, sejak tahun 1907, menyatakan bahwa kadmium iodida digunakan sebagai suatu pengobatan untuk mengobati "pembesaran sendi, kelainan kelenjar, dan jari dingin".[16] Pada tahun 1907, International Astronomical Union mendefinisikan satuan internasional ångström sebagai garis spektra kadmium merah (1 panjang gelombang = 6438,46963 Å).[17][18] Ini diadopsi oleh General Conference on Weights and Measures ke-7 pada tahun 1927. Pada tahun 1960, definisi dari meter dan ångström diubah menggunakan krypton.[19] Setelah produksi skala industri kadmium dimulai pada tahun 1930-an dan 1940-an, aplikasi utama kadmium adalah sebagai pelapis besi dan baja untuk mencegah korosi. Di Amerika Serikat, penggunaan kadmium untuk pelapisan mencapai 62% pada tahun 1944, dan 59% pada tahun 1956.[4][20] Pada tahun 1956, 24% kadmium yang digunakan di Amerika Serikat digunakan untuk aplikasi kedua, yaitu untuk pigmen merah, jingga dan kuning berdasarkan sulfida dan selenida kadmium.[20] Efek menstabilkan zat kimia yang mengandung kadmium seperti kadmium karboksilat dan kadmium stearat pada PVC menyebabkan peningkatan penggunaan senyawa tersebut pada tahun 1970-an dan 1980-an. Penggunaan kadmium dalam aplikasi seperti pigmen, pelapis, stabilisator dan paduan menurun karena peraturan lingkungan dan kesehatan pada tahun 1980-an dan 1990-an. Pada tahun 2006, hanya 7% dari total konsumsi kadmium yang digunakan untuk pelapisan dan hanya 10% yang digunakan untuk pigmen.[4] Penurunan konsumsi pada aplikasi lain disebabkan oleh meningkatnya permintaan kadmium pada baterai nikel-kadmium, yang menyumbang 81% konsumsi kadmium di Amerika Serikat pada tahun 2006.[21] Keberadaan Kadmium menyusun sekitar 0,1 ppm kerak bumi. Dibandingkan dengan seng yang melimpah (65 ppm), kadmium termasuk jarang.[22] Tidak ada deposit bijih kadmium penting yang diketahui. Greenockite (CdS), satu-satunya mineral kadmium yang penting, hampir selalu dikaitkan dengan sphalerite (ZnS). Hubungan ini disebabkan oleh kesamaan geokimia antara seng dan kadmium yang membuat pemisahan geologi tidak mungkin terjadi. Sebagai konsekuensinya, kadmium diproduksi terutama sebagai produk sampingan dari proses pertambangan, peleburan, dan pemurnian bijih sulfida seng, dan pada tingkat yang lebih rendah, timbal dan tembaga. Sejumlah kecil kadmium, sekitar 10% konsumsi, dihasilkan dari sumber sekunder, terutama dari debu yang dihasilkan dari daur ulang besi dan skrap baja. Produksi di Amerika Serikat dimulai pada tahun 1907,[15] tetapi kadmium baru digunakan secara luas pasca Perang Dunia I.[23][24] Satu tempat di mana kadmium logam dapat ditemukan adalah sungai Vilyuy di Siberia.[25] Batu yang ditambang untuk menghasilkan pupuk fosfat mengandung jumlah kadmium yang bervariasi, dengan konsentrasi kadmium hingga 300 mg/kg dalam pupuk fosfat yang diproduksi, kandungan kadmium dalam tanah pertanian juga tinggi.[26][27] Batubara dapat mengandung kadmium dalam jumlah besar, yang sebagian besar berakhir pada debu buangan.[28] ProduksiBritish Geological Survey melaporkan bahwa pada tahun 2001, China adalah produsen kadmium papan atas, memproduksi hampir seperenam dari pangsa dunia, diikuti oleh Korea Selatan dan Jepang.[29] Kadmium adalah ketakmurnian umum dalam bijih seng, dan merupakan yang paling sering diisolasi selama produksi seng. Beberapa bijih seng yang dipekatkan dari bijih seng sulfida mengandung 1,4% kadmium.[30] Pada 1970-an, produksi kadmium adalah 65 pon (29 kg) per ton seng.[30] Bijih seng sulfida dipanggang dengan adanya oksigen, mengubah seng sulfida menjadi oksida. Logam seng diproduksi dengan cara melebur oksidanya dengan karbon atau dengan cara elektrolisis dalam asam sulfat. Kadmium diisolasi dari logam seng dengan distilasi vakum jika seng dilelehkan, atau kadmium sulfat diendapkan dari larutan elektrolisis.[24][31]
AplikasiKadmium memiliki banyak kegunaan di bidang industri seperti, komponen kunci dalam produksi baterai, sebagai pigmen kadmium,[32] proses pelapisan,[33] dan biasa digunakan pada penyepuhan elektrik.[34] Baterai Pada tahun 2009, 86% kadmium digunakan di baterai, terutama dalam baterai isi ulang nikel-kadmium. Sel nikel-kadmium memiliki potensi sel 1,2 V. Sel terdiri dari elektrode positif nikel hidroksida dan sebuah pelat kadmium sebagai elektrode negatif yang dipisahkan oleh elektrolit alkali (kalium hidroksida).[35] Uni Eropa menetapkan batas penggunaan kadmium yang diizinkan dalam elektronika pada tahun 2004 maksimal 0,01%,[36] dengan beberapa pengecualian, namun mengurangi kandungan kadmium yang diizinkan dalam baterai menjadi 0,002%.[37] Penyepuhan elektrik (electroplating) Penyepuhan elektrik kadmium, yang menghabiskan 6% dari produksi global, dapat ditemukan di industri pesawat terbang karena kemampuannya untuk menahan korosi ketika diterapkan pada komponen baja.[34] Lapisan ini dipasifkan menggunakan garam kromat.[33] Keterbatasan pelapisan kadmium adalah perapuhan hidrogen pada baja berregangan tinggi yang disebabkan oleh proses penyepuhan elektrik. Oleh karena itu, bagian baja yang diolah-panas dengan kekuatan tarik di atas 1300 MPa (200 ksi) harus dilapisi dengan metode alternatif (seperti proses penyepuhan elektrik khusus dengan kadmium perapuhan rendah, atau deposisi uap fisika). Selain itu, perapuhan titanium yang disebabkan oleh residu alat berlapis cadmium mengakibatkan alat ini disingkirkan dari program A-12 / SR-71 dan U-2, (bersamaan dengan program pengujian alat secara rutin untuk mendeteksi kontaminasi cadmium), dan program pesawat terbang berikutnya yang menggunakan titanium.[38] Fisi nuklirKadmium digunakan sebagai penghalang untuk mengendalikan neutron pada fisi nuklir.[34] Reaktor air bertekanan yang dirancang oleh Westinghouse Electric Company menggunakan paduan yang terdiri dari perak 80%, indium 15%, dan kadmium 5%.[34] Senyawa Kadmium oksida digunakan dalam fosfor televisi hitam-putih, dan dalam fosfor biru dan hijau untuk tabung televisi berwarna.[39] Cadmium sulfida (CdS) digunakan sebagai lapisan permukaan fotokonduktif untuk tabung fotokopi.[40]  Dalam pigmen cat, kadmium membentuk beragam garam, dengan CdS adalah yang paling umum. Sulfida ini digunakan sebagai pigmen kuning. Kadmium selenida dapat digunakan sebagai pigmen merah, biasa disebut kadmium merah. Bagi pelukis yang bekerja dengan pigmen, kadmium kuning, jingga, dan merah adalah warna yang paling cemerlang dan tahan lama. Sebenarnya, selama proses produksi, warna-warna ini dilunakkan secara signifikan sebelum dicampur dengan minyak dan pengikat, atau dicampur ke dalam cat air, gouache, cat akrilik, dan formulasi cat dan pigmen lainnya. Karena pigmen ini berpotensi racun, maka dianjurkan untuk menggunakan krim penghalang di tangan untuk mencegah penyerapan melalui kulit saat bekerja menggunakannya[32] meski jumlah kadmium yang diserap tubuh melalui kulit biasanya kurang dari 1%.[6] Dalam PVC, Kadmium digunakan sebagai penstabil panas, cahaya, dan pelapukan.[34][41] Saat ini, stabilisator kadmium telah sepenuhnya diganti dengan stabilisator barium-seng, kalsium-seng dan organo-timah. Kadmium digunakan dalam berbagai jenis solder dan paduan bantalan, karena koefisien gesek yang rendah dan ketahanannya terhadap kelelahan.[34] Ini juga ditemukan pada beberapa alloy bertitik lebur rendah, seperti logam Wood.[42] Aplikasi laboratorium Laser helium-kadmium adalah sumber umum sinar laser ultraviolet biru. Mereka beroperasi pada panjang gelombang 325 atau 422 nm dan digunakan dalam mikroskop fluoresensi serta berbagai percobaan laboratorium.[43][44] Quantum dot kadmium selenida memancarkan luminesensi terang di bawah eksitasi UV (laser He-Cd, misalnya). Warna luminesensi ini bisa berwarna hijau, kuning atau merah tergantung ukuran partikelnya. Larutan koloid dari partikel tersebut digunakan untuk pencitraan jaringan biologis dan larutan dengan menggunakan mikroskop fluoresensi.[45] Kadmium adalah komponen dari beberapa senyawa semikonduktor, seperti kadmium sulfida, kadmium selenida, dan kadmium telurida, yang dapat digunakan sebagai detektor cahaya atau sel surya. HgCdTe sensitif terhadap sinar inframerah, dan oleh karena itu dapat digunakan sebagai detektor inframerah atau saklar misalnya pada perangkat pengendali jarak jauh. Dalam biologi molekular, kadmium digunakan untuk memblokir saluran kalsium yang bergantung pada tegangan ion kalsium yang berfluktuasi, seperti pada penelitian hipoksia untuk merangsang degradasi Hif-1α yang bergantung pada proteasom.[46] Sensor selektif kadmiumSensor selektif kadmium berdasarkan fluorofora BODIPY telah dikembangkan untuk pencitraan dan penginderaan kadmium dalam sel.[47] Peran biologisKadmium tidak diketahui memiliki peran berguna pada organisme yang lebih tinggi,[48] namun karbonat anhidrase yang tergantung pada kadmium telah ditemukan pada beberapa diatom laut.[49] Diatom yang hidup dalam lingkungan dengan konsentrasi seng dan kadmium yang sangat rendah, melakukan fungsi yang biasanya dilakukan oleh seng dalam anhidrase lainnya. Penemuan ini dilakukan dengan menggunakan spektroskopi fluoresensi sinar-X (XAFS).[49][50] Konsentrasi tertinggi kadmium telah ditemukan diserap dalam ginjal manusia, dan sampai sekitar 30 mg kadmium umumnya dihirup oleh seluruh anak dan remaja.[51] Kadmium dapat digunakan untuk memblokir saluran kalsium dalam neuron ayam.[52] Telah ditinjau metode analisis untuk penentuan kadmium dalam sampel biologis.[53] LingkunganBiogeokimia kadmium dan pelepasannya ke lingkungan telah menjadi bahan kajian, seperti spesiasi kadmium di lingkungan.[54][55] KeselamatanTelah ditinjau aspek toksisitas bioanorganik kadmium.[56] Bentuk paparan kerja paling berbahaya terhadap kadmium adalah menghirup debu halus dan asap, atau menelan senyawa kadmium yang sangat mudah larut.[4] Menghirup asap yang mengandung kadmium dapat mengakibatkan demam asam logam pada awalnya, namun mungkin berlanjut ke penyakit pneumonitis kimia, edema paru-paru, dan kematian.[57] Kadmium juga menyebabkan bahaya lingkungan. Eksposur manusia terhadap kadmium lingkungan terutama disebabkan oleh pembakaran bahan bakar fosil, pupuk fosfat, sumber daya alam, produksi besi dan baja, produksi semen dan kegiatan terkait, produksi logam non besi, dan insinerasi limbah padat kota.[4] Roti, tanaman akar, dan sayuran juga berkontribusi pada kadmium pada populasi modern.[58] Ada beberapa kasus keracunan umum akibat paparan kadmium jangka panjang akibat makanan dan air yang terkontaminasi, dan penelitian terus berlanjut mengenai mimikri estrogen yang dapat menyebabkan kanker payudara.[58] Dalam beberapa dasawarsa sebelum Perang Dunia II, operasi penambangan mengkontaminasi sungai Jinzū di Jepang dengan terdeteksinya kadmium dan jejak logam beracun lainnya. Sebagai konsekuensinya, kadmium terakumulasi pada tanaman padi yang tumbuh di sepanjang bantaran sungai bagian hilir tambang. Beberapa anggota komunitas pertanian lokal yang mengkonsumsi beras yang terkontaminasi menderita penyakit itai-itai dan kelainan ginjal, termasuk proteinuria dan glukosuria.[59]  Korban keracunan ini hampir secara eksklusif wanita pasca menopause dengan cadangan besi dan mineral tubuh rendah. Paparan kadmium umum yang serupa di belahan dunia lain tidak mengakibatkan masalah kesehatan yang sama karena masyarakatnya mempertahankan kadar besi dan mineral yang cukup. Jadi, walaupun kadmium merupakan faktor utama pencetus penyakit itai-itai di Jepang, sebagian besar peneliti telah menyimpulkan bahwa itu adalah salah satu dari beberapa faktor.[4] Kadmium adalah satu dari enam zat yang dilarang oleh perintah Uni Eropa Restriction on Hazardous Substances (RoHS), yang melarang zat berbahaya tertentu dalam peralatan listrik dan elektronik namun memungkinkan pengecualian tertentu sesuai ruang lingkup undang-undang.[60] Badan Internasional untuk Penelitian Kanker (The International Agency for Research on Cancer) telah mengklasifikasikan kadmium dan senyawa kadmium sebagai karsinogenik bagi manusia.[61] Meskipun paparan kerja kadmium terkait dengan kanker paru-paru dan prostat, namun masih ada kontroversi mengenai karsinogenisitas kadmium dalam lingkungan paparan rendah. Data terakhir dari studi epidemiologi menunjukkan bahwa asupan kadmium melalui makanan berhubungan dengan risiko kanker endometrium, payudara dan prostat yang lebih tinggi serta osteoporosis pada manusia.[62][63][64][65] Sebuah studi baru-baru ini telah menunjukkan bahwa kadar kadmium dalam jaringan endometrium lebih tinggi pada wanita perokok dan bekas perokok.[66] Meskipun beberapa studi epidemiologi menunjukkan korelasi yang signifikan antara paparan kadmium dan kejadian kondisi penyakit pada manusia, peran kadmium sebagai faktor di balik efek ini tetap harus ditunjukkan. Untuk membuktikan peran kausatif, perlu ditentukan mekanisme molekuler bagaimana kadmium dalam paparan rendah dapat menyebabkan efek kesehatan yang merugikan. Satu hipotesis adalah bahwa kadmium bekerja sebagai pengganggu endokrin karena beberapa penelitian eksperimental menunjukkan bahwa ia dapat berinteraksi dengan jalur sinyal hormonal yang berbeda. Misalnya, kadmium dapat mengikat reseptor estrogen alfa,[67][68] dan mempengaruhi transduksi sinyal di sepanjang jalur sinyal estrogen dan MAPK pada dosis rendah.[69][70][71] Merokok tembakau adalah sumber paparan kadmium paling penting di masyarakat umum. Telah diperkirakan sekitar 10% dari kadmium dalam rokok terhirup melalui aktivitas merokok. Penyerapan kadmium melalui paru-paru jauh lebih efektif daripada melalui usus, dan sebanyak 50% kadmium yang dihirup melalui asap rokok dapat diserap.[72] Rata-rata, perokok memiliki konsentrasi kadmium darah 4-5 kali lebih tinggi dan konsentrasi kadmium ginjal 2-3 kali lebih tinggi daripada non-perokok. Meskipun kandungan kadmium dalam asap rokok tinggi, tampaknya ada sedikit paparan kadmium dari merokok pasif. Tidak ada pengaruh yang signifikan terhadap konsentrasi kadmium darah yang terdeteksi pada anak-anak yang terpapar asap tembakau.[73] Bagi masyarakat non-perokok, makanan merupakan sumber paparan kadmium terbesar. Kandungan kadmium yang tinggi dapat ditemukan misalnya pada krustasea, moluska, jeroan, dan produk alga. Namun, karena konsumsi yang lebih tinggi, kontributor paling signifikan terhadap paparan kadmium makanan adalah biji-bijian, sayuran, akar berkanji dan umbi.[74] Paparan kadmium adalah faktor risiko yang terkait dengan aterosklerosis dini dan hipertensi, yang keduanya dapat menyebabkan penyakit kardiovaskular.[75] RegulasiKarena efek buruk pada lingkungan dan kesehatan manusia, pasokan dan penggunaan kadmium dibatasi di Eropa di bawah Peraturan REACH.[76] The EFSA Panel on Contaminants in the Food Chain telah menetapkan 2,5 μg/kg berat badan sebagai asupan mingguan yang dapat ditoleransi untuk manusia.[74] Sebagai perbandingan, Komite Pakar Gabungan FAO/WHO untuk Aditif Makanan (Joint FAO/WHO Expert Committee on Food Additives) telah menetapkan 7 μg/kg bb sebagai tingkat asupan mingguan yang dapat ditoleransi.[77] Badan Administrasi Keselamatan dan Kesehatan Kerja (Occupational Safety and Health Administration, OSHA) telah menetapkan batas paparan yang diizinkan (Permissible Exposure Limit, PEL) untuk kadmium dengan rata-rata waktu tertimbang (time-weighted average, TWA) sebesar 0,005 ppm. Institut Nasional untuk Keselamatan dan Kesehatan Kerja (National Institute for Occupational Safety and Health, NIOSH) belum menetapkan batas paparan yang direkomendasikan (Recommended Exposure Limit, REL) dan telah menetapkannya sebagai diketahui karsinogen bagi manusia. Tingkat IDLH (berbahaya bagi kehidupan dan kesehatan) untuk kadmium adalah 9 mg/m3.[78]
Penarikan produkPada bulan Mei 2006, penjualan kursi dari stadion tua Arsenal F.C., Highbury di London, Inggris dibatalkan setelah ditemukan sejumlah kursi mengandung kadmium.[80] Laporan tingginya penggunaan kadmium pada perhiasan anak-anak pada tahun 2010 memicu penyelidikan Komisi Keamanan Produk Konsumen (Consumer Product Safety Commission) AS.[81] CPSC AS mengeluarkan pemberitahuan penarikan khusus untuk perhiasan yang mengandung kadmium yang dijual oleh toko Claire's[82] dan Wal-Mart.[83] Pada bulan Juni 2010, McDonald secara sukarela menarik lebih dari 12 juta promosi koleksi gelas minum "Shrek Forever After 3D" karena kekhawatiran tingkat kadmium dalam pigmen cat yang digunakan pada gelas.[84] Gelas tersebut diproduksi oleh Arc International, yang berlokasi di Millville, NJ, USA.[85] Lihat jugaReferensi
Bacaan lebih lanjut
Pranala luarLihat entri Kadmium di kamus bebas Wiktionary. Wikimedia Commons memiliki media mengenai Cadmium.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



