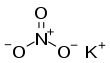|
Kalium nitrat
Kalium nitrat (disebut juga sendawa[2][catatan 1] atau salpeter[3]) adalah senyawa kimia dengan rumus kimia KNO3. Ia termasuk senyawa ionik yang terdiri dari ion kalium K+ dan ion nitrat NO−3. Ia menjadi salah satu sumber nitrogen. Kalium nitrat banyak digunakan dalam pupuk, penghilangan tunggul pohon, propelan roket, dan kembang api. Ia menjadi bahan utama dalam pembuatan bubuk mesiu (bubuk hitam).[7] Dalam daging olahan, kalium nitrat bereaksi dengan hemoglobin dan mioglobin yang kemudian menghasilkan warna merah muda.[8] DeskripsiKalium nitrat merupakan komponen bubuk mesiu teroksidasi (disuplai oksigen). Sebelum fiksasi industri nitrogen skala besar (proses Haber), sumber utama kalium nitrat adalah deposit yang mengkristal dari dinding gua atau mengalirkan bahan organik yang membusuk. Tumpukan kotoran juga sumber umum yang utama: amonia dari dekomposisi urea dan zat nitrogen lainnya akan melalui oksidasi bakteri untuk memproduksi nitrat. Sifat-sifatKalium nitrat memiliki kristal ortorombik pada suhu ruang dan berubah menjadi sistem trigonal pada suhu 129 °C. Kalium nitrat agak mudah larut dalam air, tetapi semakin mudah larut seiring kenaikan suhu. Larutannya hampir netral dengan pH 6,2 pada suhu 14 °C untuk 10% bubuk komersial. Ia tidak higroskopis karena hanya menyerap 0,08% air dalam kelembapan relatif 80% selama lebih dari 50 hari. Ia tidak larut dalam alkohol dan tidak beracun. Ia dapat meledak bila bereaksi dengan reduktor, tetapi tidak mudah meledak dengan sendirinya.[4] Dekomposisi termalAntara 550–790 °C, kalium nitrat mencapai sebuah ekuilibrium yang bergantung pada suhu dengan kalium nitrit:[9]
ProduksiKalium nitrat dapat dibuat dengan menggabungkan amonium nitrat dan kalium hidroksida.
Cara lain yang tidak menghasilkan produk samping amonia adalah dengan menggabungkan amonium nitrat dengan kalium klorida.
Kalium nitrat juga dapat diproduksi dengan menetralkan asam nitrat dengan kalium hidroksida. Reaksi ini sangat eksotermis.
Sejarah produksiSecara historis, nitre-beds tersedia dengan mencampurkan rabuk dengan adukan semen ataupun abu kayu, bahan tanah, dan bahan organik yang umum seperti jerami untuk memberikan porositas pada tumpukan kompos yang secara umum setinggi 1,5 m, selebar 2 m, dan sepanjang 5 m.[10] Timbunannya biasanya ditutupi dari hujan dan dibiarkan lembab oleh urin yang ternyata mempercepat dekomposisi. Setelah kurang lebih setahun, hasilnya dikenai pelindian dengan air untuk menghilangkan kalsium nitrat yang mudah larut dengan air, kemudian diubah menjadi kalium nitrat dengan garam abu. Di Inggris, hak pengolahan bahan peledak telah ada di tangan keluarga John Evelyn, diaris ternama, sebagai monopoli puncak sejak sebelum 1588.[butuh rujukan] KegunaanKalium nitrat dipakai dalam produksi asam nitrat, yaitu dengan menambahkan asam sulfat yang terkonsentrasi pada larutan encer kalium nitrat sehingga menghasilkan asam nitrat dan kalium sulfat yang terpisah melalui distilasi fraksional. Namun, saat ini, yang terjadi adalah sebaliknya: nitrat diproduksi dari asam nitrat melalui proses Ostwald. Kalium nitrat juga digunakan sebagai pupuk dan sebagai propelan roket. Kesalahan konsepsi terkenal ialah bahwa kalium nitrat itu antafrodisiak dan ditambahkan dalam makanan dalam adat yang biasa dikerjakan lelaki. Nyatanya kalium nitrat tak memiliki efek seperti itu pada manusia.[11] Kini, penggunaan kalium nitrat dalam pasta gigi untuk gigi sensitif telah bertambah secara dramatis walau nyatanya telah tak ditampakkan untuk membantu dengan sebenarnya hipersensitivitas gigi.[12] Lihat pulaCatatan kaki
Referensi
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia