|
Asam borat
Asam borat, juga disebut hidrogen borat, asam boraks, asam ortoborat dan acidum boricum, adalah monobasa asam Lewis boron lemah yang sering digunakan sebagai antiseptik, insektisida, penghambat nyala, penyerap neutron, atau prekursor untuk senyawa kimia lainnya. Senyawa ini memiliki rumus kimia H3BO3 (kadang-kadang ditulis B(OH)3), dan ada dalam bentuk kristal tidak berwarna atau serbuk putih yang larut dalam air. Ketika berbentuk mineral, senyawa ini disebut sasolit. KeberadaanAsam borat, atau sasolit, ditemukan dalam keadaan bebas di beberapa distrik vulkanik, misalnya, di wilayah Tuscany Italia, Kepulauan Lipari dan negara bagian Amerika Serikat Nevada. Dalam pengaturan vulkanik terjadi masalah, tercampur dengan uap, dari celah di dalam tanah. Hal ini juga ditemukan sebagai konstituen dari banyak mineral alami, seperti boraks, borasit, boronatrokaisit dan kolemanit. Asam borat dan garamnya ditemukan dalam air laut. Senyawa ini juga ditemukan pada tumbuhan, termasuk hampir semua buah-buahan.[4] Asam borat pertama kali disusun oleh Wilhelm Homberg (1652-1715) dari boraks, oleh aksi asam mineral, dan diberi nama sal sedativum Hombergi ("garam penenang dari Homberg"). Namun borat, termasuk asam borat, telah digunakan sejak Yunani Kuno untuk membersihkan, menjaga makanan, dan kegiatan lainnya. PembuatanAsam borat dapat dibuat dengan mereaksikan boraks (sodium tetraborat dekahidrat) dengan asam mineral, seperti asam klorida:
Zat ini juga terbentuk sebagai produk hidrolisis trihalides boron dan diborana:[5]
SifatAsam borat larut dalam air mendidih. Ketika dipanaskan di atas 170 °C, asam borat akan terdehidrasi, membentuk asam metaborat (HBO2):
Asam metaborat berwarna putih, berbentuk kristal kubik padat dan hanya sedikit larut dalam air. Asam metaborat mencair pada suhu sekitar 236 °C, dan ketika dipanaskan di atas 300 °C akan terdehidrasi lebih lanjut, membentuk asam tetraborat atau asam piroborat (H2B4O7):
Istilah asam borat kadang-kadang mengacu pada senyawa ini. Pemanasan lebih lanjut akan membentuk boron trioksida.
Ada pertentangan mengenai interpretasi asal usul keasaman larutan asam borat cair. Spektroskopi Raman dalam larutan basa kuat menunjukkan adanya ion B(OH)−4,[6] sehingga beberapa penelitian menyimpulkan bahwa keasaman secara eksklusif karena abstraksi OH– dari air:[6][7][8][9]
atau lebih tepat dinyatakan dalam larutan:
Hal ini dapat dikarakterisasi[7][8][9] sebagai asam Lewis boron terhadap OH–, bukan sebagai asam Brønsted. Namun sumber lain[10] mengatakan bahwa asam borat juga merupakan tribasa asam Brønsted, dengan langkah-langkah ionisasi berturut-turut:
Karena nilai Ka1 sebanding dengan reaksi dengan OH–, konsentrasi BO(OH)−2 dan B(OH)−4 serupa.[10] Anion Poliborat terbentuk pada pH 7-10 jika konsentrasi boron lebih tinggi sekitar 0,025 mol/L. Yang paling terkenal di antaranya adalah ion tetraborat, ditemukan pada mineral boraks:
Asam borat membuat kontribusi penting untuk penyerapan bunyi frekuensi rendah dalam air laut.[11] ReaksiDengan alkohol polihidrat seperti gliserol dan manitol, keasaman asam borat meningkat. Dengan manitol misalnya pK menurun menjadi 5,15. Hal ini disebabkan pembentukan kelat, [((OH)4C6H8O2)2B]−, dan fitur ini digunakan dalam kimia analitik.[12] Asam borat larut dalam asam sulfat anhidrat dan bersifat asam kuat:[12]
Asam borat bereaksi dengan alkohol membentuk ester borat, B(OR)3 dimana R merupakan alkil atau aril. Suatu agen dehidrasi, seperti asam sulfat pekat biasanya ditambahkan:[13]
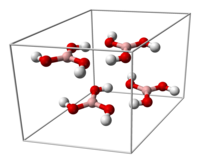
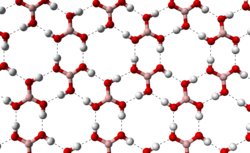
Struktur kristalKristal asam borat terdiri dari lapisan molekul B(OH)3 yang terbentuk bersama oleh ikatan hidrogen. Panjang ikatan B-O 136 pm dan O-H 97 pm dengan ikatan hidrogen 272pm. Jarak antara dua lapisan yang berdekatan 318 pm.[12]
ToksikologiBerdasarkan median dosis letal mamalia (LD50) nilai 2.660 mg/kg massa tubuh, asam borat beracun jika diambil secara internal atau terhirup dalam jumlah besar. Indeks Merck Edisi Ketigabelas menunjukkan bahwa LD50 asam borat adalah 5,14 g/kg untuk dosis oral yang diberikan kepada tikus, dan bahwa 5 sampai 20 g/kg telah menghasilkan kematian pada manusia dewasa. Demi perbandingan, LD50 garam dilaporkan 3,75 g/kg pada tikus menurut Indeks Merck. Tapi hal ini sangat menyesatkan, manusia telah diketahui meninggal dari jumlah hanya sebagian kecil dari LD50. "Dosis letal minimal tertelan boron (sebagai asam borat) dilaporkan menjadi 2-3 g pada bayi, 5-6 g pada anak-anak, dan 15-20 g pada orang dewasa", menurut Badan Pendaftaran Zat Beracun dan Penyakit.[14] Paparan jangka panjang untuk asam borat mungkin lebih mengkhawatirkan, menyebabkan kerusakan ginjal dan pada akhirnya gagal ginjal (lihat link di bawah). Meskipun tidak tampak karsinogenik, studi pada anjing telah dilaporkan menyebabkan atrofi testis setelah terpapar 32 mg/kg berat badan/hari selama 90 hari. Tingkat ini jauh lebih rendah dari LD50.[15] Menurut IUCLID Dataset yang diterbitkan oleh Komisi Eropa, asam borat dalam dosis tinggi menunjukkan perkembangan toksisitas yang signifikan dan bersifat teratogenik pada kelinci, tikus, dan janin tikus serta cacat jantung, variasi rangka, lesi ginjal ringan.[16] Sebagai akibatnya, pada bulan Agustus 2008, pada perintah ATP ke Uni Eropa ke-30 67/548/EEC, Komisi Eropa memutuskan untuk mengubah klasifikasi sebagai reprotoksik kategori 2 dan menerapkan pernyataan risiko R60 (dapat menurunkan kesuburan) dan R61 (dapat menyebabkan bahaya bagi anak dalam kandungan).[17][18][19][20][21] Pada Pertemuan Asosiasi Manufaktur Diagnostik Eropa (EDMA) terakhir, terdapat beberapa tambahan daftar calon baru ke dalam Substansi Kepedulian Sangat Tinggi (SVHC) sehubungan dengan Peraturan Pendaftaran, Evaluasi, Otorisasi dan Pembatasan Bahan Kimia 2007 (REACH) yang dibahas. Pendaftaran dan tinjauan diselesaikan sebagai bagian dari REACH yang memiliki arti bahwa klasifikasi asam borat saat ini CAS 10043-35-3 / 11113-50-1 per 1 Desember 2010 terdaftar sebagai H360FD (Dapat mengganggu kesuburan. Dapat membahayakan janin).[22][23] PenggunaanMedisAsam borat dapat digunakan sebagai antiseptik untuk luka bakar ringan atau luka dan kadang-kadang digunakan dalam pembalut atau salep. Asam borat diterapkan dalam larutan yang sangat encer sebagai pencuci mata. Asam borat encer dapat digunakan sebagai penyemprot vagina untuk mengobati vaginosis bakteri yang disebabkan oleh alkalinitas berlebihan,[24] serta kandidiasis yang disebabkan oleh kandida non albikan.[25] Sebagai senyawa antibakteri, asam borat juga dapat digunakan sebagai pengobatan jerawat. Senyawa ini juga digunakan untuk mencegah penyakit kaki atlet, dengan memasukkan serbuk asam borat ke dalam kaus kaki atau stoking, dan dalam larutan alkohol dapat digunakan untuk mengobati beberapa jenis otitis externa (infeksi telinga) baik pada manusia maupun hewan. Asam borat juga digunakan sebagai pengawet dalam botol sampel urin di Inggris. Larutan asam borat yang digunakan sebagai pencuci mata atau pada kulit terkelupas diketahui menjadi racun, terutama bagi bayi, penggunaan terutama setelah berulang; hal ini dikarenakan tingkat penghilangan yang lambat.[26] InsektisidaAsam borat pertama kali terdaftar di Amerika Serikat sebagai insektisida pada tahun 1948 untuk mengendalikan kecoa, rayap, semut api, kutu, gegat, dan banyak serangga lainnya. Produk ini umumnya dianggap aman untuk digunakan di dapur rumah tangga untuk mengendalikan kecoa dan semut.[27] Asam borat ini bertindak sebagai racun perut yang mempengaruhi metabolisme serangga, dan serbuk kering abrasif untuk serangga eksoskeleton. PengawetanDalam kombinasi dengan penggunaannya sebagai insektisida, asam borat juga mencegah dan menghancurkan busuk basah dan kering pada kayu. Asam borat dapat digunakan dalam kombinasi dengan pembawa glikol etilena untuk merawat kayu eksternal terhadap serangan jamur dan serangga. Hal ini dimungkinkan untuk membeli borat, kemudian diresap ke sebuah tongkat untuk dimasukkan ke dalam kayu melalui lubang bor di mana kelembaban dan lengasan diketahui berkumpul dan berdiam. Asam borat ini tersedia dalam bentuk gel dan bentuk pasta injeksi untuk merawat kayu yang terkena pembusukan tanpa perlu mengganti kayu. Konsentrat perawatan berbasis borat dapat digunakan untuk mencegah lendir, miselium, dan pertumbuhan alga, bahkan dalam lingkungan laut. Asam borat ditambahkan ke dalam garam untuk mengawetkan kulit sapi, kulit lembu, dan kulit domba. Campuran ini dapat membantu untuk mengontrol perkembangan bakteri, dan membantu untuk mengendalikan serangga. Penyangga pH  Asam borat dalam kesetimbangan dengan basa konjugasinya ion borat banyak digunakan (dalam rentang konsentrasi 50-100 ppm setara boron) sebagai sistem penyangga pH primer atau tambahan dalam kolam renang. Asam borat merupakan asam lemah, dengan pKa (pH di mana penyangga terkuat karena asam borat bebas dan ion dalam konsentrasi yang sama) mulai dari 9,24 dalam air murni pada suhu 25 °C. Namun jelas bahwa pKa secara substansial lebih rendah di kolam renang atau laut perairan karena interaksi dengan berbagai molekul lain dalam larutan. Hal ini menyebabkan larutan akan menjadi sekitar 9,0 di kolam air asin. Tidak peduli yang ditambahkan boron bentuk larut, dalam rentang yang dapat diterima dari pH dan konsentrasi boron untuk kolam renang, asam borat adalah bentuk dominan dalam larutan air, seperti yang ditunjukkan pada gambar terlampir. Asam borat - sistem borat dapat berguna sebagai sistem penyangga utama (menggantikan sistem bikarbonat dengan pKa1 = 6,0 dan pKa2 = 9,4 dalam kondisi kolam renang air asin khas) di kolam dengan generator klorin air garam yang cenderung menunjukkan pergeseran pH ke atas dari berbagai kerja pH 7,5-8,2. Kapasitas penyangga yang lebih besar terhadap kenaikan pH (menuju pKa sekitar 9,0), seperti yang digambarkan dalam grafik yang terlampir. Penggunaan asam borat dalam kisaran konsentrasi ini tidak memungkinkan pengurangan konsentrasi HOCl bebas yang dibutuhkan untuk sanitasi kolam renang, tetapi dapat menambahkan sedikit efek foto-protektif asam sianurat dan memberikan manfaat lain melalui kegiatan anti-korosif atau dirasakan kelembutan air, tergantung pada komposisi air kolam terlarut secara keseluruhan.[28] PelumasanSuspensi koloid nanopartikel asam borat terlarut dalam minyak bumi atau minyak sayur dapat membentuk pelumas yang luar biasa pada permukaan keramik atau logam[29] dengan koefisien gesekan yang menurun dengan meningkatnya tekanan dengan nilai luncur berkisar 0,10-0,02. Film swapelumas H3BO3 hasil dari reaksi kimia spontan antara molekul air dan salutan B2O3 dalam lingkungan yang lembap. Dalam jumlah besar-besaran, terdapat hubungan terbalik antara koefisien gesekan dan tekanan kontak Hertzian disebabkan oleh beban yang diterapkan. Asam borat digunakan untuk melumasi papan karambol dan novuss, memungkinkan untuk bermain lebih cepat.[30] Tenaga nuklirAsam borat digunakan di beberapa pembangkit listrik tenaga nuklir sebagai racun neutron. Boron dalam asam borat mengurangi kemungkinan fisi termal dengan menyerap beberapa neutron termal. Reaksi fisi berantai umumnya didorong oleh kemungkinan bahwa neutron bebas akan menghasilkan fisi dan ditentukan oleh bahan dan sifat geometris dari reaktor. Boron alami terdiri dari sekitar 20% boron-10 dan 80% isotop boron-11. Boron-10 memiliki penampang tinggi untuk penyerapan energi rendah (thermal) neutron. Dengan meningkatkan konsentrasi asam borat dalam pendingin reaktor, kemungkinan bahwa neutron akan menyebabkan fisi berkurang. Perubahan konsentrasi asam borat dapat secara efektif mengatur laju fisi yang terjadi di reaktor. Asam borat hanya digunakan dalam reaktor bertekanan air (PWR) (reaktor air mendidih (BWR) menggunakan Natrium Pentaborat untuk tujuan yang sama). Asam borat dapat dilarutkan dalam kolam bahan bakar bekas yang digunakan untuk menyimpan elemen bahan bakar bekas. Konsentrasi cukup tinggi untuk menjaga multiplikasi neutron minimal. Asam borat dibuang dari Reaktor 4 di PLTN Chernobyl setelah krisis untuk mencegah reaksi lain yang terjadi. IndustriPenggunaan industri utama asam borat dalam pembuatan serat kaca monofilamen biasanya disebut sebagai serat kaca tekstil. Serat kaca tekstil ini digunakan untuk memperkuat plastik dalam aplikasi yang berkisar dari kapal, hingga pipa industri untuk papan sirkuit komputer.[31] Dalam industri perhiasan, asam borat sering digunakan dalam kombinasi dengan spirtus untuk mengurangi oksidasi permukaan dan pewarnaan api dari pembentukan pada logam selama proses pelunakan dan pematri. Asam borat digunakan dalam produksi kaca pada tampilan layar datar LCD. Dalam penyepuhan elektrik, asam borat digunakan sebagai bagian dari beberapa rumus milik perorangan. Salah satu rumus yang dikenal seperti sebutan untuk rasio sekitar 1 hingga 10 H3BO3 hingga NiSO4, sebagian kecil dari natrium lauril sulfat dan sebagian kecil dari H2SO4. Asam borat, dicampur dengan boraks (natrium tetraborat dekahidrat) pada perbandingan berat 4:5, merupakan larutan yang sangat larut dalam air, meskipun keduanya tidak begitu larut secara terpisah.[32] Larutan ini digunakan untuk penghambat api pada bahan kayu dengan impregnasi.[33] Senyawa ini juga digunakan dalam pembuatan cetak-tekan massa, silika yang mengandung serbuk halus yang digunakan untuk memproduksi lapisan tungku induksi dan keramik. Asam borat merupakan salah satu substansi yang paling umum digunakan yang dapat menetralisir asam hidrofluorat aktif (HF). Senyawa ini bekerja dengan memaksa anion F- bebas dalam garam kompleks. Proses ini mengalahkan sifat racun asam hidrofluorat, terutama kemampuannya untuk menyerap ion kalsium dari serum darah yang dapat menyebabkan serangan jantung dan dekomposisi tulang; peristiwa tersebut dapat terjadi akibat hanya kontak kulit sedikit dengan HF.[34] Asam borat ditambahkan ke boraks untuk digunakan sebagai pengelasan fluks oleh pandai besi.[35] Asam borat, dalam kombinasi dengan minyak silikon, digunakan untuk memproduksi Silly Putty.[36] Asam borat, dapat digunakan pada peretakan hidraulis Serpihan Marcellus, di negara bagian Pennsylvania.[37] PiroteknikBoron digunakan dalam piroteknik untuk mencegah reaksi amida membentuk antara aluminium dan nitrat. Sejumlah kecil asam borat ditambahkan pada komposisi untuk menetralkan amida alkali yang dapat bereaksi dengan aluminium. Asam borat dapat digunakan sebagai pewarna untuk membuat api berwarna hijau. Misalnya, ketika dilarutkan dalam metanol yang populer digunakan oleh akrobat api dan pemutar api untuk membuat api berwarna hijau tua. Referensi
Bacaan lebih lanjut
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||