|
Palonosetron
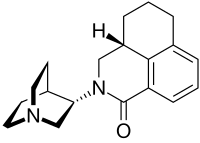
Palonosetron adalah obat yang digunakan untuk pencegahan dan pengobatan mual dan muntah akibat kemoterapi (CINV). Obat ini merupakan antagonis 5-HT3.[1][2][3] Palonosetron diberikan secara intravena,[4] atau sebagai kapsul oral tunggal.[5] Obat ini memiliki durasi kerja yang lebih lama daripada antagonis 5-HT3 lainnya. Formulasi oral disetujui pada tanggal 22 Agustus 2008, untuk pencegahan CINV akut saja, karena uji klinis besar tidak menunjukkan pemberian oral sama efektifnya dengan penggunaan intravena terhadap CINV yang tertunda.[5] Obat ini tercantum dalam Daftar Obat Esensial Organisasi Kesehatan Dunia.[6] Kombinasi oral netupitant/palonosetron disetujui untuk CINV akut dan tertunda.[7][8][9][10] Efek sampingEfek samping yang paling umum adalah sakit kepala, yang terjadi pada 4–11% pasien, dan konstipasi hingga 6% pasien. Pada kurang dari 1% pasien, gangguan pencernaan lainnya terjadi, sulit tidur, blok atrioventrikular derajat pertama dan kedua, nyeri otot, dan sesak napas. Palonosetron ditoleransi dengan baik seperti antagonis 5-HT3 lainnya, dan sedikit lebih rendah daripada plasebo.[11][12] InteraksiPalonosetron tidak secara relevan menghambat atau menginduksi enzim hati sitokrom P450. Ada laporan kasus tentang sindrom serotonin ketika obat tersebut dikombinasikan dengan zat serotonergik, seperti penghambat penyerapan kembali serotonin selektif (SSRI) dan penghambat penyerapan kembali serotonin-norepinefrin (SNRI), dua jenis antidepresan yang umum.[11][12] FarmakologiMekanisme kerjaPalonosetron adalah antagonis 5-HT3, yang umumnya dikenal sebagai "setron". Obat ini bekerja dengan menghalangi serotonin agar tidak terikat pada reseptor 5-HT3.[13] FarmakokinetikaPalonosetron yang digunakan secara oral diserap dengan baik dari usus dan memiliki bioavailabilitas sebesar 97%. Kadar plasma darah tertinggi dicapai setelah 5,1±1,7 jam; terlepas dari asupan makanan; dan ikatan protein plasma adalah 62%. 40% zat tersebut dieliminasi dalam bentuk yang tidak berubah, dan 45–50% lainnya dimetabolisme oleh enzim hati CYP2D6, serta pada tingkat yang lebih rendah oleh CYP3A4 dan CYP1A2. Dua metabolit utama, N-oksida dan turunan hidroksil, memiliki kurang dari 1% efek antagonis palonosetron dan dengan demikian praktis tidak aktif.[11][12] Palonosetron dan metabolitnya sebagian besar (hingga 80–93%) dieliminasi melalui ginjal. Waktu paruh biologis pada orang sehat adalah 37±12 jam dalam sebuah penelitian, dan 48±19 jam pada pasien kanker. Pada 10% pasien, waktu paruhnya lebih dari 100 jam.[11][12] Sebagian besar setron yang dipasarkan memiliki waktu paruh dalam kisaran sekitar dua hingga 15 jam.  KimiaZat ini berbentuk padat pada suhu kamar dan meleleh pada suhu 87 hingga 88 °C (189 hingga 190 °F).[14] Infus dan kapsul mengandung palonosetron hidroklorida,[11] yang juga berbentuk padat. Hidroklorida ini mudah larut dalam air, larut dalam propilen glikol, dan sedikit larut dalam etanol dan isopropil alkohol.[12][15] Molekul ini memiliki dua atom karbon asimetris. Zat ini digunakan dalam bentuk stereoisomer (S,S) murni.[15] Masyarakat dan budayaEkonomiPalonosetron dikembangkan oleh Helsinn sekitar tahun 2001. Pada bulan Januari 2003, Helsinn mengajukan permohonan paten sementara untuk palonosetron. Selama 10 tahun berikutnya, Helsinn mengajukan empat permohonan paten yang mengklaim prioritas pada tanggal Januari 2003. Terkait hal ini, Helsinn mengajukan permohonan paten keempatnya pada tahun 2013. Paten tersebut (paten ’219) mencakup dosis tetap 0,25 mg palonosetron dalam larutan 5 ml. Saat mengembangkan obat tersebut, Helsinn menandatangani perjanjian lisensi rahasia dengan sebuah perusahaan bernama MGI untuk menjual palonosetron di Amerika Serikat. Perjanjian lisensi ini berisi informasi kimia tentang palonosetron dan persyaratan dosis. Namun, Helsinn tidak mengajukan paten untuk palonosetron hingga dua tahun setelah mereka menandatangani perjanjian dengan MGI.[1] Pada tahun 2011, Teva Pharmaceuticals - produsen obat generik - menantang keabsahan paten Helsinn dengan mengajukan permohonan versi generik palonosetron ke FDA. Teva mengklaim bahwa, karena Helsinn mengungkapkan/menjual dosis palonosetron 0,25 mg ke MGI pada tahun 2003, yang lebih dari setahun (sebenarnya sekitar 2 tahun) sebelum tanggal prioritas paten '219-nya, penjualan "rahasia" ini menghalangi Helsinn untuk menerima paten. Kesimpulan ini merupakan hasil dari bahasa America Invents Act, yang melarang paten atas penemuan, yang "digunakan publik, dijual, atau tersedia untuk publik sebelum tanggal pengajuan efektif penemuan yang diklaim," 35 U. S. C. §102(a)(1). Pengadilan Distrik memutuskan bahwa ketentuan “penjualan” AIA tidak berlaku, karena pengungkapan publik perjanjian tersebut tidak mengungkapkan dosis 0,25 mg. Pengadilan Federal membatalkannya, dengan menyatakan bahwa penjualan tersebut diungkapkan kepada publik, terlepas dari apakah rincian penemuan tersebut diungkapkan kepada publik dalam ketentuan perjanjian penjualan. SCOTUS setuju dengan Pengadilan Federal, bahwa dalam kasus ini penjualan komersial kepada pihak ketiga, yang diharuskan untuk merahasiakan penemuan tersebut, tetap menempatkan penemuan tersebut “pada penjualan” berdasarkan USC §102(a).[2] Referensi
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia