|
Tembaga(II) hidroksida
Tembaga(II) hidroksida adalah hidroksida tembaga dengan rumus kimia Cu(OH)2. Ini adalah biru pucat kehijauan atau hijau kebiruan. Beberapa bentuk tembaga(II) hidroksida dijual sebagai "hidroksida tembaga" yang distabilkan, walaupun mereka kemungkinan terdiri dari campuran tembaga(II) karbonat dan hidroksida. Tembaga hidroksida adalah basa lemah. KeberadaanTembaga(II) hidroksida telah dikenal sejak peleburan tembaga dimulai sekitar 5000 SM meskipun para alkemis mungkin yang pertama kali memproduksinya dengan mencampurkan larutan alkali (natrium atau kalium hidroksida) dan vitriol biru (tembaga(II) sulfat).[3] Sumber kedua senyawa tersedia di zaman kuno. Itu diproduksi pada skala industri selama abad ke-17 dan ke-18 untuk digunakan dalam pigmen seperti verditer biru dan bremen hijau.[4] Pigmen ini digunakan dalam keramik dan lukisan. .[5] Sintesis laboratorium Tembaga(II) hidroksida dapat diproduksi dengan menambahkan natrium hidroksida ke dalam larutan encer tembaga(II) sulfat (CuSO4 · 5H2O).[6] Endapan yang dihasilkan dengan cara ini, bagaimanapun, sering mengandung air dan sejumlah besar pengotor natrium hidroksida. Produk yang lebih murni dapat dicapai jika amonium klorida ditambahkan ke larutan terlebih dahulu.[7] Sebagai alternatif, tembaga hidroksida mudah dibuat dengan elektrolisis air (mengandung sedikit elektrolit seperti natrium sulfat, atau magnesium sulfat) dengan anoda tembaga. MineralMineral formula Cu(OH)2 disebut spertiniite. Tembaga(II) hidroksida jarang ditemukan sebagai mineral yang tidak terkombinasi karena perlahan bereaksi dengan karbon dioksida dari atmosfer untuk membentuk tembaga(II) karbonat. Jadi tembaga perlahan memperoleh lapisan hijau kusam di udara lembap oleh reaksi:
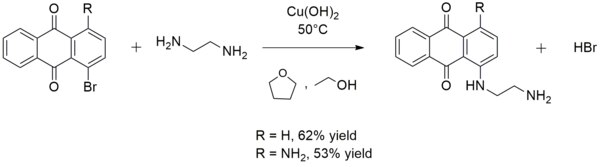
Bahan hijau pada prinsipnya adalah campuran mol 1:1 Cu(OH)2 dan CuCO3.[8] Patina ini terbentuk pada perunggu dan patung paduan tembaga lainnya seperti Patung Liberty. StrukturStruktur Cu(OH)2 telah ditentukan oleh kristalografi sinar-X. Pusat tembaga adalah piramidal persegi. Empat jarak Cu-O dalam kisaran pesawat adalah 1,96 Å, dan jarak Cu-O aksial adalah 2,36 Å. Ligan hidroksida di dalam pesawat menjembatani dua kali lipat atau tiga kali lipat.[9] ReaksiStabil hingga sekitar 100 °C.[6] Tembaga(II) hidroksida bereaksi dengan larutan amonia untuk membentuk larutan biru ion kompleks tetramin tembaga [Cu(NH3)4]2+. Ini mengkatalisasi oksidasi larutan amonia dengan adanya dioksigen, sehingga menimbulkan nitrit tembaga ammina, seperti Cu(NO2)2( NH3)n.[10][11] Tembaga(II) hidroksida bersifat amfoter ringan. Ini sedikit larut dalam alkali pekat, membentuk [Cu(OH)4]2−.[6][12] Reagen untuk kimia organikTembaga(II) hidroksida memiliki peran yang agak khusus dalam sintesis organik. Seringkali, ketika digunakan untuk tujuan ini, disiapkan di situ dengan mencampurkan garam tembaga(II) larut dan kalium hidroksida. Kadang-kadang digunakan dalam sintesis aril amina. Misalnya, tembaga(II) hidroksida mengkatalisis reaksi etilendiamina dengan 1-bromoanthraquinone atau 1-amino-4-bromoanthraquinone untuk membentuk 1 - ((2-aminoetil) amino) antrakuinon atau 1-amino-4 - ((2-aminoetil ) amino) antrakuinon, masing-masing:[13] Tembaga(II) hidroksida juga mengubah asam hidrazida menjadi asam karboksilat pada suhu kamar. Konversi ini berguna dalam sintesis asam karboksilat dengan adanya gugus fungsi rapuh lainnya. Hasilnya umumnya sangat baik seperti halnya produksi asam benzoat dan asam oktanoat:[13] PenggunaanTembaga(II) hidroksida dalam larutan amonia, yang dikenal sebagai pereaksi Schweizer, memiliki kemampuan menarik untuk melarutkan selulosa. Properti ini menyebabkannya digunakan dalam produksi rayon, serat selulosa. Ini juga digunakan secara luas dalam industri akuarium karena kemampuannya untuk menghancurkan parasit eksternal pada ikan, termasuk cacing, ich laut, sungai dan beludru laut, tanpa membunuh ikan. Meskipun senyawa tembaga lain yang larut dalam air dapat efektif dalam peran ini, mereka umumnya menghasilkan kematian ikan yang tinggi. Tembaga(II) hidroksida telah digunakan sebagai alternatif dari campuran Bordeaux, fungisida dan nematisida.[14] Produk-produk tersebut termasuk Kocide 3000, yang diproduksi oleh Kocide L.L.C. Tembaga(II) hidroksida juga kadang-kadang digunakan sebagai pewarna keramik. Tembaga(II) hidroksida telah dikombinasikan dengan cat lateks, membuat produk yang dirancang untuk mengendalikan pertumbuhan akar pada tanaman pot. Akar sekunder dan lateral tumbuh dan berkembang, menghasilkan sistem akar yang padat dan sehat. Itu dijual dengan nama Spin Out, yang pertama kali diperkenalkan oleh Griffin L.L.C. Hak-hak tersebut sekarang dimiliki oleh SePRO Corp.[15] Sekarang dijual sebagai Microkote baik dalam larutan yang Anda aplikasikan sendiri, atau sebagai pot yang dirawat. Hidroksida tembaga(II) lainnya Bersama dengan komponen lain, tembaga(II) hidroksida banyak. Beberapa mineral yang mengandung tembaga(II) mengandung hidroksida. Contoh penting termasuk azurit, perunggu, antlerit, dan brokantit. Azurite (2CuCO3·Cu(OH)2) dan malakit (CuCO3·Cu(OH)2) adalah hidroksi-karbonat, sedangkan antlerit (CuSO4·2Cu(OH)2) dan brokantit (CuSO4·3Cu(OH)2) adalah hidroksi -sulfat. Banyak turunan tembaga sintetis(II) hidroksida telah diselidiki.[17] Referensi
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||