维基百科 中的醫學内容
仅供参考 ,並
不能 視作專業意見。如需獲取醫療幫助或意見,请咨询专业人士。詳見
醫學聲明 。
四氢大麻酚 (THC) 懷孕分級 依賴性 生理:無 成癮性 不確定 ATC碼 法律規範
生物利用度 10-35% (吸入),6-20% (口服)[ 1] 血漿蛋白結合率 95-99%[ 1] 药物代谢 主要在肝脏中为CYP2C代谢[ 1] 生物半衰期 1.6-59小时[ 1] 排泄途徑 65-80% (粪便),20-35% (尿液),以酸型代谢物的形式[ 1]
(−)-(6aR ,10aR )-6,6,9-trimethyl-H -benzo[c ]chromen-1-olR ,10aR )-6,6,9-三甲基-3-戊基-6a,7,8,10a-四氢-6H -苯并[c ]色烯-1-酚
CAS号 1972-08-3 Y PubChem CID IUPHAR/BPS DrugBank ChemSpider UNII ChEBI ChEMBL CompTox Dashboard (EPA ) ECHA InfoCard 100.153.676 化学式 C 21 H 30 O 2 摩尔质量 314.45 3D模型(JSmol 比旋度 −152° (乙醇) 沸点 157 °C(315 °F) [ 2]
C1=C(CC[C@@H]3[C@@H]1C2=C(C=C(C=C2OC3(C)C)CCCCC)O[H])C
四氢大麻酚 (Tetrahydrocannabinol ,简称THC),又称Δ9 -四氢大麻酚 (Δ9 -THC)、Δ1 -THC(根据旧命名法),為大麻素 之一,是大麻 中的主要精神活性物质。
四氢大麻酚最早由以色列 雷霍沃特 魏茨曼科学研究所 的三名研究人员在1964年分离出来。[ 4] [ 5] [ 6]
与植物中的其他多数药理活性次级代谢产物 类似,四氢大麻酚是在大麻中发现的一种脂类 [ 7] 植物 (对于草食性动物)的自我防御机制。[ 8] UV-B 段(280~315纳米)的强吸收,可能对植物具保护作用,使其免受紫外線 的伤害。[ 9] [ 10] [ 11]
THC及其双键异构体及其立体异构体是联合国“精神药物公约 ”中规定的三种大麻素 之一(另外两种是Dimethylheptylpyran和Parahexyl)。它在1971年被列在附表一,但是在世界卫生组织 (WHO)的建议之后,在1991年被重新分类到附表二。根据随后的研究,世界卫生组织 建议将这一重新分类列入不那么严格的附表三[ 12] 麻醉品单一公约 ”(附表一和附表四)安排大麻作为植物。根据1970年美国国会通过的“受控物质法案 [ 13]
四氢大麻酚是一种经典大麻素受体 大麻素Ⅰ型受体 CB1 (Ki =10nM[ 14] CB2 (Ki =24nM[ 14] [ 15]
早期发现:罗杰·亚当斯 从大麻中分离和鉴定出大麻二酚,显示它与大麻酚和四氢大麻酚的关系[ 16] 希伯来大学 药学院的一个研究小组研究,他们在1964年报告了他们的工作成果[ 4] 拉斐尔·梅乔勒姆 [ 17]
四氢大麻酚是一种芳香 类萜 ,因此难溶于水,但易溶于多数有机溶剂 中,特别是脂类 和醇 [ 18]
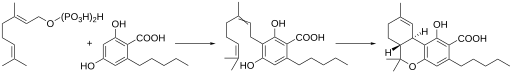
四氢大麻酚羧酸的生物合成 大麻植物内四氢大麻酚主要是以四氢大麻酚羧酸(THCA)的形式存在,后者是由香叶基焦磷酸 与2,4-二羟基-6-戊基苯甲酸 酶促缩合产生的大麻萜酚酸 [ 19] THC酸合成酶 催化下环化而得。经过一段时间后,或者被加热时,四氢大麻酚羧酸被脱羧 ,得到THC。THCA生物合成的途径类似于在蛇麻 花朵中产生苦味酸hum草酮 的途径[ 20] [ 21]
人体内的四氢大麻酚主要被代谢为11-羟基-THC ,该代谢物仍有精神活性,继续被代谢则产生11-正-9-羧基-THC 。从人类和动物体内可鉴定出超过100种四氢大麻酚的代谢物,但其中以11-羟基-THC和11-正-9-羧基-THC含量最高[ 22] 细胞色素P450 酶类CYP2C9 、CYP2C19 和CYP3A4 所催化[ 23] 葡糖醛酸 酯及游离的11-正-9-羧基-THC。[ 24]
^ 1.0 1.1 1.2 1.3 1.4 Grotenhermen F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacokinet. 2003, 42 (4): 327–60. PMID 12648025 doi:10.2165/00003088-200342040-00003 ^ Cannabis and Cannabis Extracts: Greater Than the Sum of Their Parts? (PDF) . www.haworthpress.com. [2009-10-22 ] . (原始内容 (PDF) 存档于2010-09-02). ^ Tetrahydrocannabinol (页面存档备份 ,存于互联网档案馆 ) bei ChemIDplus ^ 4.0 4.1 Gaoni, Yechiel; Raphael Mechoulam. Isolation, structure and partial synthesis of an active constituent of hashish (PDF) . Journal of the American Chemical Society. 1964, 86 (8): 1646–1647 [2008-05-31 ] . doi:10.1021/ja01062a046 ^ Interview with the winner of the first ECNP Lifetime Achievement Award: Raphael Mechoulam, Israel (页面存档备份 ,存于互联网档案馆 ) February 2007^ Geller, Tom. (2007)."Cannabinoids: A Secret History (页面存档备份 ,存于互联网档案馆 )", Chemical Heritage Newsmagazine , 25 (2)
^ Firn, Richard (2010). Nature's Chemicals. Oxford: Biology.
^ Pate, D.W. Chemical ecology of Cannabis . J. Int. Hemp Assoc. 1994, 1 (29): 32–37 [2009-12-08 ] . (原始内容 存档于2020-03-27). ^ Pate, D.W. Possible role of ultraviolet radiation in evolution of Cannabis chemotypes. Economic Botany. 1983, 37 : 396–405. doi:10.1007/BF02904200 ^ Lydon, J; A.H. Teramura. Photochemical decomposition of cannabidiol in its resin base . Phytochemistry. 1987, 26 : 1216. doi:10.1016/S0031-9422(00)82388-2 ^ Lydon, J; A.H. Teramura, C.B. Coffman. UV-B radiation effects on photosynthesis, growth and cannabinoid production of two Cannabis sativa chemotypes. Photochem. Photobiol. A. 1987, 46 : 201. doi:10.1111/j.1751-1097.1987.tb04757.x ^ A Primer on the UN Drug Control Conventions. Transnational Institute . [2017-11-25 ] . (原始内容存档 于2018-02-03). ^ 存档副本 . [2017-11-25 ] . (原始内容 存档于2017-08-09). ^ 14.0 14.1 PDSP Database – UNC . NIMH Psychoactive Drug Screening Program. [11 June 2013] . (原始内容 存档于2013-11-08). ^ Pertwee RG. The pharmacology of cannabinoid receptors and their ligands: An overview. International Journal of Obesity. 2006, 30 : S13–S18. PMID 16570099 doi:10.1038/sj.ijo.0803272 ^ Roger Adams, Madison Hunt, J. H. Clark. Structure of Cannabidiol, a Product Isolated from the Marihuana Extract of Minnesota Wild Hemp. . Journal of the American Chemical Society. 1940, 62 : 196–200 [2017-11-25 ] . doi:10.1021/ja01858a058 存档 于2018-04-11). ^ Mechoulam R. Marihuana chemistry. Science. 1970, 168 (3936): 1159–66. Bibcode:1970Sci...168.1159M PMID 4910003 doi:10.1126/science.168.3936.1159 ^ Garrett ER, Hunt CA. Physicochemical properties, solubility, and protein binding of Δ9 -tetrahydrocannabinol . J. Pharm. Sci. July 1974, 63 (7): 1056–64. PMID 4853640 doi:10.1002/jps.2600630705 ^ Fellermeier M, Zenk MH. Prenylation of olivetolate by a hemp transferase yields cannabigerolic acid, the precursor of tetrahydrocannabinol. FEBS Lett. May 1998, 427 (2): 283–5. PMID 9607329 ^ Marks MD, Tian L, Wenger JP, Omburo SN, Soto-Fuentes W, He J, Gang DR, Weiblen GD, Dixon RA. Identification of candidate genes affecting Δ9-tetrahydrocannabinol biosynthesis in Cannabis sativa . Journal of Experimental Botany. 2009, 60 (13): 3715–26. PMC 2736886 PMID 19581347 doi:10.1093/jxb/erp210 ^ Baker PB, Taylor BJ, Gough TA. The tetrahydrocannabinol and tetrahydrocannabinolic acid content of cannabis products. J Pharm Pharmacol. June 1981, 33 (6): 369–72. PMID 6115009 doi:10.1111/j.2042-7158.1981.tb13806.x ^ Aizpurua-Olaizola, Oier; Zarandona, Iratxe; Ortiz, Laura; Navarro, Patricia; Etxebarria, Nestor; Usobiaga, Aresatz. Simultaneous quantification of major cannabinoids and metabolites in human urine and plasma by HPLC-MS/MS and enzyme-alkaline hydrolysis . Drug Testing and Analysis. 2016-01-01: n/a–n/a [2017-11-25 ] . ISSN 1942-7611 doi:10.1002/dta.1998 存档 于2017-12-01) (英语) . ^ Watanabe K, Yamaori S, Funahashi T, Kimura T, Yamamoto I. Cytochrome P450 enzymes involved in the metabolism of tetrahydrocannabinols and cannabinol by human hepatic microsomes. Life Science. March 2007, 80 (15): 1415–9. PMID 17303175 doi:10.1016/j.lfs.2006.12.032 ^ Huestis MA. Pharmacokinetics and metabolism of the plant cannabinoids, Δ9 -tetrahydrocannabinol, cannabidiol and cannabinol. Handb Exp Pharmacol. 2005, 168 (168): 657–90. PMID 16596792 doi:10.1007/3-540-26573-2_23
主要娛樂性
用藥文化
製藥與交易
用藥議題 用藥合法性
依各國
迷幻药物 5-HT2A R 激動劑
麦角酰胺类 苯乙胺衍生物
哌嗪 色胺
1-甲基-5-甲氧基二异丙基色胺 2,N,N-三甲基色胺 4,5-DHP-AMT 4,5-DHP-DMT 4-AcO-DALT 4-AcO-DET 4-AcO-DiPT 4-AcO-DMT 4-Acetoxy-DPT 4-AcO-MiPT 4-HO-5-MeO-DMT 4-羟基-N,N-二丁基色胺 4-羟基-N,N-二丙基色胺 4-羟基-N-甲基-N-乙基色胺 4-HO-MPMI 4-羟基-N-甲基-N-丙基色胺 4,N,N-三甲基色胺 4-PrO-DMT 5,6-diBr-DMT 5-AcO-DMT 5-溴-N,N-二甲基色胺 5-Me-MIPT 5-MeO-2,N ,N -TMT 5-MeO-4,N ,N -TMT 5-MeO-α,N,N-TMT 5-MeO-α-ET 5-MeO-α-MT 5-MeO-DALT 5-MeO-DET 5-甲氧基二异丙基色胺 5-甲氧基二甲基色胺 5-MeO-DPT 5-MeO-EiPT 5-MeO-MET 5-MeO-MiPT 5-MeO-MPMI 5,N,N-TMT 7,N,N-三甲基色胺 α-ET α-MT α,N,N-三甲基色胺 Aeruginascin Baeocystin 蟾毒色胺 DALT DBT DCPT DET DIPT DMT DPT EiPT 4-羟二乙基色胺 4-磷酸二乙基色胺 4-羟二异丙基色胺 MET Miprocin MiPT Norbaeocystin PiPT 脱磷酸裸盖菇素 裸盖菇素 其它藥物
解离性药物 NMDAR 拮抗劑
致谵妄药 mAChR 拮抗劑 其它相關藥物
中华人民共和国《
精神药品 品种目录》(2013年版)
第一类 第二类