|
Fluoruro di tionile
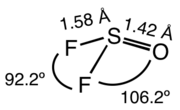
Il fluoruro di tionile o difluoruro di tionile è il composto inorganico con formula SOF2. In condizioni normali è un gas incolore di odore soffocante.[1] In questo composto lo zolfo ha stato di ossidazione +4. StrutturaSOF2 è un composto molecolare, gassoso a temperatura ambiente. La forma della molecola è quella di una di piramide distorta, con simmetria Cs.[4] Le distanze S-O e S-F sono rispettivamente 142,0 pm e 158,3 pm; gli angoli O-S-F e F-S-F sono rispettivamente 106,2° and 92,8°. I corrispondenti alogenuri SOCl2 e SOBr2 hanno strutture simili, ma sono liquidi a temperatura ambiente. Sono noti anche alogenuri misti, tipo SOClF e SOBrF.[2] SintesiIl fluoruro di tionile fu ottenuto per la prima volta nel 1896 da Maurice Meslans (1862-1938), allievo di Henri Moissan, trattando cloruro di tionile con fluoruro di zinco.[5] In seguito furono usate altre fonti di ioni fluoruro, come il fluoruro di idrogeno[1] o il trifluoruro di antimonio:[2][6] Alternativamente si può fluorurare il diossido di zolfo con pentafluoruro di fosforo:[2] ReattivitàSOF2 è un gas termicamente stabile fino al calor rosso. Al di sotto di 125 ºC non attacca né il vetro né i metalli ferro, nichel, cobalto, mercurio, magnesio alluminio e zinco.[1] A contatto con acqua si idrolizza formando diossido di zolfo e acido fluoridrico:[2] Reagisce con il fluoro per formare tetrafluoruro di tionile:[2] Chimicamente SOF2 si comporta come una base di Lewis debole, tramite il doppietto non condiviso sull'ossigeno, e anche come acido di Lewis debole, legandosi tramite lo zolfo; in questo senso reagisce con ioni F− formando l'anione [O=SF3]–.[2] NoteBibliografia
Voci correlateAltri progetti
|
||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia