|
Fluorofosgene
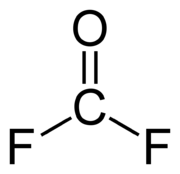
Il fluorofosgene o fluoruro di carbonile, di formula COF2, è un gas incolore, igroscopico, estremamente aggressivo, tossico, e dotato di odore pungente.[1] Fa parte degli ossoalogenuri del carbonio,[2] dove il C è nel suo massimo stato di ossidazione (+4), ed è il composto analogo del fosgene, con il fluoro (più elettronegativo) al posto del cloro. È un composto molto stabile termodinamicamente (ΔHƒ° = -638, kJ/mol),[3] ma anche molto reattivo: con l'acqua, ma anche solo con l'umidità dell'aria in fase gassosa,[4] si idrolizza rapidamente dando alla fine anidride carbonica e acido fluoridrico.[5]
Struttura molecolare e proprietà
La molecola del fluorofosgene è qualitativamente molto simile a quella del fosgene: è planare trigonale, con il carbonio centrale ibridato sp2, ma la simmetria molecolare è C2v soltanto (non D3h, come nelle specie isoelettroniche BF3 o lo ione carbonato CO32–):[6] oltre al fatto che i tre atomi attorno all'atomo centrale non sono uguali, anche gli angoli differiscono dal valore normale di 120°. Pur essendo qui l'atomo di carbonio legato ad atomi molto elettronegativi, la molecola non è molto polare (μ = 0,95 D), perché i momenti di dipolo dei legami, che sono diretti verso i vertici di un triangolo, tendono a sottrarsi nella loro somma vettoriale.
La molecola del fluoruro di carbonile può considerarsi un ibrido di risonanza tra le tre forme limite seguenti, anche se ciascuna delle ultime due (uguali fra loro) contribuisce molto limitatamente alla struttura della molecola reale, perché contiene una separazione di carica di tipo sfavorevole:[7][8]
- [ F2C=O ←→ +F=C(–F)–O– ←→ F–C(–O–)=F+ ]
Da indagini combinate di diffrazione elettronica e spettroscopia rotazionale nella regione delle microonde si sono potuti trovare i parametri strutturali seguenti:[9]
- r(C=O)) = 117,17 pm; r(C–F) = 131,57 pm
- ∠(FCF) = 107,71°; ∠(FCO) = 126,15°
Il legame C=O in COF2 è significativamente più corto rispetto a quello nell'acetone (121,5 pm[10]) e nella formaldeide (120,78 pm[11]), ed è appena inferiore rispetto a quello in COCl2 (117,7 pm[12]), molecola isoelettronica di valenza. Anche il legame C–F è un po' più corto del normale, cioè 135 pm per C(sp3)-F(sp3),[13] ma non tanto, considerando l'ibridazione sp2 del carbonio che tende a far accorciare il legame.
L'angolo FCF è molto più stretto rispetto al valore atteso di 120° per l'ibridazione sp2 dell'atomo centrale. Due fattori operanti nello stesso senso concorrono a questo risultato: teoria VSEPR,[14][15] che prevede che un doppio legame occupi più spazio angolare rispetto ad un legame semplice (quindi ∠(FCF) < ∠(FCO)) e la regola di Bent,[16][17] che prevede l'uso, da parte di un atomo (qui C) che si lega ad uno più elettronegativo di un altro (qui F rispetto a O), di un orbitale ibrido avente minor carattere s dell'altro, il che comporta quindi un restringimento dell'angolo tra legami con il fluoro (FCF) rispetto al valore teorico di 120° e il conseguente allargamento degli altri due (FCO), come qui si osserva.
Un andamento analogo per l'angolo XCX si osserva in COCl2 (111,91°[12]) e anche nell'1,2-difluoroetene H2C=CF2, dove l'angolo FCF è ancora un po' più stretto (109,1°);[18] anche nel fluoruro di metilene CH2F2, senza doppi legami, l'angolo FCF (108,49°) è leggermente più piccolo del valore teorico di 109,5°.[19]
Chimica ionica in fase gassosa
La molecola CF2O ha un'energia di ionizzazione pari a 13,04 eV,[20] significativamente maggiore di quella di COCl2 (~11,2 eV).[21]
L'affinità protonica del fluoruro di carbonile, che è una misura della sua basicità intrinseca, è pari a 666,7 kJ/mol:[22]
- F2C=O (g) + H+ (g) → [ F2C=O+–H ←→ F2C+–O–H ←→ +F=CF–O–H[23] ] (g)
Come si può vedere, questo valore dell'affinità protonica è intermedio tra quelli dell'acqua (691 kJ/mol[24]) o dell'aldeide formica (712,9 kJ/mol[22]), che sono più basiche, e quelli dell'anidride carbonica (540,5 kJ/mol) o del tetrafluoruro di carbonio (529,3 kJ/mol[25]), che sono meno basici.[26]
Secondo dei calcoli quantomeccanici, nello ione molecolare che così si produce (F2C=O · H+) il protone si unisce all'atomo di ossigeno,[27] generando così una struttura stabilizzata per risonanza con quattro forme limite.
Il fluoruro di carbonile in fase gassosa può comportarsi da acido di Lewis nei confronti di anioni alogenuro e pseudoalogenuro:[28]
- F2C=O (g) + F – (g) → [F3C–O –] (g) ΔH° = -178 kJ/mol
- F2C=O (g) + Cl – (g) → [F2ClC–O –] (g) ΔH° = -52,3 kJ/mol
- F2C=O (g) + C≡N – (g) → [F2(N≡C)C–O –] (g) ΔH° = -98,3 kJ/mol
Produzione ed utilizzi
Industrialmente, il fluorofosgene viene prodotto facendo reagire in un reattore non catalitico il fluoro e il monossido di carbonio. La reazione di sintesi consta in una combustione del monossido di carbonio in cui l'ossigeno è sostituito, come comburente, dal fluoro[29].

La reazione è di tipo radicalico, veloce ed estremamente esotermica, ovvero avviene con sviluppo di calore (530 kJ/mol)[30].
Il reattore più comune per la sintesi del fluorofosgene è costituito da un bruciatore non premiscelato che produce una fiamma che si sviluppa in uno scambiatore di calore.
Per evitare il surriscaldamento dell'impianto, lo scambiatore di calore e il bruciatore devono essere raffreddati continuamente per allontanare il calore che viene prodotto dalla reazione.
In caso di perdita del controllo termico del reattore si può verificare un successivo step di combustione con la formazione di tetrafluorometano e ossigeno.

L'eccessiva temperatura nella camera di combustione può portare, oltre che alla formazione di sottoprodotti, ad un precoce invecchiamento delle apparecchiature.
Per risolvere il problema del controllo della temperatura nella sintesi del fluorofosgene è stato messo a punto un reattore di tipo CSTR[31] in cui i gas, prima della reazione, vengono disciolti in un opportuno solvente. La reazione avviene così in fase liquida e il calore di reazione viene asportato per evaporazione del solvente.
Il fluorofosgene viene prodotto in tracce anche nella combustione di polimeri fluorurati ad esempio il PTFE.
Viene usato come agente acilante o come agente fluorurante.
Sicurezza
Il fluorurofosgene è tossico con un limite di esposizione raccomandato di 2 ppm come media ponderata nel tempo di 8 ore e 5 ppm come esposizione a breve termine (15 minuti medi).[32]
Note
- ^ Scheda di sicurezza - Fluoruro di carbonile (PDF), su appvvflecco.it.
- ^ (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, pp. 301-305, ISBN 0-7506-3365-4.
- ^ (EN) Carbonic difluoride, su webbook.nist.gov. URL consultato il 5 agosto 2022.
- ^ (EN) J. S. Francisco, A study of the gas-phase reaction of carbonyl fluoride with water, in Journal of Atmospheric Chemistry, vol. 16, n. 3, 1993-04, pp. 285–292, DOI:10.1007/BF00696901. URL consultato il 5 agosto 2022.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 305, ISBN 0-7506-3365-4.
- ^ CCCBDB list all species by point group, su cccbdb.nist.gov. URL consultato il 23 luglio 2022.
- ^ Viene detta "sfavorevole" perché pone una carica positiva su un atomo più elettronegativo, qui F, e una negativa su un atomo meno elettronegativo, qui O (vedi nota seguente), e similmente accade nella risonanza di BF3.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 151-159.
- ^ (EN) Munetaka Nakata, Kunio Kohata e Tsutomu Fukuyama, Molecular structure of carbonyl fluoride as studied by gas electron diffraction and microwave data, in Journal of Molecular Structure, vol. 68, 1º novembre 1980, pp. 271–280, DOI:10.1016/0022-2860(80)80278-X. URL consultato il 23 luglio 2022.
- ^ (EN) J. D. Swalen e C. C. Costain, Internal Rotation in Molecules with Two Internal Rotors: Microwave Spectrum of Acetone, in The Journal of Chemical Physics, vol. 31, n. 6, 1959-12, pp. 1562–1574, DOI:10.1063/1.1730653. URL consultato il 23 luglio 2022.
- ^ (EN) Kojiro Takagi e Takeshi Oka, Millimeter Wave Spectrum of Formaldehyde, in Journal of the Physical Society of Japan, vol. 18, n. 8, 1963-08, pp. 1174–1180, DOI:10.1143/JPSJ.18.1174. URL consultato l'8 giugno 2022.
- ^ a b CCCBDB listing of experimental data page 2, su cccbdb.nist.gov. URL consultato il 23 luglio 2022.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ G. L. Miessler e D. A. Tarr, Inorganic Chemistry, 2nd, Prentice-Hall, 1999, pp. 54–62, ISBN 978-0-13-841891-5.
- ^ J.E. Huheey, E.A. Keiter e R.L. Keiter, 6 - La struttura e la reattività delle molecole, in Chimica Inorganica, Seconda edizione italiana, sulla quarta edizione inglese, Piccin Nuova Libraria, Padova, 1999, pp. 209-223, ISBN 88-299-1470-3.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. 231-236, ISBN 88-299-1470-3.
- ^ A. F. Holleman, E. Wiberg e N. Wiberg, Anorganische Chemie, 103ª ed., De Gruyter, 2016, pp. 398-399, ISBN 978-3-11-026932-1.
- ^ Victor W. Laurie e Dallas T. Pence, Microwave Spectra and Structures of Difluoroethylenes, in The Journal of Chemical Physics, vol. 38, n. 11, 1º giugno 1963, pp. 2693–2697, DOI:10.1063/1.1733575. URL consultato il 22 luglio 2022.
- ^ (EN) Eizi Hirota, Anharmonic potential function and equilibrium structure of methylene fluoride, in Journal of Molecular Spectroscopy, vol. 71, n. 1-3, 1978-06, pp. 145–159, DOI:10.1016/0022-2852(78)90079-6. URL consultato il 30 giugno 2022.
- ^ (EN) Carbonic difluoride, su webbook.nist.gov. URL consultato il 31 luglio 2022.
- ^ (EN) Phosgene, su webbook.nist.gov. URL consultato il 31 luglio 2022.
- ^ a b (EN) Edward P. L. Hunter e Sharon G. Lias, Evaluated Gas Phase Basicities and Proton Affinities of Molecules: An Update, in Journal of Physical and Chemical Reference Data, vol. 27, n. 3, 1998-05, pp. 413–656, DOI:10.1063/1.556018. URL consultato il 30 giugno 2022.
- ^ Quest'ultima forma limite è duplice: entrambi i fluori possono fare il doppio legame assumendo la carica positiva formale.
- ^ (EN) Water, su webbook.nist.gov. URL consultato il 31 luglio 2022.
- ^ (EN) Tetrafluoromethane, su webbook.nist.gov. URL consultato il 3 agosto 2022.
- ^ (EN) Carbon dioxide, su webbook.nist.gov. URL consultato il 31 luglio 2022.
- ^ (EN) Janet E. Del Bene e Anthony Vaccaro, A molecular orbital study of protonation substituted carbonyl compounds, in Journal of the American Chemical Society, vol. 98, n. 24, 1976-11, pp. 7526–7532, DOI:10.1021/ja00440a013. URL consultato il 31 luglio 2022.
- ^ (EN) Carbonic difluoride, su webbook.nist.gov. URL consultato il 31 luglio 2022.
- ^ Georg Brauer, Handbook of preparative inorganic chemistry, 1963
- ^ F.Mubarakshevich Mukkametshin; Hypofluorites and their Application in organic synthesis
- ^ Mitsui et al., Method for producing carbonyl fluoride, 2008, US 7371899 B2
- ^ Carbonyl Fluoride, in NIOSH Pocket Guide to Chemical Hazards, CDC Centers for Disease Control and Prevention. URL consultato il 10 settembre 2013.
Voci correlate
Altri progetti
 Portale Chimica Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia |
|