|
Tionil klorida
Tionil klorida adalah suatu senyawa anorganik dengan rumus kimia SOCl2. Cairan ini sangat mudah menguap dan berbau tidak sedap. Tionil klorida terutama digunakan sebagai pereaksi klorinasi, dengan sekitar 45,000 ton per tahun diproduksi pada awal tahun 1990an.[5] Senyawa ini beracun dan akan bereaksi keras dengan air untuk menghasilkan gas beracun, juga terdaftar sebagai senyawa Schedule 3 karena dapat digunakan untuk produksi senjata kimia. Banyak yang tidak dapat membedakan antara tionil klorida dengan sulfuril klorida, SO2Cl2, namun sifat senyawa ini berbeda secara signifikan. Sulfuril klorida adalah sumber klor sedangkan tionil klorida merupakan sumber ion klorida. ProduksiSintesis utama senyawa ini dalam industri melibatkan reaksi belerang trioksida dan belerang diklorida:[6]
Metode lainnya termasuk sintesis dari fosfor pentaklorida, klorin dan belerang diklorida, atau fosgen:
Yang pertama dari empat reaksi di atas juga memberi fosfor oksiklorida (fosforil klorida), yang menyerupai tionil klorida dalam banyak reaksinya. Sifat dan struktur SOCl2 mengadopsi geometri molekul piramidal dengan simetri molekul Cs Geometri ini dikaitkan dengan efek dari pasangan elektron sunyi di pusat belerang(IV). Dalam keadaan padat SOCl2 membentuk kristal monoklinik dengan grup ruang P21/c.[7] KestabilanTionil klorida Memiliki umur simpan yang panjang, namun sampel "tua" mengembangkan rona berwarna kuning, mungkin karena pembentukan disulfur diklorida. Senyawa ini perlahan terdekomposisi menjadi S2Cl2, SO2 dan Cl2 pada sedikit di atas titik didih.[6][8] Tionil klorida rentan terhadap fotolisis, yang terutama berlanjut melalui mekanisme radikal.[9] Sampel yang menunjukkan tanda-tanda penuaan dapat dimurnikan dengan distilasi di bawah tekanan rendah, untuk memberi cairan yang tidak berwarna.[10] ReaksiTionil klorida terutama digunakan dalam produksi industri senyawa organoklorin, yang sering kali merupakan zat antara obat-obatan dan agrikultur. Biasanya lebih disukai daripada pereaksi lainnya, seperti fosfor pentaklorida, sebagai produk sampingannya (HCl dan SO2) adalah gas, yang menyederhanakan pemurnian produk. Banyak produk tionil klorida sendiri sangat reaktif dan karena itu melibatkan berbagai reaksi. Dengan spesi oksigenTionil klorida bereaksi dengan air untuk membentuk sulfur dioksida dan asam klorida. Proses ini sangat eksotermik.
Secara klasik, ia mengubah asam karboksilat menjadi asil klorida.[11][12][13]
Dengan proses yang sama, juga mengubah alkohol menjadi alkil klorida. Jika alkoholnya kiral, reaksi tersebut umumnya berlanjut melalui mekanisme SNi dengan mempertahankan stereokimia;[14] namun, tergantung pada kondisi pasti yang digunakan, stereo-inversi juga dapat dicapai. Secara historis penggunaan SOCl2 dalam kombinasi dengan amina tersier seperti piridin disebut halogenasi Darzens namun nama ini jarang digunakan oleh ahli kimia modern.  Reaksi dengan kelebihan alkohol menghasilkan ester sulfit, yang dapat menjadi pereaksi metilasi, alkilasi dan hidroksialkilasi yang kuat.[15]
Contohnya, penambahan SOCl2 pada asam amino dalam metanol secara selektif menghasilkan metil ester yang sesuai.[16] Dengan spesi nitrogenDengan amina primer, thionil klorida memberikan turunan sulfinamina (RNSO), satu contohnya adalah N-sulfinilanilin. Tionil klorida bereaksi dengan senyawa utama formamida untuk membentuk isosianida[17] dan dengan formamida sekunder untuk menghasilkan ion kloroiminium; Seperti reaksi dengan dimetilformamida akan membentuk pereaksi Vilsmeier.[18] Dengan proses analog primer amida akan bereaksi dengan tionil klorida untuk membentuk imidoil klorida, dengan amida sekunder juga memberi ion kloroiminium. Spesi ini sangat reaktif dan dapat digunakan untuk mengkatalisis konversi asam karboksilat menjadi asil klorida, mereka juga dieksploitasi dalam reaksi Bischler–Napieralski sebagai alat untuk membentuk isokuinolin. 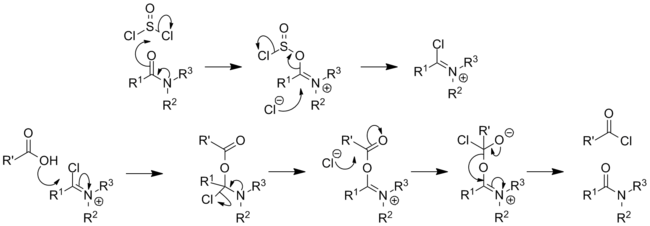 Amida primer akan terus terbentuk nitril jika dipanaskan (degradasi amida Von Braun).[19] Tionil klorida juga telah digunakan untuk mempromosikan penataan ulang Beckmann dari oksima. KeamananSOCl2 aalah senyawa reaktif yang dapat dengan keras dan/atau secara eksplosif melepaskan gas berbahaya pada kontak dengan air dan pereaksi lainnya. Tionil klorida dikontrol di bawah Konvensi Senjata Kimia, di mana tercantum di dalamnya Schedule 3. Tionil klorida digunakan dalam metode "di-di" untuk memproduksi agen saraf seri-G. Lihat pulaReferensi
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia





