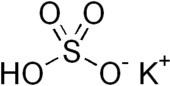Бісульфат калію
Кульково-стрижнева модель складових іонів
Кристали бісульфату калію на фільтрувальному папері
Назва за IUPAC
Гідросульфат калію
Ідентифікатори
Номер CAS
7646-93-7 PubChem
516920 Номер EINECS
231-594-1 RTECS
TS7200000 SMILES
OS(=O)(=O)[O-].[K+] InChI
1/K.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+1;/p-1
Властивості
Молекулярна формула
KHSO4
Молярна маса
136.169 г/моль
Зовнішній вигляд
безбарвна тверда речовина
Запах
без запаху
Густина
2.245 г/см3
Тпл
197°C (470 K)
Розчинність (вода )
36.6 г/100 мл (0°C)
Розчинність
розчинний в ацетоні , етанолі .
Термохімія
Ст. ентальпія Δf H o 298 -1163.3 кДж/моль
Небезпеки
ЛД50
2340 мг*кг−1
ГГС піктограми
ГГС формулювання небезпек
314 , 335
ГГС запобіжних заходів
260 , 261 , 264 , 271 , 280 , 301+330+331 , 303+361+353 , 304+340 , 305+351+338 , 310 , 312 , 321 , 363 , 403+233 , 405 , 501
Пов'язані речовини
Пов'язані речовини
Сульфат калію Гідросульфат натрію
Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа)
Інструкція з використання шаблону
Примітки картки
Бісульфат калію або гідросульфат калію — неорганічна сполука з хімічною формулою KHSO4 , яка є калієвою кислою сіллю сульфатної кислоти . Це біла водорозчинна тверда речовина.
У 1985 році на початковому етапі Мангеймського процесу (інші мови) виробництва сульфату калію було вироблено понад 1 млн. тонн. Відповідним перетворенням є екзотермічна реакція хлориду калію та сірчаної кислоти:[ 1] [ 2]
KCl + H2 SO4 → HCl + KHSO4 Бісульфат калію є побічним продуктом у виробництві азотної кислоти з нітрату калію та сірчаної кислоти:[ 3]
KNO3 + H2 SO4 → KHSO4 + HNO3
При термічному розкладанні бісульфату калію утворюється піросульфат калію :[ 1]
2 KHSO4 → K2 S2 O7 + H2 O Вище 600 °C піросульфат калію перетворюється на сульфат калію та триоксид сірки :[ 4]
K2 S2 O7 → K2 SO4 + SO3
Бісульфат калію зазвичай використовується для приготування гідротартрату калію для виноробства .[ 5] аналітичній хімії або як прекурсор для отримання персульфату калію , який є сильним окисником .[ 6]
Меркаліт є мінералогічною формою бісульфату калію, зустрічається вкрай рідко.[ 7] Мізеніт є іншою більш складною формою бісульфату калію з формулою K8 H6 (SO4 )7 .
↑ а б Washington Wiley, Harvey (1895). Principles and Practice of Agricultural Analysis: Fertilizers 218 . Процитовано 31 грудня 2015 . Potassium disulfate. Washington Wiley, Harvey (1895). Principles and Practice of Agricultural Analysis: Fertilizers 218 . Retrieved 31 December 2015 . Potassium disulfate. ↑ . Weinheim. ISBN 978-3-527-30673-2 ↑ Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals ISBN 978-0-07-049439-8 ↑ Iredelle Dillard Hinds, John (1908). Inorganic Chemistry: With the Elements of Physical and Theoretical Chemistry 547 . Процитовано 31 грудня 2015 . Potassium disulfate. ↑ Weisblatt, Jayne; Montney, Charles B. (2006). Chemical Compounds . ISBN 978-1-4144-0453-0 ↑ Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed ISBN 978-0-12-126601-1 ↑ Mercallite: Mineral information, data and localities . mindat.org . Процитовано 8 травня 2019 .