|
Хлораль
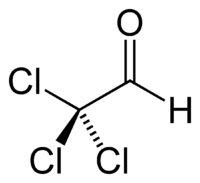
Хлораль (трихлорацетальдегид, трихлоруксусный альдегид) — органическое соединение, принадлежащее к классу альдегидов, соответствующее трихлоруксусной кислоте; бесцветная жидкость со специфическим резким запахом, растворим в органических растворителях и нерастворим в воде. Впервые получен в 1832 г. Юстусом Либихом при хлорировании этанола[1][2]. Реакционная способностьАльдегидная группа хлораля активирована за счёт отрицательного индуктивного эффекта трихлорметильной группы, поэтому карбонильный атом углерода является активным электрофильным центром. Хлораль вступает в реакции нуклеофильного присоединения образуя, в отличие от алифатических альдегидов, реагирующих с отщеплением воды, стабильные и хорошо кристаллизующиеся аддукты: Так, хлораль реагирует с водой с образованием стабильного, в отличие от ацетальдегида, гидратного аддукта — хлоральгидрата: и со спиртами с образованием полуацеталей — хлоральалкоголятов: Так, этилполуацеталь хлоральгидрата образуется при взаимодействии хлораля, образующегося in situ при хлорировании этанола, с избытком этанола в промышленном производстве хлораля. С аммиаком хлораль образует стабильный хлоральаммиак: Реакция с алифатическими аминами при нагревании идёт по типу галоформного расщепления, при этом образуются соответствующий формамид и хлороформ, реакция может использоваться как метод формилирования первичных и вторичных алифатических аминов[3]:
Вследствие высокой электрофильности карбонильного углерода хлораль реагирует на только с аминами, но и с амидами: Хлораль также образует аддукты c фосфорными нуклеофилами, так, он реагирует с трифенилфосфином с образованием фосфониевой соли:
Аналогично хлораль взаимодействует с триалкилфосфитами, образуя винилфосфаты (реакция Перкова):
С гидрофосфорильными соединениями хлораль образует аддукты нуклеофильного присоединения по карбонильной группы (реакция Абрамова) в реакцию вступают оксиды вторичных фосфинов:
диалкилфосфиты и т. п., взаимодействие диметилфосфита и хлораля является промышленным методом синтеза инсектицида хлорофоса: При 100 °C хлораль гидролизуется водой с образованием глиоксиловой кислоты: Под действием щелочей хлораль (подобно другим трихлорметилкарбонильным соединениям) претерпевает галоформное расщепление с образованием хлороформа и формиата: Хлораль в жёстких условиях (температуры выше 100 °C или при облучении ультрафиолетом) хлорируется, образуя четырёххлористый углерод, окись углерода и хлороводород, окисляется концентрированной азотной кислотой до трихлоруксусной кислоты и восстанавливается (например, этилатом алюминия[4]) до трихлорэтанола: СинтезИсторически первым методом синтеза хлораля было хлорирование этанола: этот метод, благодаря доступности и дешевизне реагентов, остаётся основным лабораторным и промышленным методом синтеза. Хлораль также может быть синтезирован хлорированием этиленхлоргидрина, ацетальдегида или смеси диэтилового эфира с водой при 25-90 °С, а также каталитическим синтезом из четырёххлористого углерода и формальдегида при пропускании их паров над тонко раздробленными металлами (Сu) при 300 °С. В промышленности хлораль синтезируют хлорированием этилового спирта. Технологически непрерывный процесс хлорирования проводится в каскаде из двух реакторов — барботажных колонн с противотоком газа и жидкости. В первую колонну, охлаждаемую до 55—65 °C, подаются этанол и смесь хлора с хлороводородом, поступающая из второй колонны. Реакционная смесь из первой колонны, содержащая смесь хлорацетальдегидов, их ацеталей и полуацеталей, подаётся во вторую колонну, работающую при 90 °C, куда также подают хлор и воду, необходимую для гидролиза промежуточных продуктов хлорирования — этилацеталей для увеличения степени конверсии этанола. Продукт, получаемый во второй колонне и представляющий собой смесь хлоральгидрата, полуацеталей хлораля и дихлорацетальдегида с примесью HCl, обрабатывают концентрированной серной кислотой, разрушающей хлоральгидрат и ацетали с высвобождением свободного хлораля и дихлорацетальдегида, органический слой отделяют, перегоняют и ректифицируют, возвращая дихлорацетальдегид на хлорирование[5]. Применение Хлораль используют в производстве инсектицидов, в частности в производстве ДДТ конденсацией с хлорбензолом, хлорофоса конденсацией с диметилфосфитом и, далее, дихлофоса дегидрохлорированием хлорофоса. Хлоральгидрат обладает снотворным и седативным действием и входит в список препаратов Всемирной организации здравоохранения, использующихся при анестезии[6]. См. такжеПримечания
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||