|
Ioduro rameoso
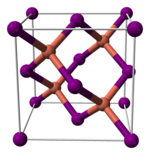
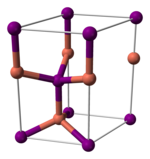
Lo ioduro rameoso o ioduro di rame(I) è un composto chimico inorganico con formula minima CuI. Polvere di colore bianco insolubile in acqua che diventa gialla con la calcinazione e viene poco decomposta dall'idrogeno gassoso se scaldato fino al calor rosso. Mischiato con l'ossido ferrico, manganico o rameico ed esponendo il miscuglio al calor rosso si libera iodio e si ottiene ossido rameoso.[2] In natura si trova in minerali come la marshite, dove il colore bruno-rossastro è dovuto alle impurità. Come molti composti contenenti ioduro, data la facile ossidazione aerobica dello ioduro a iodio, spesso può presentare colorazioni leggermente brunastre. Utilizzato in una varietà di applicazioni che vanno dalla sintesi organica alla semina delle nubi. StrutturaLo ioduro di rame(I) è un polimero inorganico. Ha un ricco schema di fase in cui esistono parecchie forme cristalline. Adotta la struttura della blenda dello zinco (Sfalerite) per temperature inferiori a 390 °C (ɣ-CuI), alla struttura della Wurtzite fra 390 e 440 °C (β-CuI) ed alla forma cubica semplice per temperature superiori ai 440 °C (α-CuI). Nelle prime due forme gli ioni sono coordinati tetraedricamente, con una distanza Cu-I di 2 338 Å. Il bromuro di rame(I) ed il cloruro di rame(I), le cui distanze interatomiche fra alogeno e rame(I) sono 2 051 e 2 173 Å, si trasformano dalla struttura ɣ alla struttura β a 405 e 435 °C, rispettivamente. Di conseguenza più lungo è il legame più basso è la temperatura per il cambio di struttura.[3]
SintesiIn laboratorio lo ioduro rameoso è preparato da soluzioni acquose di uno ioduro alcalino e di un sale di rame solubile. dove lo ioduro rameico CuI2, instabile, immediatamente si decompone a iodio ed a ioduro rameoso[4] Questa reazione può essere impiegata per analizzare campioni contenenti il rame(II), poiché lo iodio sviluppato può essere analizzato tramite la titolazione redox. Strati sottilissimi di rame se esposti a vapori di iodio formano film di CuI con centri catodoluminescenti.[5] CuI è poco solubile in acqua (0.00042 g/l a 25 °C), ma si dissolve in presenza di NaI o di KI per dare l'anione lineare [CuI2]−. La diluizione di tali soluzioni con acqua precipita di nuovo CuI. Questo processo di dissoluzione-precipitazione è impiegato per purificare CuI, rendendo il campione sempre più bianco.[6] Usi
Note
Altri progetti
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia