|
Кетони
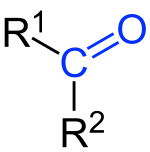 Кетонами називаються сполуки, в молекулах яких міститься група атомів >С = О, пов'язана з двома вуглеводневими радикалами. Карбонільна група >С = О присутня в молекулах альдегідів, що зумовлює схожість хімічних властивостей альдегідів і кетонів. Проте схожість не є повною, оскільки в молекулах альдегідів один із зв'язків карбонільною групою витрачається на з'єднання з воднем, а в молекулах кетону обидва зв'язки йдуть на з'єднання з вуглеводневими радикалами. Це позначається, зокрема, на тому, що кетони окиснюються значно важче, ніж альдегіди, і не є такими енергійними відновниками, як альдегіди. У практичному плані найважливішим з кетонів є диметилкетон, або ацетон. Представники
РеакціїПо карбонілуКетони беруть участь у багатьох органічних реакціях. Наважливіші реакції - нуклеофільне приєднання до карбонільного атома вуглецю, наприклад:
R2C=O + AlkMgCl --> R2AlkCOH .
Кетонам властива кето-енольна тавтомерія. Зазвичай, кетонна форма набагато стабільніша, але існують винятки. За іншими позиціями
Див. такожДжерела
Посилання
|
