|
Пероксиди Перокси́ди (рос. пере́киси, англ. peróxides) — хімічні сполуки, що містять пероксидну групу . В органічних пероксидах група з'єднана ковалентним зв'язком з хоча б одним атомом вуглецю. Неорганічні пероксиди здебільшого тверді солеподібні з іонним типом зв'язку. Дуже активні сполуки, легко розкладаються, є сильними окисниками. Багато органічних пероксидів є вибухонебезпечними. Історія відкриттяОдин із перших синтетичних пероксидів, пероксид барію, був синтезований в 1799 році Александром фон Гумбольтом в результаті спроби розділення повітря. Через 19 років Луї Жак Тенар дослідив цю сполуку та визначив, що вона може бути використана для синтезу іншої, ще невідомої сполуки, яку він назвав "окиснена вода" — наразі відома як перекис водню.[1] Неорганічні пероксиди Група неорганічних пероксидів поділяється на іонні солі пероксид-іонів та неорганічні пероксиди, що мають ковалентно пов'язані пероксидні групи. До першого класу відносяться пероксиди лужних і лужноземельних металів. Найвизначнішим представником другого класу є ковалентний перекис водню; однак, важливе значення мають також деякі пероксиди мінеральних кислот, таких як кислота Каро та пероксокарбонатна кислота. На відміну від іонного характеру пероксидів лужних металів, пероксиди перехідних металів мають більш ковалентний характер, що пояснюється їх більшою електронегативністю.[2] ОтриманняІонні пероксидиПероксиди лужних металів, за винятком пероксиду літію, можна отримати безпосередньо шляхом окиснення цих металів киснем при нормальному тиску:[2]
Пероксид літію можна отримати шляхом взаємодії гідроксиду літію з перекисом водню:[2]
Пероксид барію, який історично використовувався для отримання перекису водню, може бути отриманий шляхом окиснення оксиду барію при підвищеній температурі та тиску:[3]
Ковалентні пероксиди Найпоширенішим методом синтезу перекису водню є антрахіноновий процес. Антрахінон спочатку відновлюєтьсядо антрагідрохінону за допомогою водню у присутності паладієвого каталізатору. Далі, окиснення киснем призводить до утворення перекису водню та антрахінону.[3] Таким чином, загальне рівняння реакції має вигляд:
Прямий синтез перекису водню з елементів на сьогодні неможливий в промислових масштабах.[3] Мінеральні надкислоти (наприклад, пероксодісульфати[4] та пероксокарбонати[5]) можуть бути синтезовані шляхом анодного окислення відповідних кислот:
Пероксодісульфатна кислота історично використовувалась для отримання перекису водню на початку XX століття:[3][6]
ВикористанняПероксиди є сильними окисниками і їх можна використовувати для окиснення інших сполук. Пероксиди лужних металів можуть бути використані для синтезу органічних пероксидів, наприклад бензоїлпероксиду.[7]  Неорганічні пероксиди використовуються як відбілюючі речовини в текстильній та паперовій промисловості,[3] чим значною мірою замінили старіший підхід, заснований на відбілювальній дії хлоровмісних сполук.[6] В домашньому господарстві пероксиди загалом зустрічаються в засобах для прання.[8] У минулому для цього використовували перборати, але їх значною мірою витіснили перкарбонати через збільшення концентрації бору в навколишньому середовищі. Пероксовмісні засоби можуть мати відповідні торгові найменування; наприклад, "Persil" походить від слів Perborate і Silicate. Реакція з вуглекислим газом може вивільняти кисень з деяких пероксидних солей з утворенням карбонатів. Це використовується в генераторах кисню в дихальних апаратах, підводних човнах або космічних апаратах.
Для цього в більшості випадків використовують пероксид натрію, але, наприклад, в космічних апаратах віддається перевага пероксиду літію, оскільки він має меншу молярну масу і тому здатний виробляти більший об'єм кисню на одиницю ваги.[3] Пероксид барію історично використовувався для отримання чистого кисню з повітря. Для цього використовували залежну від температури рівновагу між оксидом та пероксидом барію. Спочатку пероксид утворювався при нагріванні оксиду барію на повітрі до 500 °С. При температурі вище 700 °C та відсутності кисню пероксид знов розпадався на оксид та кисень:[3]
Органічні пероксидиОрганічні пероксиди — це органічні сполуки, похідні пероксиду водню, де щонайменш один атом водню заміщений органічним фрагментом. ВластивостіВ залежності від структури органічних замісників, органічні пероксиди можна поділити на декілька класів:[8]
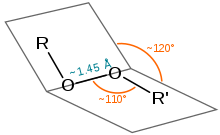 Довжина зв'язку в пероксидах становить близько 1,45 Å, кути (R = H, C) становлять приблизно 110° (подібні до води), а двогранні кути (R = H, C) — приблизно 120°. Енергія дисоціації зв'язку доволі низька – 45-50 ккал·моль−1 (1900–210 кДж·моль−1).[9][10] Відомо, що органічні пероксиди є сильними окисниками, але квантифікувати їхні окисно-відновні властивості дуже важко: циклічна вольтаметрія, що зазвичай застосовується для визначення редокс-потенціалу, у випадку пероксидів результує незворотні цикловольтамограми, аналіз яких потребує детального вивчення механізму відновлення конкретного пероксиду, а також дослідження впливу варіації умов (у першу чергу, pH).[11] Наразі точно встановленим є редокс-потенціал надоцтової кислоти — 1,762 В проти Ag/AgCl (NaCl нас.),[11] або 1,960 В проти водневого електроду.[12] Для порівняння, редокс-потенціал пероксиду водню — 1,776 В проти водневого електроду;[13] тобто, надоцтова кислота має бути сильнішим окисником, аніж пероксид водню. Пероксикарбонові кислоти є, як правило, слабкішими кислотами, аніж відповідні карбонові кислоти.[14] ОтриманняДіалкілпероксиди можуть бути отримані в результаті реакції між діалкілсульфатом та лужним перекисом водню:[15]
Цей спосіб також може давати циклічні пероксиди.[16] Чотиричленні діоксетани можуть бути отримані шляхом [2+2]-циклоприєднання кисню до алкенів.[14] Цільовий синтез гідропероксидів може здійснюватися радикальним окисленням алканів киснем. Первинний радикал, утворений радикальним ініціатором, реагує з киснем, утворюючи гідропероксильний радикал. Останній здатен відщеплювати атоми водню від іншої молекули алкану, що продовжує радикальний ланцюг:[14]  Така реакція використовується в промислових масштабах, наприклад, в куменовому методі.[17] Подібна радикальна реакція, спонукована атмосферним киснем, також може повільно відбуватись у речовинах, що можуть утворювати стійкі радикали. Наприклад, це призводить до самоокислення розчинників з групи простих ефірів, таких як діетиловий ефір, діізопропілового, тетрагідрофуран або 1,4-діоксан. Продуктами є гідропероксиди простих ефірів, які можуть стати причиною сильних вибухів при нагріванні або концентруванні.[14]  Пероксиди можуть утворюватися в організмах в результаті енової реакції (конкретніше, енової реакції Шенка (англ. Schenk ene reaction) або реакції Дільса-Альдера ненасичених зв'язків із киснем. Субстратами для енової реакції можуть бути ненасичені жирні кислоти, а для циклізації Дільса-Альдера — ненасичені амінокислоти, такі як гістидин.[18] Пероксиди утворюються поряд із спиртами, альдегідами й карбоновими кислотами у процесі згіркнення жирів. Це дозволяє виявити прогірклий жир чи олію за допомогую оцінки пероксидного числа, яке вказує на кількість пероксидів на кілограм речовини.[19] Більшість надкарбонових кислот можна отримати за допомогою реакції перекису водню з відповідною карбоновою кислотою або її хлоридом:
Ароматичні альдегіди можуть вступати в реакцію автоокиснення, утворюючи надкислоти; однак, останні одразу ж реагують із сусідніми молекулами альдегіду й відновлюються до карбонових кислот:
ВикористанняЗв'язок є доволі нестабільним, тому легко розривається, утворюючи вільні радикали . Розщеплення може бути викликане підвищенням температури (термоліз), світловими хвилями (фотоліз) або хімічними реакціями. Таким чином, органічні пероксиди є корисними як ініціатори деяких видів полімеризації. Наприклад, перекис дібензоїлу використовується для полімеризації акрилатів;[20] пероксид метилетилкетону, пероксид бензоїлу та меншою мірою пероксид ацетону використовуються як ініціатори радикальної полімеризації деяких смол, наприклад, поліестеру та силікону; гідропероксид пінану використовується у виробництві синтетичного каучуку. Органічні пероксиди, як і їх неорганічні аналоги, також є потужними відбілюючими засобами.[8] Перекис бензоїлу та перекис водню використовуються як відбілюючі та «дозріваючі» засоби при обробці борошна. Перекис бензоїлу є ефективним місцевим препаратом для лікування більшості форм прищів. Надкислоти широко використовуються для синтезу епоксидів (реакції Прилежаєва)[21] та лактонів з циклічних кетонів (реакція Байєра-Вілліґера).[22] Для цих реакцій часто використовують мета-хлорнадбензойну кислоту (mCPBA). Трет-бутилгідропероксид використовується в якості окисника в реакції енантіоселективного синтезу епоксидів за Шарплессом[en].[23][24] Через вибухонебезпечність, деякі пероксиди використовуються як первинні вибухові речовини. Найвідоміші з них: пероксид ацетону (APEX) та гексаметилентрипероксиддіамін (HMTD).  Роль пероксидів в біологіїПероксиди відіграють важливу роль у біології. Багато пероксидів та гідропероксидів є похідними жирних кислот, стероїдів та терпенів. Біосинтез простагландинів протікає за допомогою ендопероксидів.[25] В пероксисомах еукаріотичних клітин відбувається β-окислення жирних кислот пероксидними інтермедіатами:[26]
Пероксиди також грають роль у процесі біолюмінесценції. У світлячкових окислення люциферинів, яке каталізується люциферазами, дає пероксисполуку 1,2-діоксетан. Діоксетан нестійкий і спонтанно розпадається до вуглекислого газу та збудженого кетону, який повертається до основного електронного стану, випромінюючи світло.[27]   Довідки
|





![{\displaystyle {\ce {2HSO4^{-}->[10^{\circ }C][{-e^{-}}]2H^{+}\ +S2O8^{2}-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/531a5390ff05f1cd7eb7d7f85a7f5694d95fadab)



![103x103пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/75/Hydroperoxide.svg/220px-Hydroperoxide.svg.png)
![149x149пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Peroxide.svg/220px-Peroxide.svg.png)
![140x140пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/bc/Acyl_peroxide.svg/220px-Acyl_peroxide.svg.png)
![101x101пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/60/Peracid.svg/220px-Peracid.svg.png)
![115x115пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/16/Peresters.svg/220px-Peresters.svg.png)
![142x142пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/94/Peroxycarbonates_1.svg/220px-Peroxycarbonates_1.svg.png)
![167x167пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a2/Peroxycarbonates_2.svg/220px-Peroxycarbonates_2.svg.png)
![161x161пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/Peroxyketals.svg/220px-Peroxyketals.svg.png)
![141x141пкс[недоступне посилання]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/77/Ketone_peroxides.svg/220px-Ketone_peroxides.svg.png)








