|
Кремнийорганические соединения Кремнийорганические соединения — органические соединения, в молекулах которых имеется связь между атомами кремния и углерода. Кремнийорганические соединения иногда называют силиконами, от латинского названия кремния «силициум». Применение
Кремнийорганические соединения используются для производства смазок, полимеров, резин, каучуков, кремнийорганических жидкостей и эмульсий. Кремнийорганические соединения применяются в косметике, бытовой химии, лакокрасочных материалах, моющих средствах. Отличительной особенностью продукции на основе кремнийорганических соединений от продукции на основе обычных органических соединений являются, как правило, более высокие эксплуатационные качества и характеристики, а также безопасность применения человеком. Кремнийорганические полимеры могут использоваться для изготовления форм в кулинарии. Полимеризация кремнийорганических компаундов и герметиков безопасна для человека и не требует вытяжки. Классификация
История кремнийорганических соединенияВ 1823 году Берцелиус получил чистый кремний действием металлического калия на тетрафторид кремния, что в свою очередь был получен действием фтороводорода на диоксид кремния.
В том же году Берцелиус синтезировал первый непосредственный прекурсор кремнийорганических соединений, тетрахлорид кремния (SiCl4).
Только через 23 года действием этанола на тетрахлорид кремния было синтезировано первое органическое соединение, содержащее кремний — тетраэтилортосиликат (Si(OEt)4).
Через 17 лет в 1863 году первые кремнийорганические соединения были синтезированы Фриделем и Крафтсом действием алкилцинков на тетрахлорид кремния[1].
Десять последующих лет, применяя очень сложные методы, Фридель и Ладенбург получили ряд новых кремнийорганических соединений действием натрия и этилцинка на тетраэтил ортосиликат: SiEt(OEt)3, SiEt2(OEt)2, SiEt3(OEt), SiEt4 и SiHEt3. В это время были получены также Si2Et6, SiH(OEt)3, а также первые ароматические кремнийорганические соединения, SiPhCl3 и SiPhEt3. В 1885 году Полис реакцией тетрахлоросилана и хлоробензина в присутствии натрия получил тетрафенилсилан, первое кремнийорганическое соединение, которое оставалось твердым при нормальных условиях.
Из тетрафенилсилана с помощью пентахлорида фосфора были получены трифенилхлоросилан и трифенилсиланол. В 1899 году Киппинг начал исследования с целью синтеза кремнийорганических соединений, имеющих хиральный атом кремния. Очень быстро выяснилось, что существует большая разница между органическими веществами и их кремниевыми аналогами. Поэтому в 1904 году он начал исследования реакций тетрахлорида кремния с реактивами Гриньяра. За тридцать лет были найдены методы синтеза алкилов и арилзамещённых силанов и хлоросиланов, и исследованы их свойства. С помощью гидролиза хлоросиланов были получены силанолы и силандиолы. Попытки расширить количество кремнийорганических соединений, и найти им использование не привели к значительным успехам. В 1939 году Киппинг в своей бейкеривской лекции сделал обзор успехов кремнийорганической химии и пришёл к выводу, что «перспектива близкого и важного развития в этой области органической химии не кажется многообещающей»[2].
В 1937 году Андрианов Кузьма Андрианович (1904-1978) советский учёный, специалист в области высокомолекулярной химии, основоположник отечественной кремнийорганической химии, впервые осуществил синтез полиорганосилоксанов. С 1947 года разрабатывает основные принципы синтеза полимеров с неорганическими цепями молекул, в том числе полиорганометаллосилоксанов. Руководил работами по синтезу термостойких кремнийорганических полимеров и материалов на их основе, получивших широкое применение для изоляции электрических машин, аппаратов, производства смазочных веществ, пластических масс, лакокрасочных покрытий и др.В 40-х годах 20-го века началось коммерческое производство кремниевых полимеров, что дало толчок развитию кремнийорганической химии. Распространение в природеСчитается, что соединения, содержащие связь Si-C, отсутствуют в естественных биохимических процессах. Однако сообщается, что у некоторых видов водорослей эти соединения появляются в виде короткоживущих интермедиатов[3]. 2016 Калтеховская группа Фрэнсиса Арнольда методом молекулярной направленной эволюции[англ.]* создала белок, синтезирующий кремнийорганические соединения в бактериях[4][5]. Соединения кремния с насыщенными связямиВ большинстве имеющихся кремнийорганических соединений кремний находится в состоянии sp3-гибридизации, и образует 4 ковалентных связи. Связи Si-H и Si-галогенСвязь Si-H имеет обратную полярность по отношению к связи CH, то есть атом водорода имеет частичный отрицательный заряд (гидридный характер). Энергия диссоциации связи SiH зависит от соседних атомов, и может изменяться в пределах от 384 кДж/моль для SiH4 до 419 кДж/моль для SiHF3. Связь Si-F является самой прочной из известных ковалентных связей. Связи Si-C и Si-SiСвязь Si-C длиннее связи C-C (186 нм и 154 нм соответственно) и слабее её (457 кДж/моль и 607кДж/моль соответственно). Благодаря большей электроотрицательности углерода относительно кремния (2.55 и 1.90 соответственно) эта связь имеет определённую полярность. Это придаёт углероду определённый нуклеофильный характер. Насыщенные связи кремния с другими атомамиСвязь Si-O является гораздо более стабильной чем связь C-O (809кДж/моль и 538 кДж/моль соответственно[источник не указан 1277 дней]). Соединения кремния с ненасыщенными связямиОдним из важнейших отличий кремния от углерода является трудность синтезирования стабильных соединений с двойными или тройными связями, содержащими кремний. До 1967 года считалось, что вообще невозможно создать кратную связь элемента третьего периода и ниже. Связи Si=C, Si=Si, Si≡C и Si≡SiВ 1967 году Гусельников и Флауэрс получили неопровержимое подтверждение формирования короткоживущих веществ, силен содержащих двойную связь Si=C[6]. В 1981 году Адриан Брук получил первый стабильный силен, содержащий связь Si=C. В том же году Роберт Вест получил первый стабильный дисилен, содержащий связь Si=Si. Силены и дисилены является термодинамично нестабильными соединениями благодаря низким энергиям п-связей вследствие плохого перекрытия 3p-орбитали кремния и 2p-орбитали углерода и 3p-орбитали кремния соответственно. Поэтому стабилизация кратной связи достигается благодаря использованию громоздких заместителей (кинетическая стабилизация), или заместителей, содержащих сопряжённые п-системы (термодинамическая стабилизация). Бета-кремниевый эффектСилильная группа, находящаяся в бета-положении относительно карбокатиона, стабилизирует его. Это явление называется бета-кремниевым эффектом. Стабилизация достигается через гиперконъюгацию пустой p-орбитали карбокатиона с сигма-орбиталью связи Si-C. Получение кремнийорганических соединенийВторым важным прекурсором для кремнийорганических соединений, кроме тетрахлоросилана, упомянутого в историческом обзоре, является трихлоросилан, который получают взаимодействием кремния с соляной кислотой.
Дихлоросилан может быть получен диспропорционированием трихлоросилана[7]:
Дихлоросилан можно восстановить силаном до монохлоросилана с помощью каталитического процесса:
Хлоросиланы реагируют со спиртами, образуя алкоксисиланы:
Алкоксисиланы и хлоросиланы реагируют в свою очередь с карбометаличными соединениями (например с реактивами Гриньяра), образуя кремнийорганические соединения:
Другой способ формирования кремнийорганических соединений это понижение кратности двойных и тройных связей углерод-углерод.
Реакции кремнийорганических соединений и применение в органическом синтезеПерегруппировка БрукаПерегруппировка Брука — миграция кремнийорганической группы, при которой разрывается связь Si-C и образуется связь Si-O. Движущей силой реакции является образование особенно термодинамически стабильной связи Si-O. 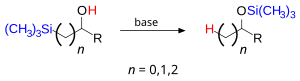 Олефинирование по ПетерсонуОлефинирование по Петерсону является представителем большого класса реакций олефинирования карбонильных соединений. На первом этапе в результате атаки альфа-кремнийкарба ниона 1 в электрофильном атоме углерода карбонильного соединения формируется аддукт 2 (бета-гидроксисилан). На втором этапе реакции от аддукта элиминирует силанолят R3SiO-, что приводит к формированию алкена[8]. Движущей силой реакции является высокая термодинамическая стабильность связи Si-O, которая формируется на втором этапе реакции.  В зависимости от характера замещения альфа-кремнийкарбониона второй этап реакции может быть спонтанным, или, наоборот, потребовать жестких условий. Привлекательной особенностью реакции Петерсона — зависимость её диастереоселективности от условий, в которых проводится второй этап реакции. Таким образом один диастереомер 2 может в кислотных и щёлочных условиях давать два разных E/Z-изомеров, 3a или 3b. Реакция СакураиРеакция Сакураи (также известная как реакция Хосоми — Сакураи) — органическая реакция между электрофильным атомом углерода (например карбонильной группы) с алилсиланом в присутствии сильной кислоты Льюиса, активирующий электрофил.  Окисления Флеминга — Тамао Присоединение гидросиланаРеакция присоединения связи Si-H в связи C = C или связи C≡C, катализируемой комплексами переходных металлов, например H 2 PtCl 6. Общий механизм отражён на рисунке. Присоединение происходит обычно против правила Марковникова[9].  Защитные группыКремниевые эфиры широко используются как защитные группы для алкоголей. Защита обычно происходит реакцией алкоголя с силанхлоридом в щёлочной среде. Устойчивость защитной группы к кислотной или щёлочной среде зависит от алкильных заместителей на атоме кремния. Относительное сопротивление силанных групп в кислой среде:
Относительное сопротивление силанных групп в щёлочной среде:
Снятие защиты происходит обычно с помощью агентов, содержащих фтор, например фтороводорода или TBAF. Силанные еноляты и реакция Мукайамы  Примечания
|

