生化学 (せいかがく、英 : biochemistry )または生物化学 (せいぶつかがく、英 : biological chemistry )は、生体内 および生物に関連する化学的プロセス を研究する学問である[ 1] 化学 と生物学 の下位分野である生化学は、構造生物学 、酵素学 、代謝学 の3つの分野に分けられる。20世紀の最後の数十年間で、生化学はこれらの分野を通じて、生命現象を説明することに成功した。生命科学 のほとんどの分野は、生化学的な方法論と研究によって解明され、発展してきた[ 2] 生体分子 に起こる過程を生み出す化学的基盤を理解することに重点を置いており[ 3] 組織 や器官 、そして生物の構造と機能をより深く理解するのにつなげている[ 4] 分子生物学 とも密接に関係する[ 5]
生化学は、タンパク質 、核酸 、炭水化物 、脂質 などの生体高分子 の構造、結合、機能、そして相互作用に大きく関わっている[ 6] 分子 は、細胞の構造を作り、生命機能の多くの役割を担っている[ 7] 小分子 やイオン の反応にも依存しており、それには、水 や金属 イオンなどの無機物 や、タンパク質合成 のためのアミノ酸 などの有機物 が含まれる[ 8] 化学反応 によって環境からエネルギーを取り出す 機構は、代謝 として知られている。生化学の主な応用分野は、医学 、栄養学 、そして農業 である。医学では生化学者 は病気 の原因や治療法 を[ 9] 栄養不足 の影響を研究している[ 10] 土壌 や肥料 を研究し、作物の栽培、貯蔵、害虫制御 の改善を目標としている。生化学は、プリオン などの複雑な対象を理解する上でも重要である[ 11]
1947年、ゲルティー・コリ とカール・コリ は、RPMIでのコリ回路 の発見により、共同でノーベル賞を受賞した。 生化学を最も広い意味で捉えると、生物の構成要素や組成、それらがどのように組み立てられて生命が作られているかを研究する学問と見なすことができる。この意味で、生化学の起源は古代ギリシャ までさかのぼることができるが、特定の科学分野 (英語版 ) [ 12] カール・ヴィルヘルム・シェーレ が生物から乳酸 (1780年)[ 13] クエン酸 (1784年)[ 14] [ 15] アンセルム・ペイアン が最初の酵素 であるジアスターゼ (現在のアミラーゼ )を発見したことを主張する人もいれば[ 16] エドゥアルト・ブフナー が無細胞抽出物でアルコール発酵 の複雑な生化学過程を最初に証明したことを考える人もいる[ 17] [ 18] [ 19] ユストゥス・フォン・リービッヒ が1842年に発表した『Animal chemistry, or, Organic chemistry in its applications to physiology and pathology 』という、代謝の化学的理論を提示した影響力のある著作や[ 12] アントワーヌ・ラヴォアジエ による発酵 と呼吸 の研究を挙げる人もいる[ 20] [ 21] エミール・フィッシャー や[ 22] フレデリック・ホプキンズ が挙げられる[ 23]
生化学(英 : biochemistry )という言葉は、生物学 と化学 の組み合わせに由来する。1877年、フェリクス・ホッペ=ザイラー が、『Zeitschrift für Physiologische Chemie Biological Chemistry 誌)の創刊号の序文で、生理化学(physiological chemistry)の同義語としてこの言葉(独 : biochemie )を使用し、この分野に特化した研究機関の設立を提唱した[ 24] [ 25] 化学者 カール・ノイベルグ が作ったとされることも多く[ 26] [ 27] [ 28] フランツ・ホフマイスター (英語版 ) [ 29]
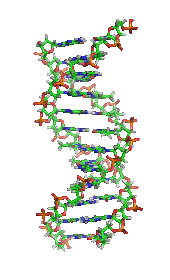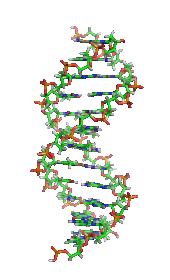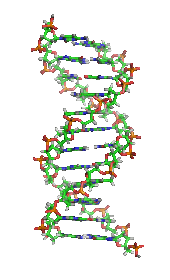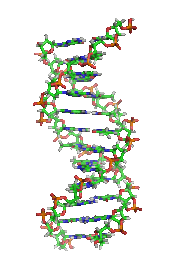
DNAの構造 (1D65 [ 30] かつては、生命やその材料には、非生物に見られるものとは異なる本質的な性質や物質があり、生命の分子を作り出せるのは生物だけであると広く信じられていた(生命原理 (英語版 ) [ 31] フリードリヒ・ヴェーラー が、シアン酸カリウムと硫酸アンモニウムから尿素を合成 した論文は、生命原理を覆し、有機化学 を確立したとする見方もある[ 32] [ 33] 生気論 が死んだとヴェーラー合成を否定する人もいて、論争を巻き起こした[ 34] クロマトグラフィー 、X線回折 、二重偏光干渉法 、NMR分光法 (英語版 ) 放射性同位体標識(放射性トレーサー) 、電子顕微鏡 、分子動力学 シミュレーションなどの新しい技術が導入された。これらの技術により、物質を精製したり、解糖やクレブス回路(クエン酸回路) のような、多くの細胞内分子や代謝経路 の発見と詳細な解析が可能となり、生化学を分子レベルで理解することにつながった。
遺伝子 の発見と、細胞内での情報伝達に果たすその役割は、生化学の歴史におけるもうひとつの重要な出来事である。1950年代、ジェームズ・D・ワトソン 、フランシス・クリック 、ロザリンド・フランクリン 、モーリス・ウィルキンス は、DNA の構造を解明し、遺伝情報の伝達との関係を示唆することに貢献した[ 35] ジョージ・ビードル とエドワード・タータム は、菌類において1つの遺伝子が1つの酵素を作り出す ことを明らかにし、ノーベル賞 を受賞した[ 36] コリン・ピッチフォーク (英語版 ) DNA証拠 を使って殺人罪で初めて有罪判決を受け、法医学 の発展につながった[ 37] アンドリュー・ファイアー とクレイグ・キャメロン・メロー が、遺伝子発現 を抑制するRNA干渉 (RNAi)の役割を発見し、2006年のノーベル賞を共同受賞した[ 38]
人体を構成する主な元素を、質量比で多いものから少ないものへと示す。 さまざまな種類の生物学的な生命 には、約20種類の化学元素 が不可欠である。地球上の希少元素の大半(セレン とヨウ素 は除く)は生命に必要ではなく[ 39] アルミニウム やチタン など豊富に存在する一般的な元素の中には、生命に利用されないものもある。ほとんどの生物は同じような元素を必要とするが、植物 と動物 には若干の違いがある。たとえば、海洋性藻類は臭素 を利用するが、陸上の動物や植物はまったく必要ないようである。また、ナトリウム はすべての動物で必要であるが、植物には必須ではない。逆に、植物にはケイ素 とホウ素 が必要だが、動物には不要か、あるいは極微量しか必要ない場合がある。
ヒト を含む生体細胞の質量のほぼ99%を、炭素 、水素 、窒素 、酸素 、カルシウム 、リン のわずか6元素が占めている(完全な一覧は人体の構成 (英語版 ) [ 40]
生化学における4種類の主要な分子(生体分子 と呼ばれる)は、炭水化物 、脂質 、タンパク質 、および核酸 である[ 41] ポリマー (重合体)である。この文脈ではモノマー (単量体)は比較的小さな高分子 であり、それらが脱水合成 と呼ばれる過程で互いに結合し、生体高分子 と呼ばれる大きな高分子を形成している。また、さまざまな高分子が集合して、より大きな複合体を形成することがあり、これは生物学的活性 に必要とされることも多い。
炭水化物は、主にエネルギーの貯蔵と構造の提供という機能を持っている。よく知られている糖類 であるグルコースは炭水化物の一つであるが、すべての炭水化物が糖類というわけではない。炭水化物は、地球上に最も多く存在する生体分子であり、エネルギー貯蔵、遺伝情報 の保存、細胞間の相互作用 (英語版 ) コミュニケーション など、さまざまな役割を果たしている。
単糖は最も単純な炭水化物で、炭素、水素、酸素を通常は1:2:1の比率で含んでいる(一般式はCn 2n On 、n は少なくとも3)。グルコース (C6 H12 O6 )は最も重要な炭水化物であり、その他には甘い 果物 に含まれるフルクトース (C6 H12 O6 )や、DNA の構成要素であるデオキシリボース (C5 H10 O4 )などがある[ 42] [ 注釈 1] 非環式 (開鎖型)と環式 の状態がある。開鎖型は、一方の端のカルボニル基 と他方の端のヒドロキシ基 の酸素 原子により架橋された炭素原子の環に変化したものである。この環状分子は、直鎖状がアルドース かケトース かによって、ヘミアセタール 基かヘミケタール 基を持つ[ 44]
これらの環状分子は、通常5個または6個の原子を含む環を持ち、それぞれフラノース およびピラノース と呼ばれる。同様の炭素-酸素環を持つ最も単純な化合物であるフラン およびピラン (炭素-炭素二重結合 を持たない)に類似していることから、その名が付けられた。たとえば、アルドヘキソース のグルコースは、炭素1の水酸基と炭素4の酸素の間でヘミアセタール結合を形成し、グルコフラノースと呼ばれる5員環の分子を作ることができる。同様の反応は炭素1と炭素5の間でも起こり、グルコピラノースと呼ばれる6員環の分子ができる。7員環のヘプトース (en:英語版 ) はまれである。
2つの単糖はグリコシド結合 またはエステル結合 で結合し、脱水反応 によって水分子が放出されて二糖 になる。二糖のグリコシド結合を切断して2つの単糖に分解する逆の反応を加水分解 という。最もよく知られた二糖類はスクロース (普通の砂糖 )で、グルコース 分子とフルクトース 分子が結合したものである。もう一つの重要な二糖類は、牛乳に含まれるラクトース (乳糖)で、これはグルコース分子とガラクトース 分子が結合したものである。乳糖はラクターゼ という酵素によって加水分解され、この酵素が欠乏すると乳糖不耐症 になる。
単糖が数個(3-6個程度)結合したものをオリゴ糖 と呼ぶ(オリゴは「少数」の意味)。この分子は、マーカー (英語版 ) シグナル として使われるなど、さまざまな用途も持っている[ 45] 多糖 を形成する。これらは、1本の長い直鎖で結合することもあれば、分岐 した構造になることもある。最も一般的な多糖にはセルロース とグリコーゲン があり、どちらもグルコースモノマー の繰り返しから構成されている。セルロースは植物の細胞壁 の重要な構造成分であり、グリコーゲンは動物のエネルギー源として貯蔵されている。
糖には還元末端 または非還元末端がある。炭水化物の還元末端は、開鎖アルデヒド (アルドース )またはケト体(ケトース )と平衡状態にある炭素原子である。このような炭素原子でモノマーの結合が起こると、ピラノース やフラノース 型の遊離ヒドロキシ基が他の糖のOH側鎖と交換され、完全なアセタール が生成される。これにより、アルデヒド型やケト型になることは抑止され、非還元性の修飾残基となる。ラクトースでは、グルコース部分は還元末端であり、ガラクトース部分はグルコースのC4-OH基と完全なアセタールを形成する。サッカロース では、グルコースのアルデヒド炭素(C1)とフルクトースのケト炭素(C2)の間で完全なアセタールが形成されるため、還元末端は存在しない。
一般的な脂質の構造。上段の2つはコレステロール とオレイン酸 [ 46] オレオイル 、ステアロイル 、パルミトイル 鎖が結合したトリグリセリド 。下段は、一般的なリン脂質 であるホスファチジルコリン [ 47] 脂質 は、生体由来の比較的水に溶けないまたは非極性 (英語版 ) ワックス 、脂肪酸 、脂肪酸由来のリン脂質 、スフィンゴ脂質 、糖脂質 、およびテルペノイド (レチノイド やステロイド など)などが含まれる。脂質には、直鎖状の脂肪族 分子もあれば、環状構造を持つものもある。また、芳香族 (環状と平面状の構造を持つ)分子もあれば、非芳香族分子もある。脂質には柔軟なものもあれば、硬いものもある。
脂質は通常、グリセロール が他の分子と結合して作られている。バルク脂質の主要なグループであるトリグリセリド は、1分子のグリセロールと3つの脂肪酸 が含まれる。ここでいう脂肪酸はモノマーとみなされ、飽和 (炭素鎖に二重結合 がない)または不飽和 (炭素鎖に一つ以上の二重結合がある)のいずれかになる。
脂質は通常、非極性の部分と極性 の部分の両方を持っている。脂質の主な構造は非極性、つまり疎水性 (水をはじく)であり、水のような極性溶媒 とは混ざりにくい。しかし、脂質には極性または親水性 (水になじむ)の部分もあり、水などの極性溶媒と結合する傾向がある。このため脂質は、疎水性部と親水性部の両方を持つ両親媒性分子 となっている。コレステロール を例に取れば、極性基は単なる-OH(ヒドロキシ基またはアルコール)である。リン脂質の場合、後述のように、より大きくて極性の強い極性基を持つ。
脂質は、私たちの毎日の食生活を支える重要なものである。バター 、チーズ 、ギー など、料理や食事に使う油 や乳製品 のほとんどは脂肪 でできている。植物油 には、さまざまな多価不飽和脂肪酸 (PUFA)が豊富に含まれている。脂質を含む食品は、体内で消化され、最終的な産物である脂肪酸とグリセロールに分解される。脂質、特にリン脂質は、非経口輸液などの共溶解剤として、あるいはリポソーム やトランスファソーム (英語版 ) 薬物担体 (英語版 ) 医薬品 にも使用されている。
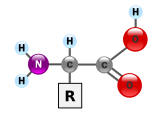
α-アミノ酸の一般的な構造。左側がアミノ 基、右側がカルボキシル 基である。Rは側鎖基でアミノ酸ごとに異なる。 タンパク質 は、マクロバイオポリマーとも呼ばれる非常に大きな分子で、アミノ酸 というモノマーから構成されている。各アミノ酸は、α炭素原子にアミノ基(–NH2 )、カルボン酸 基(–COOH、ただし生理学的条件下では–NH3 + や–COO− として存在する)、単一の水素原子、および固有の側鎖(一般に –R と表記される)が結合したものである。この側鎖「R」によって、20種類の標準的なアミノ酸 がそれぞれ区別される。この側鎖基「R」がアミノ酸に異なる性質を与え、タンパク質の全体の立体構造 に大きな影響を与える。たとえば神経伝達物質 として機能するグルタミン酸 のように、単独または修飾された形で機能を持つアミノ酸もある。アミノ酸は、脱水合成 という過程でペプチド結合 を形成し、互いに結合する。このとき、一方のアミノ酸のアミノ基の窒素と、別のアミノ酸のカルボン酸基の炭素が結びつき、水分子が放出される。こうして作られた分子をジペプチド と呼び、短いアミノ酸の配列(通常は30個以下)はペプチドまたはポリペプチド、より長い鎖はタンパク質と呼ばれる。たとえば、血清 タンパク質であるアルブミン は、585個のアミノ酸残基から構成されている[ 48]
一般的なアミノ酸の構造式を、(1)中性型、(2)生理的に存在する状態、(3)ジペプチドとして結合した状態で示す。 ヘモグロビン の模式図。赤と青のリボンはタンパク質のグロビン 、緑の構造はヘム基 を表す。タンパク質は、構造的な役割と機能的な役割の両方に関与している。たとえば、アクチン とミオシン というタンパク質は、骨格筋の収縮を担っている。多くのタンパク質が持つ特性の1つは、特定の分子または分子群に特異的に結合する能力を持つことである。たとえば、抗体 は、特定の1種類の分子に結合するタンパク質である。抗体は、2本の重鎖と2本の軽鎖が、アミノ酸間のジスルフィド結合によって結合して構成されている。抗体は、N末端ドメインの違いにより、標的分子 と特異的に結合することができる[ 49]
酵素結合免疫吸着法 (ELISA)は抗体を利用した検査法で、現代医学でがさまざまな生体分子を検出するための最も高感度な方法の一つである。しかし、酵素 は最も重要なタンパク質であると考えられている。生細胞内でのほぼすべての反応は、反応の活性化エネルギーを低減させるために酵素が必要である。酵素の分子は、基質 と呼ばれる特定の反応分子を識別し、それらの間の反応を触媒 することができる[ 17] 11 倍以上に向上させ[ 17] [ 50] [ 17]
タンパク質の構造は、慣例で4段階に分類される。一次構造 とは、たとえば「アラニン-グリシン-トリプトファン-セリン-グルタミン酸-アスパラギン-グリシン-リジン…」というように、アミノ酸が一列に並んだ状態のことである。二次構造 は、局所的な形態に着目したもので、特定のアミノ酸の組み合わせが、αヘリックス というらせん状に巻きついたり、βシート という板状に折り重なる傾向がある。下の図には、いくつかのαヘリックスをもつヘモグロビン が示されている。三次構造 とは、タンパク質の全体的な立体形状を指し、アミノ酸の配列によって決定される。実際、ヘモグロビン のα鎖には146個のアミノ酸残基が含まれ、その6位のグルタミン酸 残基がバリン 残基に置換された鎌状赤血球症 のように、配列の一つの変えると構造全体が変わることがある。四次構造 は、4つのサブユニットを持つヘモグロビンのように、複数のペプチドサブユニットを持つタンパク質の構造を扱っている。すべてのタンパク質が複数のサブユニットを持つわけではない[ 51]
蛋白質構造データバンク からのタンパク質構造の例。タンパク質群のメンバーを示す(イソメラーゼ ドメイン のみを示す)。 摂取されたタンパク質は、通常、小腸 で個々のアミノ酸やジペプチドに分解され、体内に吸収される。その後、再び組み合わされて新しいタンパク質が作られる。アミノ酸は、解糖 、クエン酸回路 、ペントースリン酸経路 の中間生成物を使用して作られる。ほとんどの細菌 や植物は、20種類すべてのアミノ酸を作るのに必要な酵素を持っている。しかし、ヒトをはじめとする哺乳類は一部の酵素を持たないため、イソロイシン 、ロイシン 、リシン 、メチオニン 、フェニルアラニン 、トレオニン 、トリプトファン 、バリン を作ることができない。これらは食餌から摂取しなければならないため必須アミノ酸 と呼ばれる。哺乳類は、アラニン 、アスパラギン 、アスパラギン酸 、システイン 、グルタミン酸 、グルタミン 、グリシン 、プロリン 、セリン 、チロシン を合成することができ、これらは非必須アミノ酸と呼ぶ。アルギニン やヒスチジン は作ることができるが、成長期の動物には十分な量を産生できないので、必須アミノ酸とされることがある。
アミノ酸からアミノ基を取り除くと、α-ケト酸 という炭素骨格が生成する。トランスアミナーゼ (アミノ基転移酵素)と呼ばれる酵素は、あるアミノ酸(α-ケト酸になる)から別のα-ケト酸(アミノ酸になる)へ、アミノ基を容易に転移させることができる。この過程はタンパク質生合成において重要である。多くの生化学的経路では、他の経路からの中間体がα-ケト酸骨格に変換された後、多くの場合、このアミノ基転移 によってアミノ基が付加される。その後、アミノ酸が結合してタンパク質が形成されることもある。
タンパク質が分解される際にも、同様の過程で行われる。最初にタンパク質は加水分解され、個々のアミノ酸になる。血液中にアンモニウム イオン(NH4 + )として存在する遊離アンモニア (NH3 )は、生物にとって有毒であるため、生物の必要に応じてさまざまな方法で排泄しなければならない。動物では、その必要性に応じて、さまざまな戦術が進化してきた。単細胞生物 はアンモニアを環境中に放出する。同様に、硬骨魚類 はアンモニアを水中に放出してすばやく希釈する。一般に、哺乳類は尿素回路 によってアンモニアを尿素 に変換する。
2つのタンパク質が近縁かどうか、換言すれば相同性 があるかどうかを判断するために、科学者は配列アラインメント や構造アラインメント (英語版 ) タンパク質群 の進化パターンを形成する以上の意味を持っている。2つのタンパク質の配列がどの程度似ているかを調べることにより、その構造、さらには機能に関する知識を得ることができる。
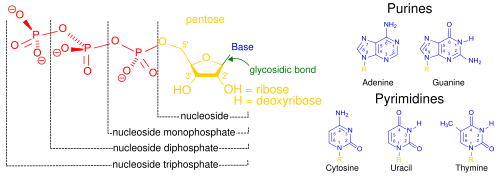
デオキシリボ核酸 (DNA)の構造。右上はモノマーが結合している様子を示す。核酸 は、細胞核 に多く存在する生体高分子群の総称であり、すべての生きた細胞やウイルスで遺伝情報 の源として使用されている[ 2] ヌクレオチド と呼ばれるモノマーから構成された、複雑で高分子量の生化学高分子である。各ヌクレオチドは、含窒素複素環塩基 (プリン またはピリミジン )、ペントース糖、およびリン酸基 の3つの成分から構成されている[ 52]
一般的な核酸の構成要素。ヌクレオシド一リン酸、ヌクレオシド二リン酸、ヌクレオシド三リン酸は、少なくとも一つのリン酸基(赤色)を持つことから、ヌクレオチドと呼ばれる化合物である。(ヌクレオシド (黄色)はリン酸基を持たない) もっともよく知られている核酸は、デオキシリボ核酸 (DNA)とリボ核酸 (RNA)の2種類である。これらの生体高分子では、各ヌクレオチドのリン酸基 と糖が結合して骨格を形成し、窒素塩基の配列が遺伝情報の保存を担っている。一般的な窒素塩基は、アデニン 、シトシン 、グアニン 、チミン 、ウラシル の5種類である。核酸の鎖に含まれる核酸塩基 は、水素結合 によって互いに結合し、ジッパーのように相補的な窒素塩基の対を作る。アデニンはチミンまたはウラシルと結合し、チミンはアデニンとのみ、シトシンとグアニンとのみ結合する。ことができる。アデニンとチミン、アデニンとウラシルはそれぞれ2つの水素結合を形成し、シトシンとグアニンの間は3つの水素結合を形成する。
細胞の遺伝物質としての役割に加え、細胞内のセカンドメッセンジャー としての役割を担うことも多い。また、すべての生物に存在する主要なエネルギー担体分子であるアデノシン三リン酸 (ATP)の構成要素でもある。RNAとDNAの窒素塩基は異なり、アデニン、シトシン、グアニンは両方に存在し、チミンはDNAにのみ、ウラシルはRNAにのみ存在する。
グルコースはほとんどの生命体のエネルギー源である。たとえば、多糖は酵素 によってモノマーに分解される(グリコーゲンホスホリラーゼ は、多糖であるグリコーゲンからグルコース残基を切断する)。ラクトース(乳糖)やスクロース(ショ糖)などの二糖類は、2つの単糖に切断される。
The image above contains clickable links 解糖の
代謝経路 は、一連の中間代謝産物を経て
グルコース を
ピルビン酸 に変換する。
各段階で、化学修飾は異なる酵素によって行われる。
段階1と3では
ATP が消費され、
段階7と10ではATPが生成する。段階6-10はグルコース1分子につき2回行われるので、ATPの正味の生成につながる。
グルコースは主に、解糖 という非常に重要な10段階の経路 によって代謝され、その結果、1分子のグルコースが2分子のピルビン酸 に分解される。また、細胞のエネルギー通貨であるATP (アデノシン三リン酸)の正味2分子が生成され、2分子分のNAD+ (酸化型のニコチンアミドアデニンジヌクレオチド)をNADH(還元型のニコチンアミドアデニンジヌクレオチド)に変換する還元当量も生成される。これには酸素を必要としない。酸素がない場合(あるいは細胞が酸素を使えない場合)、ピルビン酸を乳酸 (例: ヒト)またはエタノール と二酸化炭素(例: 酵母 )に変換することでNADを回復される。ガラクトースやフルクトースなどの他の単糖も、解糖経路の中間体に変換される[ 53]
ヒトのほとんどの細胞のように、十分な酸素が存在する好気性細胞 (英語版 ) アセチルCoA に変換され、1個の炭素原子が老廃物の二酸化炭素 として排出され、別の還元当量としてNADH が生成される。次に、2分子のアセチルCoA(1分子のグルコースから)がクエン酸回路 に入り、2分子のATP、さらに6分子のNADH、2つの還元型(ユビ )キノン(酵素結合補因子としてFADH2 を経由)を生成し、残りの炭素原子を二酸化炭素として放出する。生成したNAD+ とキノール分子は、呼吸鎖の酵素複合体に供給され、電子伝達系 が電子を最終的に酸素に伝達し、放出されたエネルギーを生体膜(真核生物 ではミトコンドリア内膜 )を介したプロトン 濃度勾配 の形で保存する。こうして、酸素は水に還元され、元の電子受容体であるNAD+ とキノンが再生される。ヒトが酸素を吸い、二酸化炭素を吐き出すのはこのためである。NADHとキノールの高エネルギー状態から電子が移動することで放出されたエネルギーは、最初にプロトン勾配として蓄えられ、ATPシンターゼ (合成酵素)によってATPに変換される。これにより、さらに28分子のATPが生成され(8つのNADHから24、2つのキノールから4つ)、分解されたグルコース1分子あたり合計32分子のATPが保存される(解糖から2つ、クエン酸回路から2つ)[ 54]
脊椎動物 では、骨格筋 が激しく収縮するとき(例: 重量挙げや全力疾走のとき)、エネルギー需要に見合うだけの酸素が供給されないため、グルコースを乳酸に変換するために嫌気性代謝 (英語版 ) グリコーゲン の貯蔵が枯渇したときにのみ起こる。この経路は、ピルビン酸からグルコースへの解糖 の根本的な逆転であり、アミノ酸、グリセロール、クレブス回路(クエン酸回路) のような多くの供給源を使用することができる。大規模なタンパク質と脂肪の異化 は、通常、飢餓やある種の内分泌疾患に伴って起こる[ 55] 肝臓 は、糖新生 と呼ばれる過程を通じてグルコースを再生成する。この過程は解糖と全く逆ではなく、実際には解糖の3倍のエネルギーを必要とする(解糖では2分子のATPが得られるのに対し、6分子のATPが使用される)。上記の反応と同様に、生成されたグルコースは、エネルギーを必要とする組織で解糖されたり、グリコーゲン(植物ではデンプン )として貯蔵されたり、他の単糖に変換されたり、二糖またはオリゴ糖に結合されたりする。運動中の解糖、血流を介した乳酸の肝臓への移動、その後の糖新生、そして血流へのグルコースの放出という経路を組み合わせたものをコリ回路 と呼ぶ[ 56]
生化学 、遺伝学 、分子生物学 との関係図。生化学の研究者は、生化学に特有の技術を使用するが、これらを遺伝学 、分子生物学 、生物物理学 の分野で開発された技術や考え方と組み合わせることも多くなっている。これらの分野の間に明確な境界線はない。生化学は分子の生物学的活性に必要な化学 を研究し、分子生物学 は分子の生物学的活性を研究し、遺伝学 はゲノム が担う分子の遺伝現象を研究する学問である。このことは、右上の図に示すように、各分野の関係を表す一つの可能性である。
生化学 (英 : biochemistry )は、生体 内で起こる化学物質と生命現象を研究する学問である。生化学者 は、生体分子の役割、機能、および構造に重点を置いている。生物学的過程の背後にある化学の研究や、生物学的に活性な分子の合成は、生化学の応用である。生化学は、原子および分子のレベルでの生命の研究である。遺伝学 (英 : genetics )とは、生物における遺伝的な差異がもたらす影響を研究する学問である。多くの場合は、正常な構成要素(例: 1つの遺伝子 )の欠如から推測することができる。変異体 、いわゆる野生型 あるいは正常な表現型 と比較して1つか複数の機能的構成要素を欠く生物の研究である。遺伝的相互作用(エピスタシス )は、このような「ノックアウト 」研究の単純な解釈をしばしば混乱させる。分子生物学 (英 : molecular biology )は、分子の合成、修飾、機構、および相互作用に焦点を当てた、生命現象の分子基盤を研究する学問である。遺伝物質がRNAに転写され、さらにタンパク質 に翻訳されるという分子生物学のセントラルドグマ は、単純化されすぎてはいるものの、この分野を理解するための良い出発点となる。この概念は、RNA の新たな役割の出現によって見直されている。化学生物学 英 : chemical biology )は、小分子 に基づく新しいツールを開発し、生体系への影響を最小限に抑えながら、その機能に関する詳細な情報を提供することを目指している。さらに、化学生物学では、生体分子と合成装置との非天然ハイブリッドを作り出すために生体システムを利用している(たとえば、遺伝子治療 や薬剤分子 を送達できる空のウイルスキャプシド )。
生化学実験はIn vitro実験とも呼ばれるように生体細胞の細胞器官内で生じる生化学反応を、複雑な代謝経路や調節機構から切り離してまさに試験管のなかで再現することで研究が進展してきた。21世紀 に入ると標識化技術や測定技術の進歩で生きている細胞内で生化学反応を間接的に追跡することも可能になってきたが、生体組織から目的の成分を分離精製する実験技術は生化学研究においては重要な研究技術である。
一般に消化酵素 やホルモン のように分泌型の生体物質でない限りは、酵素や受容体を含めて目的の生体物質は特定の組織細胞の特定の細胞小器官にのみ発現・存在している。したがって、生化学実験は標的組織を多数採集し、そこから目的の生体物質を分離精製するところから始まる。
DNAのように細胞破砕後に、エタノール沈澱するだけで捕集できるものもあるが多くの場合、細胞破砕後に密度勾配法による遠心分離で目的の細胞内器官を密度により選択し捕集する。溶液 には塩化セシウム などが用いられる。この状態では多くの場合、酵素や受容体は細胞膜に取り込まれていたり、膜の二重層に埋め込まれているので、界面活性剤 を使って脂質膜と分離〈可溶化〉する必要がある。
目的の生体高分子の精製は古くは半透膜による透析 が行われたが、20世紀後半からはゲル濾過クロマトグラフィー やアフィニティークロマトグラフィー により目的物を精製することが可能になった[ 57] [ 58]
代謝による生体内物質の移動や変化の追跡にはトレーサー 物質が利用される。古くから放射性あるいは非放射性同位体を組み込んだ生体内物質が広く利用された。しかし同位体置換した生体内物質を用意することは困難をともない、放射性トレーサー の場合はラジオアイソトープセンターなど専用実験施設が必要な為、今日では抗体染色 やELISA 法など同位体を使用しないトレーサーが広く利用されている[ 59] MALDI法 などの質量分析 でクロマトグラフィ・スポット(ピーク)から直接、標的物質の同定も可能である[ 60]
イオンチャネル の研究においては、生体膜にガラスの毛細管を押し当てることで、管内にイオンチャネルを閉じ籠めて生化学実験を行うパッチクランプ の実験技術によって上記のように生体成分を分離せずに実験を行う技法も開発された。
1990年代 以降には特定の無機イオンに反応して蛍光を発する標識色素やルシフェラーゼ遺伝子を応用した形質導入によって、細胞外から蛍光顕微鏡 で発光現象を追跡することで間接的に生化学反応をトレースすることも可能になってきている。
^ 果物に含まれる糖分はフルクトース(果糖)だけではない。グルコース(ブドウ糖)とスクロース(ショ糖)もさまざまな果物に含まれており、時にはフルクトースを上回ることもある。たとえば、デーツ (ナツメヤシの果実)の可食部の32%はグルコースで、フルクトースは24%、スクロースは8%である。しかし、モモ にはフルクトース(0.93%)やグルコース(1.47%)よりも多くのスクロース(6.66%)が含まれている。[ 43]
^ “Biological/Biochemistry ”. acs.org . 2014年2月6日 閲覧。 ^ a b Voet (2005), p. 3.
^ Karp (2009), p. 2.^ Miller (2012). p. 62.^ Astbury (1961), p. 1124.^ Srinivasan, Bharath (March 2022). “A guide to enzyme kinetics in early drug discovery” . The FEBS Journal . doi :10.1111/febs.16404 . ISSN 1742-464X . PMID 35175693 . https://doi.org/10.1111/febs.16404 . ^ Eldra (2007), p. 45.^ Marks (2012), Chapter 14.^ Finkel (2009), pp. 1–4.^ UNICEF (2010), pp. 61, 75.^ Cobb, N. J.; Surewicz, W. K. (2009). “Prion Diseases and Their Biochemical Mechanisms - Nathan J. Cobb and Witold K. Surewicz” . Biochemistry 48 (12): 2574–2585. doi :10.1021/bi900108v . PMC 2805067 . PMID 19239250 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2805067/ . ^ a b Helvoort (2000), p. 81.
^ Scheele, Carl Wilhelm (1780). “Om Mjölk och dess syra [About milk and its acid]” (Swedish). Kongliga Vetenskaps Academiens Nya Handlingar (New Proceedings of the Royal Academy of Science) 1 : 116–124. https://books.google.com/books?id=9N84AAAAMAAJ&pg=PA116 . ^ Scheele, Carl Wilhelm (1784). “Anmärkning om Citron-Saft, samt sätt att crystallisera den samma [Note on lemon juice, as well as ways to crystallize the same]” (Swedish). Kongliga Vetenskaps Academiens Nya Handlingar (New Proceedings of the Royal Academy of Science) 5 : 105–109. ^ 生化学辞典第2版、p.713 【生化学】 ^ Hunter (2000), p. 75.^ a b c d Srinivasan, Bharath (2020-09-27). “Words of advice: teaching enzyme kinetics”. The FEBS Journal 288 (7): 2068–2083. doi :10.1111/febs.15537 . ISSN 1742-464X . PMID 32981225 .
^ Hamblin (2005), p. 26.^ Hunter (2000), pp. 96–98.^ Berg (1980), pp. 1–2.^ Holmes (1987), p. xv.^ Feldman (2001), p. 206.^ Rayner-Canham (2005), p. 136.^ Ziesak (1999), p. 169.^ Kleinkauf (1988), p. 116.^ Ben-Menahem (2009), p. 2982.^ Amsler (1986), p. 55.^ Horton (2013), p. 36.^ Kleinkauf (1988), p. 43.^ Edwards (1992), pp. 1161–1173.^ Fiske (1890), pp. 419–20.^ Wöhler, F. (1828). “Ueber künstliche Bildung des Harnstoffs” . Annalen der Physik und Chemie 88 (2): 253–256. Bibcode : 1828AnP....88..253W . doi :10.1002/andp.18280880206 . ISSN 0003-3804 . https://doi.org/10.1002/andp.18280880206 . ^ Kauffman (2001), pp. 121–133.^ Lipman, Timothy O. (August 1964). “Wohler's preparation of urea and the fate of vitalism” . Journal of Chemical Education 41 (8): 452. Bibcode : 1964JChEd..41..452L . doi :10.1021/ed041p452 . ISSN 0021-9584 . https://doi.org/10.1021/ed041p452 . ^ Tropp (2012), pp. 19–20.^ Krebs (2012), p. 32.^ Butler (2009), p. 5.^ Chandan (2007), pp. 193–194.^ Cox, Nelson, Lehninger (2008). Lehninger Principles of Biochemistry . Macmillan ^ Nielsen (1999), pp. 283–303.^ Slabaugh (2007), pp. 3–6.^ Whiting (1970), pp. 1–31.^ Whiting , G.C. (1970), p. 5.^ Voet (2005), pp. 358–359.^ Varki (1999), p. 17.^ Stryer (2007), p. 328.^ Voet (2005), Ch. 12 Lipids and Membranes.^ Metzler (2001), p. 58.^ Feige, Matthias J.; Hendershot, Linda M.; Buchner, Johannes (2010). “How antibodies fold” . Trends in Biochemical Sciences 35 (4): 189–198. doi :10.1016/j.tibs.2009.11.005 . PMC 4716677 . PMID 20022755 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4716677/ . ^ Srinivasan, Bharath (2021-07-16). “A Guide to the Michaelis‐Menten equation: Steady state and beyond” (英語). The FEBS Journal 289 (20): 6086–6098. doi :10.1111/febs.16124 . ISSN 1742-464X . PMID 34270860 . ^ Fromm and Hargrove (2012), pp. 35–51.^ Saenger (1984), p. 84.^ Fromm and Hargrove (2012), pp. 163–180.^ Voet (2005), Ch. 17 Glycolysis.^ A Dictionary of Biology ISBN 9780198714378 . https://www.oxfordreference.com/view/10.1093/acref/9780198714378.001.0001/acref-9780198714378 ^ Fromm and Hargrove (2012), pp. 183–194.^ Meir Wilchek, Talia Miron (1999). “Thirty years of affinity chromatography” . Reactive, Functional Polymers 41 (1): 263-268. doi :10.1016/S1381-5148(99)00042-5 . ISSN 1381-5148 . https://doi.org/10.1016/S1381-5148(99)00042-5 . ^ André M. Striegel, Wallace W. Yau, Joseph J. Kirkland, Donald D. Bly (2009). Modern Size-Exclusion Liquid Chromatography: Practice of Gel Permeation and Gel Filtration Chromatography, Second Edition doi :10.1002/9780470442876 . ISBN 9780471201724 . https://onlinelibrary.wiley.com/doi/book/10.1002/9780470442876 . ^ Voller, A., Bidwell, D. E., & Bartlett, A. (1979). The enzyme linked immunosorbent assay (ELISA). A guide with abstracts of microplate applications. Dynatech Europe, Borough House, Rue du Pre..
^ Hillenkamp, Franz; Jaskolla, Thorsten W; Karas, Michael (2014). “The MALDI process and method” . MALDI MS. A Practical Guide to Instrumentation, Methods, and Applications, 2nd Ed.(Ed.: F. Hillenkamp, J. Peter-Katalinic), Wiley Blackwell, Weinheim, Germany (Wiley Online Library). doi :10.1002/9783527335961 . https://onlinelibrary.wiley.com/doi/book/10.1002/9783527335961#page=16 .
Amsler, Mark (1986). The Languages of Creativity: Models, Problem-solving, Discourse ISBN 978-0-87413-280-9 . https://books.google.com/books?id=I-X-ijtoD9QC&pg=PA55 Astbury, W.T. (1961). “Molecular Biology or Ultrastructural Biology ?”. Nature 190 (4781): 1124. Bibcode : 1961Natur.190.1124A . doi :10.1038/1901124a0 . PMID 13684868 . Ben-Menahem, Ari (2009). Historical Encyclopedia of Natural and Mathematical Sciences Bibcode : 2009henm.book.....B . ISBN 978-3-540-68831-0 . https://books.google.com/books?id=9tUrarQYhKMC&pg=PA2982 Burton, Feldman (2001). The Nobel Prize: A History of Genius, Controversy, and Prestige ISBN 978-1-55970-592-9 . https://books.google.com/books?id=xnckeeTICn0C&pg=PA206 Butler, John M. (2009). Fundamentals of Forensic DNA Typing ISBN 978-0-08-096176-7 . https://books.google.com/books?id=-OZeEmqzE4oC&pg=PA5 Sen, Chandan K.; Roy, Sashwati (2007). “MiRNA: Licensed to Kill the Messenger”. DNA and Cell Biology 26 (4): 193–194. doi :10.1089/dna.2006.0567 . PMID 17465885 . Clarence, Peter Berg (1980). The University of Iowa and Biochemistry from Their Beginnings ISBN 978-0-87414-014-9 . https://books.google.com/books?id=XwQhAQAAIAAJ&pg=PA1 Edwards, Karen J.; Brown, David G.; Spink, Neil; Skelly, Jane V.; Neidle, Stephen (1992). “Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2 an examination of propeller twist and minor-groove water structure at 2·2Åresolution”. Journal of Molecular Biology 226 (4): 1161–1173. doi :10.1016/0022-2836(92)91059-x . PMID 1518049 . Eldra P. Solomon; Linda R. Berg; Diana W. Martin (2007). Biology, 8th Edition, International Student Edition ISBN 978-0-495-31714-2 . オリジナル の2016-03-04時点におけるアーカイブ。. https://web.archive.org/web/20160304064412/http://www.slideshare.net/nicolledb05/biology-solomon-berg-martin-8th-edition Fariselli, P.; Rossi, I.; Capriotti, E.; Casadio, R. (2006). “The WWWH of remote homolog detection: The state of the art”. Briefings in Bioinformatics 8 (2): 78–87. doi :10.1093/bib/bbl032 . PMID 17003074 . Fiske, John (1890). Outlines of Cosmic Philosophy Based on the Doctrines of Evolution, with Criticisms on the Positive Philosophy, Volume 1 . https://books.google.com/books?id=bTgmlJNazxkC 16 February 2015 閲覧。 Finkel, Richard; Cubeddu, Luigi; Clark, Michelle (2009). Lippincott's Illustrated Reviews: Pharmacology ISBN 978-0-7817-7155-9 . https://books.google.com/books?id=Q4hG2gRhy7oC Krebs, Jocelyn E.; Goldstein, Elliott S.; Lewin, Benjamin; Kilpatrick, Stephen T. (2012). Essential Genes ISBN 978-1-4496-1265-8 . https://books.google.com/books?id=FzBs_QgihRIC&pg=PA32 Fromm, Herbert J.; Hargrove, Mark (2012). Essentials of Biochemistry ISBN 978-3-642-19623-2 . https://books.google.com/books?id=2eXILOD0Yl8C&q=editions:ISBN3642196241 Hamblin, Jacob Darwin (2005). Science in the Early Twentieth Century: An Encyclopedia ISBN 978-1-85109-665-7 . https://books.google.com/books?id=mpiZRAiE0JwC&pg=PA26 Helvoort, Ton van (2000). Arne Hessenbruch. ed. Reader's Guide to the History of Science ISBN 978-1-884964-29-9 . https://books.google.com/books?id=fjhdAgAAQBAJ&pg=PA81 Holmes, Frederic Lawrence (1987). Lavoisier and the Chemistry of Life: An Exploration of Scientific Creativity ISBN 978-0-299-09984-8 . https://books.google.com/books?id=MLY-x9a393QC&pg=PR15 Horton, Derek, ed (2013). Advances in Carbohydrate Chemistry and Biochemistry, Volume 70 ISBN 978-0-12-408112-3 . https://books.google.com/books?id=JQluAAAAQBAJ&pg=PA36 Hunter, Graeme K. (2000). Vital Forces: The Discovery of the Molecular Basis of Life ISBN 978-0-12-361811-5 . https://books.google.com/books?id=VdHV5ET4usoC Karp, Gerald (2009). Cell and Molecular Biology: Concepts and Experiments ISBN 978-0-470-48337-4 . https://books.google.com/books?id=arRGYE0GxRQC Kauffman, George B.; Chooljian, Steven H. (2001). “Friedrich Wöhler (1800–1882), on the Bicentennial of His Birth”. The Chemical Educator 6 (2): 121–133. doi :10.1007/s00897010444a . Kleinkauf, Horst; Döhren, Hans von; Jaenicke Lothar (1988). The Roots of Modern Biochemistry: Fritz Lippmann's Squiggle and its Consequences ISBN 978-3-11-085245-5 . https://books.google.com/books?id=tuzwshIlng4C&pg=PA116 Knowles, J.R. (1980). “Enzyme-Catalyzed Phosphoryl Transfer Reactions”. Annual Review of Biochemistry 49 : 877–919. doi :10.1146/annurev.bi.49.070180.004305 . PMID 6250450 . Metzler, David Everett; Metzler, Carol M. (2001). Biochemistry: The Chemical Reactions of Living Cells 1 . Academic Press. ISBN 978-0-12-492540-3 . https://books.google.com/books?id=1R_a_D6SSJEC&pg=PA58 Miller G; Spoolman Scott (2012). Environmental Science – Biodiversity Is a Crucial Part of the Earth's Natural Capital Cengage Learning . ISBN 978-1-133-70787-5 . https://books.google.com/books?id=NYEJAAAAQBAJ&pg=PA62 2016年1月4日 閲覧。 Nielsen, Forrest H. (1999). “Ultratrace minerals”. In Maurice E. Shils. Modern Nutrition in Health and Disease . Baltimore: Williams & Wilkins. pp. 283–303. hdl :10113/46493 Peet, Alisa (2012). Marks, Allan; Lieberman Michael A.. eds. Marks' Basic Medical Biochemistry (Lieberman, Marks's Basic Medical Biochemistry) ISBN 978-1-60831-572-7 . https://books.google.com/books?id=HHK7S7t47BEC Rayner-Canham, Marelene F.; Rayner-Canham, Marelene; Rayner-Canham, Geoffrey (2005). Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century ISBN 978-0-941901-27-7 . https://books.google.com/books?id=S_NJ7AubQIcC&pg=PA136 Rojas-Ruiz, Fernando A.; Vargas-Méndez, Leonor Y.; Kouznetsov, Vladimir V. (2011). “Challenges and Perspectives of Chemical Biology, a Successful Multidisciplinary Field of Natural Sciences” . Molecules 16 (3): 2672–2687. doi :10.3390/molecules16032672 . PMC 6259834 . PMID 21441869 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6259834/ . Saenger, Wolfram (1984). Principles of Nucleic Acid Structure ISBN 978-0-387-90762-8 . https://books.google.com/books?id=0R3wAAAAMAAJ Slabaugh, Michael R.; Seager, Spencer L. (2013). Organic and Biochemistry for Today ISBN 978-1-133-60514-0 . https://books.google.com/books?id=K-MBTrn3ZDQC Sherwood, Lauralee; Klandorf, Hillar; Yancey, Paul H. (2012). Animal Physiology: From Genes to Organisms ISBN 978-0-8400-6865-1 . https://books.google.com/books?id=I6X8G8YPdv4C&pg=PA558 Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry ISBN 978-0-7167-8724-2 . https://archive.org/details/biochemistry0006berg Tropp, Burton E. (2012). Molecular Biology ISBN 978-1-4496-0091-4 . https://books.google.com/books?id=CCQYtlufUIAC UNICEF (2010). Facts for life ISBN 978-92-806-4466-1 . オリジナル の2022-10-09時点におけるアーカイブ。. https://ghostarchive.org/archive/20221009/http://www.unicef.org/nutrition/files/Facts_for_Life_EN_010810.pdf Ulveling, Damien; Francastel, Claire; Hubé, Florent (2011). “When one is better than two: RNA with dual functions” . Biochimie 93 (4): 633–644. doi :10.1016/j.biochi.2010.11.004 . PMID 21111023 . オリジナル の2022-10-09時点におけるアーカイブ。. https://ghostarchive.org/archive/20221009/https://hal-univ-diderot.archives-ouvertes.fr/hal-02127323/file/Ulveling%20Review%20revised.pdf . Varki A, Cummings R, Esko J, Jessica F, Hart G, Marth J (1999). Essentials of glycobiology ISBN 978-0-87969-560-6 . https://books.google.com/books?id=lH72FFWIIpgC Voet, D; Voet, JG (2005). Biochemistry ISBN 978-0-471-19350-0 . オリジナル のSeptember 11, 2007時点におけるアーカイブ。. https://web.archive.org/web/20070911065858/http://www.chem.upenn.edu/chem/research/faculty.php?browse=V Whiting, G.C (1970). “Sugars” . In A.C. Hulme. The Biochemistry of Fruits and their Products 1 . London & New York: Academic Press. ISBN 978-0-12-361201-4 . https://books.google.com/books?id=KYDwAAAAMAAJ Ziesak, Anne-Katrin; Cram Hans-Robert (1999). Walter de Gruyter Publishers, 1749–1999 ISBN 978-3-11-016741-2 . https://books.google.com/books?id=ulN4rKWA8c4C&pg=PA169 Ashcroft, Steve. “Professor Sir Philip Randle; Researcher into metabolism: [1st Edition]”. Independent . ProQuest 311080685
Fruton, Joseph S. Proteins, Enzymes, Genes: The Interplay of Chemistry and Biology . Yale University Press: New Haven, 1999. ISBN 0-300-07608-8
Keith Roberts, Martin Raff, Bruce Alberts, Peter Walter, Julian Lewis and Alexander Johnson, Molecular Biology of the Cell
4th Edition, Routledge, March, 2002, hardcover, 1616 pp. ISBN 0-8153-3218-1
3rd Edition, Garland, 1994, ISBN 0-8153-1620-8
2nd Edition, Garland, 1989, ISBN 0-8240-3695-6
Kohler, Robert. From Medical Chemistry to Biochemistry: The Making of a Biomedical Discipline . Cambridge University Press, 1982.
Maggio, Lauren A.; Willinsky, John M.; Steinberg, Ryan M.; Mietchen, Daniel; Wass, Joseph L.; Dong, Ting (2017). “Wikipedia as a gateway to biomedical research: The relative distribution and use of citations in the English Wikipedia” . PLOS ONE 12 (12): e0190046. Bibcode : 2017PLoSO..1290046M . doi :10.1371/journal.pone.0190046 . PMC 5739466 . PMID 29267345 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5739466/ .
ウィキブックスに
生化学 関連の解説書・教科書があります。
ウィキメディア・コモンズには、
生化学 に関連するカテゴリがあります。
対象生物学 生理・生化学 細胞・組織学 ゲノム・遺伝学 進化生物学 生態学 応用・学際領域