|
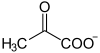
ピルビン酸
ピルビン酸(ピルビンさん、Pyruvic acid)は有機化合物で、カルボン酸の一種。IUPAC命名法で 2-オキソプロパン酸 (2-oxopropanoic acid) と表される。α-ケトプロピオン酸 (α-ketopropionic acid) あるいは焦性ブドウ酸 (pyroracemic acid) とも呼ばれる。水、エタノール、エーテルなど、さまざまな極性溶媒や無極性溶媒と任意な比率で混和する。酢酸に似た酸味臭を示す。2位のカルボニル基を還元すると乳酸となる。 生体内では解糖系による糖の酸化で生成する。 ピルビン酸デヒドロゲナーゼ複合体の作用により補酵素Aと結合するとアセチルCoAとなり、クエン酸回路や脂肪酸合成系に組み込まれる。 また、グルタミン酸からアミノ基を転移されるとアラニンになる。 化学1834年、テオフィル=ジュール・ペルーズは酒石酸(L-酒石酸)およびブドウ酸(D-およびL-酒石酸の混合物)を蒸留し、焦性酒石酸(メチルコハク酸[2])およびもう一種の酸を単離した。後者は翌年イェンス・ヤコブ・ベルセリウスが分析を行い、焦性(pyro)+ラテン語でブドウ(uva)+酸(-ic acid)からピルビン酸(Pyruvic acid)と命名した[3]。ピルビン酸は、酢酸に似た臭いの無色液体であり、水と混和する。実験室では、ピルビン酸は酒石酸および硫酸水素カリウムの混合物の加熱や[4]、強力な酸化剤(例えば過マンガン酸カリウムや漂白剤)によるプロピレングリコールの酸化、塩化アセチルとシアン化カリウムの反応によって得られるシアン化アセチルの加水分解などによって調製される。 生化学ピルビン酸は生化学において重要な化合物である。ピルビン酸は解糖系として知られるグルコースの嫌気性代謝の生産物である[5]。グルコース1分子はピルビン酸2分子へと分解し[5]、ピルビン酸はさらにエネルギーを得るため2つの方法で使われる。ピルビン酸は、クレブス回路として知られる一連の反応の主要な材料であるアセチル補酵素Aへと変換される。また、ピルビン酸は補充反応によってオキサロ酢酸へ変換される。オキサロ酢酸はクレブス回路の中間体を補充し、糖新生にも使用される。これらの反応は、代謝過程の研究でフリッツ・アルベルト・リップマンと共に1953年のノーベル生理学・医学賞を受賞したハンス・アドルフ・クレーブスに因んで命名された。この回路はまた、クエン酸がこれらの反応中の中間体として生成するため、クエン酸回路あるいはトリカルボン酸 (TCA) 回路としても知られている。 十分な酸素が供給されない場合、ピルビン酸は嫌気的に分解され、動物では乳酸、植物や微生物ではエタノールが生成する。解糖系からのピルビン酸は乳酸発酵において乳酸脱水素酵素と補酵素NADHを用いて、あるいはアルコール発酵においてアセトアルデヒド、さらにエタノールへと変換される。 ピルビン酸は代謝経路ネットワークの鍵となる物質である。ピルビン酸は糖新生によって炭水化物、アセチルCoAを介して脂肪酸あるいはエネルギー、アミノ酸のアラニン、エタノールへと変換することができる。  ピルビン酸誘導体のブロモピルビン酸は、抗がん剤候補として研究されている(ワールブルク仮説を参照)。 解糖系によるピルビン酸の産生解糖系において、ホスホエノールピルビン酸 (PEP) はピルビン酸キナーゼによってピルビン酸へと変換される。この反応は自発的かつ不可逆的である。糖新生では、ピルビン酸からPEPへの逆変換を触媒するために、ピルビン酸カルボキシラーゼとホスホエノールピルビン酸カルボキシキナーゼの2種の酵素が使われる。
アセチルCoAへの脱炭酸ピルビン酸デヒドロゲナーゼ複合体によるピルビン酸脱炭酸反応がアセチルCoAを産生する。
オキサロ酢酸へのカルボキシル化ピルビン酸カルボキシラーゼによるカルボキシル化はオキサロ酢酸を産生する。
アラニンへのアミノ基転移アラニントランスアミナーゼによるアミノ基転移でアラニンが産生する。
乳酸への還元
双方向伝達経路地図以下の遺伝子、タンパク質、代謝それぞれの記事をクリックできる [6]
クエン酸回路 編集
脚注
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||