|
Резонанс (хімія)Теорія резонансу, або поняття мезомерії[1], в хімії — спосіб опису електронної будови часток (молекул, радикалів, іонів), яким притаманна суттєва делокалізація електронів. Електронна будова таких часток погано описується одною структурною формулою із певним розподілом ковалентних зв'язків і неподілених електронних пар. Її описують як проміжну між набором таких структурних формул (резонансних або граничних структур), згідно із принципом суперпозиції. Теорія резонансу спирається на метод валентних зв'язків і фактично є способом візуалізації результатів його застосування. Разом із тим, вона (особливо в органічній хімії) часто дозволяє наближено передбачити або пояснити хімічні властивості взагалі без застосування методів квантової хімії, ґрунтуючись лише на поняттях валентності та електронегативності. Резонанс як «змішування» граничних структур відповідає збільшенню кількості параметрів пробної хвильової функції, отже, приводить до зниження обчислюваної електронної енергії, згідно із варіаційним принципом. Різницю в енергії між найважливішою граничною структурою та справжньою електронною будовою називають енергією резонансу; її можна оцінити непрямими методами із застосуванням адитивних схем.
Історичні відомостіТермін «резонанс» вперше запровадив Вернер Гейзенберг[2], розглядаючи взаємодію двох ідентичних квантових систем чи то двох електронів (які характеризуються власним ступенем свободи — спіном), певною мірою аналогічно до механічного резонансу. Посилання на статистику Фермі та на перестановки електронів дозволяють побачити в роботах Гейзенберга підґрунтя методу валентних зв'язків. Терміну «резонанс» було надано чіткого змісту дещо пізніше автором сучасного формулювання теорії резонансу Л. Полінгом (англійською видано зручну колекцію[3] обраних статей Полінга із короткими коментарями). В IV розділі статті про резонанс[4] зустрічається розрахунок молекули водню методом, який згодом отримав назву методу валентних зв'язків. Тут же вказано, що квантовохімічний резонанс не має класичного аналогу (причиною цього є відсутність класичного аналогу для принципу суперпозиції). Побудова граничних структурУ граничній структурі електрони поділено на такі дві групи:
В окремій резонансній структурі немає ані делокалізації електронів, ані поляризації зв'язків. Саме тому вона називається граничною: це ідеалізований опис, який не відповідає будь-чому в реальності. Електронна будова молекул описується комбінацією (сумішшю) резонансних структур. Як загальні правила побудови таких комбінацій, так і числову оцінку внеску кожної резонансної структури дає метод валентних зв'язків. Але часто можна перелічити найважливіші резонансні структури, спираючись лише на загальні хімічні уявлення: валентність, електронегативність. Для того, щоб скласти перелік найважливіших резонансних структур для певної частки (молекули, іона, радикалу), можна скористатися таким алгоритмом:
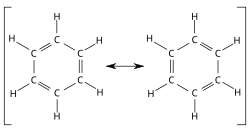
При цьому слід звертати увагу на дотримання валентності атомів (приміром, атом нітрогену утворює три ковалентні зв'язки, тобто тривалентний; якщо додати 1 електрон, неспарованими залишаться тільки 2 валентних електрони, тож негативно заряджений атом нітрогену двовалентний; аналогічно, якщо відняти 1 електрон, позитивно заряджений атом нітрогену буде чотиривалентним), а також на принципову можливість утворення зв'язків (так, атом нітрогену може утворити не більше ніж 4 зв'язки, ця кількість обмежена числом орбіталей на валентному електронному рівні). Для обрання переважного способу гетеролітичного розриву зв'язку із двох можливих слід взяти до уваги електронегативності елементів: електронній парі вигідніше залишитися у більш електронегативного атома. Кількість резонансних структур, навіть побудованих за такою спрощеною схемою, дуже швидко зростає зі збільшенням молекули. Тому зазвичай записують лише структури, в яких зміни відбуваються навколо певного атома чи групи атомів, цікавої досліднику. Перехід між двома резонансними структурами можна в разі потреби зобразити за допомогою вигнутих стрілочок. Переміщення електронної пари позначається стрілочкою звичайною (загостреною з обох боків, як-от →), одного електрона — загостреною лише з одного боку стрілочкою-гарпуном (⇀). Приклади в органічній хіміїСаме концепція резонансу дозволила пояснити особливі властивості бензену — ненасиченого вуглеводню, який поводить себе подібно до насичених. Такі властивості отримали назву «ароматичність».
Аналогічний резонанс із більшою кількістю важливих структур притаманний, приміром, поліконденсованим бензеновим вуглеводням.
Суттєва делокалізація π-електронів відбувається в багатьох структурах, приміром, в алільній (катіон, аніон, радикал). Кольорові стрілочки вказують перерозподіл електронів при переході від першої до другої резонансної структури. Теорія резонансу в певних випадках дозволяє пояснити реакційну здатність органічних сполук. Найвідоміший приклад — замісники-орієнтанти в бензеновому кільці.
Взагалі, теорія резонансу дозволяє пояснити взаємний вплив структурних фрагментів, який розповсюджується крізь електронну π-систему. Кілька прикладів для аміногрупи:
Приклади в неорганічній хіміїСтруктуру деяких сполук не вдається описати за допомогою одної канонічної структурної формули. В першу чергу це сполуки «п'ятивалентного» нітрогену: максимальна можлива валентність нітрогену становить чотири. Четвертий зв'язок атом нітрогену утворює за донорно-акцепторним механізмом (так само, як в іоні амонію), виступаючи як донор електронної пари, отже, набуваючи позитивного заряду.
Теорія резонансу часто дозволяє пояснити структурні особливості молекули та її реакційну здатність.
Кількісні оцінкиСпосіб кількісного оцінювання структурних величин цілком належить до методу валентних зв'язків, оскільки вимагає знання точних вагових коефіцієнтів, із якими кожна резонансна структура входить до суміші (резонансного гібриду). Із загальних міркувань ці вагові коефіцієнти можна обчислити лише в окремих симетричних випадках. Приміром, розглянемо наведений вище резонанс для нітрат-іона. Оскільки ми обмежилися лише трьома основними структурами і всі вони еквівалентні (за симетрією), кожній з них слід приписати ваговий множник 1/3. Тоді можна обчислити заряди атомів та порядки зв'язків як середньозважені величини:
Обрахований заряд атома нітрогену пояснює, чому нітратна кислота є сильним окисником, з нетиповими для кислот хімічними властивостями. Див. такожПримітки
Джерела
Посилання |
Portal di Ensiklopedia Dunia






![{\displaystyle {\ce {[S=C=N^{\ominus }<->\ ^{\ominus }\!S-C\!\equiv \!N]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c17afeea6f4d9ade72c079cda93666ad29706a18)



