–Ш—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В
–Ш—И–µ–Љ–ЄћБ—З–µ—Б–Ї–Є–є –Є–љ—Б—ГћБ–ї—М—В (–Є–љ—Д–∞—А–Ї—В –Љ–Њ–Ј–≥–∞) вАФ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П —Б –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ–Љ —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –µ–≥–Њ —Д—Г–љ–Ї—Ж–Є–є –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Ј–∞—В—А—Г–і–љ–µ–љ–Є—П –Є–ї–Є –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –Ї—А–Њ–≤–Є –Ї —В–Њ–Љ—Г –Є–ї–Є –Є–љ–Њ–Љ—Г –Њ—В–і–µ–ї—Г. –Ь–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї—С–љ–љ–Њ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –њ–Њ –њ—А–Є—З–Є–љ–µ —Б–љ–Є–ґ–µ–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞, —В—А–Њ–Љ–±–Њ–Ј–∞ –Є–ї–Є —Н–Љ–±–Њ–ї–Є–Є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —Б–Њ—Б—Г–і–Њ–≤, —Б–µ—А–і—Ж–∞ –Є–ї–Є –Ї—А–Њ–≤–Є[2]. –ѓ–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Є—З–Є–љ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Б—А–µ–і–Є –ї—О–і–µ–є[3]. –Ш—Б—В–Њ—А–Є—П –Є–Ј—Г—З–µ–љ–Є—П–Я–µ—А–≤—Л–Љ–Є —Б–Њ—Е—А–∞–љ–Є–≤—И–Є–Љ–Є—Б—П —Г–њ–Њ–Љ–Є–љ–∞–љ–Є—П–Љ–Є –Є–љ—Б—Г–ї—М—В–∞ —П–≤–ї—П—О—В—Б—П –Њ–њ–Є—Б–∞–љ–Є—П –Њ—В—Ж–∞ –Љ–µ–і–Є—Ж–Є–љ—Л –У–Є–њ–њ–Њ–Ї—А–∞—В–∞, –љ–∞–Ј—Л–≤–∞–≤—И–µ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ ¬Ђ–∞–њ–Њ–њ–ї–µ–Ї—Б–Є—П¬ї (–і—А.-–≥—А–µ—З. бЉАѕАќњѕАќїќЈќЊќѓќ±) вАФ —Г–і–∞—А[4]. –Ґ–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л –њ–Њ –≤–Њ–њ—А–Њ—Б—Г —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Є–љ—Б—Г–ї—М—В–∞ –±—Л–ї–Є –Ј–∞–ї–Њ–ґ–µ–љ—Л —И–≤–µ–є—Ж–∞—А—Б–Ї–Є–Љ –њ–∞—В–Њ–ї–Њ–≥–Њ–Љ XVII –≤–µ–Ї–∞ –Ш–Њ–≥–∞–љ–љ–Њ–Љ –ѓ–Ї–Њ–±–Њ–Љ –Т–µ–њ—Д–µ—А–Њ–Љ, –Њ–±–љ–∞—А—Г–ґ–Є–≤—И–Є–Љ, —З—В–Њ –њ—А–Є—З–Є–љ–Њ–є –∞–њ–Њ–њ–ї–µ–Ї—Б–Є–Є –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –Ј–∞–Ї—Г–њ–Њ—А–Ї–∞ —Б–Њ—Б—Г–і–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є–ї–Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —Б –≤–љ—Г—В—А–Є–Љ–Њ–Ј–≥–Њ–≤—Л–Љ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–µ–Љ[5]. –≠—В–Є–Љ –ґ–µ —Г—З—С–љ—Л–Љ –≤–њ–µ—А–≤—Л–µ –±—Л–ї–Є –Њ–њ–Є—Б–∞–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–ї—Г—З–∞–Є –Њ—З–µ–љ—М –±—Л—Б—В—А–Њ–≥–Њ —А–µ–≥—А–µ—Б—Б–∞ —Б–ї–∞–±–Њ—Б—В–Є –≤ –Ї–Њ–љ–µ—З–љ–Њ—Б—В—П—Е[6]. –Ю–і–љ–∞–Ї–Њ –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ —Б–Њ—Б—Г–і–Є—Б—В–∞—П –њ—А–Є—А–Њ–і–∞ –Є–љ—Б—Г–ї—М—В–Њ–≤ –±—Л–ї–∞ –њ—А–Є–Ј–љ–∞–љ–∞ –ї–Є—И—М –≤ –њ–µ—А–≤–Њ–є –њ–Њ–ї–Њ–≤–Є–љ–µ XIX —Б—В–Њ–ї–µ—В–Є—П. ¬Ђ–†–∞–Ј–Љ—П–≥—З–µ–љ–Є–µ¬ї –Љ–Њ–Ј–≥–∞ —А–∞–Ј–ї–Є—З–∞–ї–Є –Њ—В –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ ¬Ђ—Г–і–∞—А–∞¬ї, –≤–Љ–µ—Б—В–µ —Б —В–µ–Љ –Є—Е —Н—В–Є–Њ–ї–Њ–≥–Є—П –Њ—Б—В–∞–≤–∞–ї–∞—Б—М –і–Њ –Ї–Њ–љ—Ж–∞ –љ–µ—П—Б–љ–Њ–є. –†–∞–Ј–≤–Є—В–Є–µ –Ј–љ–∞–љ–Є–є –Њ–± –Є–љ—Б—Г–ї—М—В–µ –±—Л–ї–Њ –Љ–µ–і–ї–µ–љ–љ—Л–Љ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –≤ —Б–≤—П–Ј–Є —Б –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–Љ –Є–љ—В–µ—А–µ—Б–Њ–Љ —Г –Ј–љ–∞–Љ–µ–љ–Є—В—Л—Е –љ–µ–≤—А–Њ–ї–Њ–≥–Њ–≤ —В–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є. –Ґ–∞–Ї, –њ–µ—А–≤—Л–µ –≤–∞–ґ–љ—Л–µ —Б–≤–µ–і–µ–љ–Є—П –Њ –њ—А–Є—З–Є–љ–∞—Е –Є–љ—Б—Г–ї—М—В–∞ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –љ–µ –љ–µ–≤—А–Њ–ї–Њ–≥–∞–Љ–Є, –∞ –њ–∞—В–Њ–ї–Њ–≥–∞–Љ–Є –†–Њ–Ї–Є—В–∞–љ—Б–Ї–Є–Љ –Є –Т–Є—А—Е–Њ–≤–Њ–Љ[7]. –Т —Б–µ—А–µ–і–Є–љ–µ XIX –≤–µ–Ї–∞ —Е–Є—А—Г—А–≥–Њ–Љ –Є –∞–љ–∞—В–Њ–Љ–Њ–Љ –Ф–ґ–Њ–љ–Њ–Љ –Ы–Є–і–µ–ї–ї–Њ–Љ –±—Л–ї –њ—А–µ–і–ї–Њ–ґ–µ–љ —В–µ—А–Љ–Є–љ ¬Ђ–Ї—А–∞—Б–љ—Л–є –Є–љ—Д–∞—А–Ї—В¬ї, –њ–Њ–і—З—С—А–Ї–Є–≤–∞—О—Й–Є–є –≤—В–Њ—А–Є—З–љ–Њ—Б—В—М –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П –њ—А–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–Љ –Є–љ—Д–∞—А–Ї—В–µ[8]. –Ъ–ї–Є–љ–Є–Ї–Њ-—В–Њ–њ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ц—О–ї—П –Ф–µ–ґ–µ—А–Є–љ–∞, –Я—М–µ—А–∞ –Ь–∞—А–Є, –∞ —В–∞–Ї–ґ–µ –Є—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П –®–∞—А–ї—П –§—Г–∞ вАФ —А–Њ–і–Њ–љ–∞—З–∞–ї—М–љ–Є–Ї–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є–љ—Б—Г–ї—М—В–∞, –≤—Л–Ј–≤–∞–ї–Є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В—М –Є –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ–≤—А–Њ–ї–Њ–≥–Њ–≤ –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П[7]. –Т 1928 –≥–Њ–і—Г –Є–љ—Б—Г–ї—М—В –±—Л–ї —А–∞–Ј–і–µ–ї—С–љ –љ–∞ –Њ—В–і–µ–ї—М–љ—Л–µ —В–Є–њ—Л —Б —Г—З—С—В–Њ–Љ —Е–∞—А–∞–Ї—В–µ—А–∞ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є[6]. –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П–°–Њ–≥–ї–∞—Б–љ–Њ –Њ—Д–Є—Ж–Є–∞–ї—М–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–∞–Љ –Љ–Є–љ–Є—Б—В–µ—А—Б—В–≤–∞ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –†–Њ—Б—Б–Є–Є –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л, —Б–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –±–Њ–ї–µ–Ј–љ–µ–є —Б–Є—Б—В–µ–Љ—Л –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –Ј–∞–љ–Є–Љ–∞–µ—В –њ–µ—А–≤–Њ–µ –Љ–µ—Б—В–Њ –Є –њ—А–Є —Н—В–Њ–Љ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ —А–∞—Б—В–Є. –Т 2002 –≥–Њ–і—Г –≤—Б–ї–µ–і—Б—В–≤–Є–µ –±–Њ–ї–µ–Ј–љ–µ–є —Б–Є—Б—В–µ–Љ—Л –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –њ–Њ–≥–Є–±–ї–Њ 56,1 % –Њ—В –Њ–±—Й–µ–≥–Њ —З–Є—Б–ї–∞ —Г–Љ–µ—А—И–Є—Е[9]. –°–Љ–µ—А—В–љ–Њ—Б—В—М –Њ—В –Є–љ—Б—Г–ї—М—В–∞ –љ–∞—Е–Њ–і–Є—В—Б—П –љ–∞ –≤—В–Њ—А–Њ–Љ –Љ–µ—Б—В–µ, —Г—Б—В—Г–њ–∞—П –ї–Є—И—М —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞. –°—Г–Љ–Љ–∞—А–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –Є–љ—Б—Г–ї—М—В–∞ –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞ –Є–Љ–µ—О—В —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —А–Њ—Б—В—Г. –Т –†–Њ—Б—Б–Є–Є –љ–∞ 2001 –≥–Њ–і –Њ–љ –і–Њ—Б—В–Є–≥ 331 –љ–∞ 100 —В—Л—Б—П—З –љ–∞—Б–µ–ї–µ–љ–Є—П[9]. –Ш—И–µ–Љ–Є—З–µ—Б–Ї–Є–µ –Є–љ—Б—Г–ї—М—В—Л —Б–Њ—Б—В–∞–≤–ї—П—О—В 70вАФ85 % –Њ—В –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Є–љ—Б—Г–ї—М—В–∞, –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–µ –≤ –Љ–Њ–Ј–≥ вАФ 20вАФ25 %, —Б—Г–±–∞—А–∞—Е–љ–Њ–Є–і–∞–ї—М–љ–Њ–µ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–µ вАФ 5 %. –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е —В–Є–њ–Њ–≤ –Є–љ—Б—Г–ї—М—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 4:1[9]. –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П–°—Г—Й–µ—Б—В–≤—Г—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –Є–љ—Б—Г–ї—М—В–Њ–≤, –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Н—В–Є–Њ–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –∞—Б–њ–µ–Ї—В–Њ–≤, –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Ј–Њ–љ—Л –Є–љ—Д–∞—А–Ї—В–∞. –Я–Њ —В–µ–Љ–њ—Г —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –Є –µ–≥–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є
–Я–Њ —В—П–ґ–µ—Б—В–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ—Л—Е
–Я–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П (–Ь–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Ю–Э–Ь–Ъ, 2000)
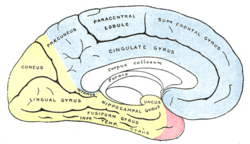
–Я–Њ –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Њ–Ј–≥–∞–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —В–Њ–њ–Є—З–µ—Б–Ї–Њ–є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Њ–є –Њ—З–∞–≥–Њ–≤–Њ–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є, –њ–Њ –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–Љ—Г –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–Љ—Г –±–∞—Б—Б–µ–є–љ—Г[12]:
–§–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ –Ъ –Њ—Б–љ–Њ–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ —А–Є—Б–Ї–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –Њ—В–љ–Њ—Б—П—В[16]:232:
–≠—В–Є–Њ–ї–Њ–≥–Є—П –Т –Ї–∞—З–µ—Б—В–≤–µ –ї–Њ–Ї–∞–ї—М–љ—Л—Е —Н—В–Є–Њ—В—А–Њ–њ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –Є–љ—Б—Г–ї—М—В–∞ —А–∞–Ј–ї–Є—З–∞—О—В[19]:
–Т –Ї–∞—З–µ—Б—В–≤–µ —Б–Є—Б—В–µ–Љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є—Е —А–∞–Ј–≤–Є—В–Є—О –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞, —А–∞–Ј–ї–Є—З–∞—О—В:
–Я–∞—В–Њ–≥–µ–љ–µ–Ј–Э–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –њ—А–Є—З–Є–љ—Л, –≤—Л–Ј–≤–∞–≤—И–µ–є –ї–Њ–Ї–∞–ї—М–љ—Г—О –Є—И–µ–Љ–Є—О –Љ–Њ–Ј–≥–∞, —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Ї–∞—Б–Ї–∞–і –њ–∞—В–Њ–±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї –љ–µ–Њ–±—А–∞—В–Є–Љ–Њ–Љ—Г –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є –њ–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ –љ–µ–Ї—А–Њ–Ј–∞ –Є –∞–њ–Њ–њ—В–Њ–Ј–∞[16]:235. –≠—В–∞ —Б–µ—А–Є—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–Њ–ї—Г—З–Є–ї–∞ –љ–∞–Ј–≤–∞–љ–Є–µ ¬Ђ–њ–∞—В–Њ–±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –Ї–∞—Б–Ї–∞–і¬ї –Є–ї–Є ¬Ђ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Ї–∞—Б–Ї–∞–і¬ї (–У—Г—Б–µ–≤ –Х. –Ш. —Б —Б–Њ–∞–≤—В.,1997). –Я—А–Њ—Ж–µ—Б—Б –Є—И–µ–Љ–Є–Є –Љ–Њ–Ј–≥–∞ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є, –Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –Њ–±—А–∞—В–Є–Љ—Л–є. –°—В–µ–њ–µ–љ—М –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≥–ї—Г–±–Є–љ—Л –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Б–љ–Є–ґ–µ–љ–Є—П —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –Ю–њ—В–Є–Љ–∞–ї—М–љ—Л–є –Њ–±—К—С–Љ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 50вАФ60 –Љ–ї –љ–∞ 100 –≥/–Љ–Є–љ. –Я—А–Є —Г—А–Њ–≤–љ–µ —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –љ–Є–ґ–µ 55 –Љ–ї –љ–∞ 100 –≥ –≤–µ—Й–µ—Б—В–≤–∞ –≤ –Љ–Є–љ—Г—В—Г –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ–µ—А–≤–Є—З–љ–∞—П —А–µ–∞–Ї—Ж–Є—П, –Ї–Њ—В–Њ—А–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —В–Њ—А–Љ–Њ–ґ–µ–љ–Є–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –±–µ–ї–Ї–Њ–≤ –≤ –љ–µ–є—А–Њ–љ–∞—Е вАФ ¬Ђ–Љ–∞—А–≥–Є–љ–∞–ї—М–љ–∞—П –Ј–Њ–љ–∞ –Є—И–µ–Љ–Є–Є¬ї. –Я—А–Є —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–µ –љ–Є–ґ–µ 35 –Љ–ї –љ–∞ 100 –≥/–Љ–Є–љ –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –≤ –Ї–ї–µ—В–Ї–∞—Е –Љ–Њ–Ј–≥–∞ –љ–∞—А—Г—И–∞—О—В—Б—П вАФ –≥–ї–Є–Ї–Њ–ї–Є–Ј (—А–∞—Б—Й–µ–њ–ї–µ–љ–Є–µ –≥–ї—О–Ї–Њ–Ј—Л) –Ј–∞–≤–µ—А—И–∞–µ—В—Б—П –њ–Њ –∞–љ–∞—Н—А–Њ–±–љ–Њ–Љ—Г –њ—Г—В–Є —Б –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ–Љ –ї–∞–Ї—В–∞—В–∞ –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤—Б–µ–≥–Њ 2 –Љ–Њ–ї–µ–Ї—Г–ї –Р–Ґ–§. –Я—А–Є –і–∞–ї—М–љ–µ–є—И–µ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Ї–Њ—А—Л –±–Њ–ї—М—И–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –∞ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ 10вАФ15 –Љ–ї –љ–∞ 100 –≥/–Љ–Є–љ –њ—А–Є–≤–Њ–і–Є—В –Ї –±—Л—Б—В—А—Л–Љ –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–Є–љ—Г—В –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –≤ –љ–µ–є—А–Њ–љ–∞—Е –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –Ј–Њ–љ—Л –Є–љ—Д–∞—А–Ї—В–∞ (¬Ђ—П–і—А–∞ –Є—И–µ–Љ–Є–Є¬ї). –Т —В–µ—З–µ–љ–Є–µ 6вАФ8 –Љ–Є–љ—Г—В –љ–µ–є—А–Њ–љ—Л –Њ—Б—В–∞—О—В—Б—П –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ—Л–Љ–Є –Є –Љ–Њ–≥—Г—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В—М —Б–≤–Њ–Є —Д—Г–љ–Ї—Ж–Є–Є –њ—А–Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П. –Я—А–Є –ї–Њ–Ї–∞–ї—М–љ–Њ–є –Є—И–µ–Љ–Є–Є –Љ–Њ–Ј–≥–∞ –≤–Њ–Ї—А—Г–≥ —Г—З–∞—Б—В–Ї–∞ —Б –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –Ј–Њ–љ–∞, –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–є –љ–Є–ґ–µ —Г—А–Њ–≤–љ—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –љ–Њ –≤—Л—И–µ –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–Њ–≥–∞ –љ–µ–Њ–±—А–∞—В–Є–Љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є вАФ ¬Ђ–Є—И–µ–Љ–Є—З–µ—Б–Ї–∞—П –њ–Њ–ї—Г—В–µ–љ—М¬ї –Є–ї–Є ¬Ђ–њ–µ–љ—Г–Љ–±—А–∞¬ї (–∞–љ–≥–ї. penumbra). –Т —Н—В–Њ–є –Ј–Њ–љ–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ—В—Б—Г—В—Б—В–≤—Г—О—В. –У–Є–±–µ–ї—М –Ї–ї–µ—В–Њ–Ї –≤ –Њ–±–ї–∞—Б—В–Є –њ–µ–љ—Г–Љ–±—А—Л –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞—Б—И–Є—А–µ–љ–Є—О –Ј–Њ–љ—Л –Є–љ—Д–∞—А–Ї—В–∞. –Ю–і–љ–∞–Ї–Њ —Н—В–Є –Ї–ї–µ—В–Ї–Є –≤ —В–µ—З–µ–љ–Є–µ –Њ–њ—А–µ–і–µ–ї—С–љ–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Љ–Њ–≥—Г—В —Б–Њ—Е—А–∞–љ—П—В—М —Б–≤–Њ—О –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М. –Ю–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –Ј–Њ–љ—Л –Є–љ—Д–∞—А–Ї—В–∞ –Ј–∞–≤–µ—А—И–∞–µ—В—Б—П —З–µ—А–µ–Ј 48вАФ56 —З–∞—Б–Њ–≤[12][16]:235-236[19]. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М ¬Ђ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–Ї–љ–∞¬ї вАФ –њ–µ—А–Є–Њ–і–∞, –≤ —В–µ—З–µ–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –љ–µ–є—А–Њ–љ–Њ–≤ –≤ –Њ–±–ї–∞—Б—В–Є ¬Ђ–Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ–ї—Г—В–µ–љ–Є¬ї вАФ —В–Њ—З–љ–Њ –љ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ. –•–Њ—В—П –і–ї—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –Ї–ї–µ—В–Њ–Ї —Н—В–Њ –≤—А–µ–Љ—П –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ 3вАФ6 —З–∞—Б–∞–Љ–Є, –љ–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Б—Г—В–Њ–Ї. –Я–Њ –°–Ї–≤–Њ—А—Ж–Њ–≤–Њ–є –Т. –Ш. (2000 –≥.), —Н—В–∞–њ–∞–Љ–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞ —П–≤–ї—П—О—В—Б—П: 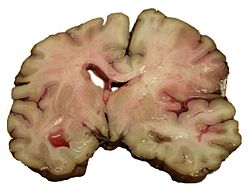 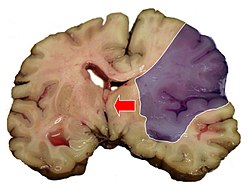
–Ш—И–µ–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П –Њ—В—С–Ї–Њ–Љ –Љ–Њ–Ј–≥–∞. –Ю—В—С–Ї –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —З–µ—А–µ–Ј –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ —А–∞–Ј–≤–Є—В–Є—П –ї–Њ–Ї–∞–ї—М–љ–Њ–є –Є—И–µ–Љ–Є–Є, –µ–≥–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –љ–∞–њ—А—П–Љ—Г—О –Ј–∞–≤–Є—Б–Є—В –Њ—В —А–∞–Ј–Љ–µ—А–Њ–≤ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Њ–Ј–≥–∞. –Я—Г—Б–Ї–Њ–≤—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Њ—В—С–Ї–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –≤ –Ї–ї–µ—В–Ї–Є –≤–Њ–і—Л –Є–Ј –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –љ–µ–і–Њ—Б—В–∞—В–Ї–∞ —Н–љ–µ—А–≥–Є–Є —Г –љ–µ–є—А–Њ–љ–Њ–≤ –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –Ї –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–Љ—Г –Њ—В—С–Ї—Г (—Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–Љ—Г) –њ—А–Є—Б–Њ–µ–і–Є–љ—П–µ—В—Б—П –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–є (–≤–∞–Ј–Њ–≥–µ–љ–љ—Л–є), –Ї–Њ—В–Њ—А—Л–є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –≥–Є–±–µ–ї—М—О –Ї–ї–µ—В–Њ—З–љ—Л—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е –≥–µ–Љ–∞—В–Њ-—Н–љ—Ж–µ—Д–∞–ї–Є—З–µ—Б–Ї–Є–є –±–∞—А—М–µ—А, —Б –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ–Љ –≤ –Ј–Њ–љ–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –љ–µ–і–Њ–Њ–Ї–Є—Б–ї–µ–љ–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤, —Д–Њ—А–Љ–Є—А—Г—О—Й–Є—Е—Б—П –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –∞–љ–∞—Н—А–Њ–±–љ–Њ–≥–Њ –≥–ї–Є–Ї–Њ–ї–Є–Ј–∞[20][21][22][23][24][25]. –Я–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –≥–µ–Љ–∞—В–Њ-—Н–љ—Ж–µ—Д–∞–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –±–∞—А—М–µ—А–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —В–∞–Ї–ґ–µ —В—А–∞–љ—Б—Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –Љ–Є–≥—А–∞—Ж–Є–µ–є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –≤ —В–Ї–∞–љ—М –Љ–Њ–Ј–≥–∞, –Ї–Њ—В–Њ—А—Л–µ –≤—Л–Ј—Л–≤–∞—О—В –≤ —В–Њ–Љ —З–Є—Б–ї–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ј–і–Њ—А–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є[26][27] –Т–љ—Г—В—А–Є- –Є –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–є –Њ—В—С–Ї –≤—Л–Ј—Л–≤–∞—О—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–±—К—С–Љ–∞ –Љ–Њ–Ј–≥–∞ –Є —А–∞–Ј–≤–Є—В–Є–µ –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є. –Я—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є –і–∞–≤–ї–µ–љ–Є—П –≤ –Њ–њ—А–µ–і–µ–ї—С–љ–љ–Њ–Љ –Њ—В–і–µ–ї–µ –Љ–Њ–Ј–≥–∞ –Є —З–µ—А–µ–њ–љ–Њ–є –Ї–Њ—А–Њ–±–Ї–Є (–њ–Њ—П–≤–ї–µ–љ–Є–µ –Њ–±–ї–∞—Б—В–Є –і–Є—Б—В–µ–љ–Ј–Є–Є) –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Б–Љ–µ—Й–µ–љ–Є–µ —З–∞—Б—В–µ–є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –і—А—Г–≥ –і—А—Г–≥–∞, —З—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ —В–µ—Е –Є–ї–Є –Є–љ—Л—Е –і–Є—Б–ї–Њ–Ї–∞—Ж–Є–Њ–љ–љ—Л—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤. –Т–Ї–ї–Є–љ–µ–љ–Є–µ –≤ –±–Њ–ї—М—И–Њ–µ –Ј–∞—В—Л–ї–Њ—З–љ–Њ–µ –Њ—В–≤–µ—А—Б—В–Є–µ –Љ–Є–љ–і–∞–ї–Є–љ –Љ–Њ–Ј–ґ–µ—З–Ї–∞ —Б–Њ —Б–і–∞–≤–ї–µ–љ–Є–µ–Љ –љ–Є–ґ–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –њ—А–Њ–і–Њ–ї–≥–Њ–≤–∞—В–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ вАФ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–∞—П –њ—А–Є—З–Є–љ–∞ —Б–Љ–µ—А—В–Є –±–Њ–ї—М–љ—Л—Е[12][19]. –Я–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –∞–љ–∞—В–Њ–Љ–Є—П–Ь–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Є —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –∞—В–∞–Ї–µ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –њ—А–Њ—П–≤–ї—П—О—В—Б—П —Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞–Љ–Є (—Б–њ–∞–Ј–Љ –∞—А—В–µ—А–Є–Њ–ї, –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –њ—А–Њ—Б–∞—З–Є–≤–∞–љ–Є–µ –Є—Е —Б—В–µ–љ–Њ–Ї, –њ–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–є –Њ—В—С–Ї –Є –µ–і–Є–љ–Є—З–љ—Л–µ –љ–µ–±–Њ–ї—М—И–Є–µ –≥–µ–Љ–Њ—А—А–∞–≥–Є–Є), –∞ —В–∞–Ї–ґ–µ –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Њ—З–∞–≥–Њ–≤ –Є–Ј–Љ–µ–љ—С–љ–љ–Њ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є (–Њ—В—С–Ї, –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≥—А—Г–њ–њ –Ї–ї–µ—В–Њ–Ї). –≠—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±—А–∞—В–Є–Љ—Л[28]:359. –Ш—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є–љ—Д–∞—А–Ї—В —П–≤–ї—П–µ—В—Б—П —Б–∞–Љ—Л–Љ —З–∞—Б—В—Л–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ (75 % —Б–ї—Г—З–∞–µ–≤) –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞. –Ю–љ –≤—Л–≥–ї—П–і–Є—В –Ї–∞–Ї –Њ—З–∞–≥ —Б–µ—А–Њ–≥–Њ —А–∞–Ј–Љ—П–≥—З–µ–љ–Є—П —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞. –Я—А–Є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б—А–µ–і–Є –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ–∞—Б—Б –љ–∞—Е–Њ–і—П—В –њ–Њ–≥–Є–±—И–Є–µ –љ–µ–є—А–Њ–љ—Л[28]:360. –У–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –Є–љ—Д–∞—А–Ї—В –Љ–Њ–Ј–≥–∞ –≤–љ–µ—И–љ–µ –њ–Њ—Е–Њ–ґ –љ–∞ –Њ—З–∞–≥ –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞, –Њ–і–љ–∞–Ї–Њ –Є–Љ–µ–µ—В –і—А—Г–≥–Њ–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П. –Я–µ—А–≤–Є—З–љ–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –Є—И–µ–Љ–Є—П –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞; –≤—В–Њ—А–Є—З–љ–Њ вАФ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–µ –≤ –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Г—О —В–Ї–∞–љ—М. –У–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –Є–љ—Д–∞—А–Ї—В —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ –Ї–Њ—А–µ –Љ–Њ–Ј–≥–∞, —А–µ–ґ–µ вАФ –≤ –њ–Њ–і–Ї–Њ—А–Ї–Њ–≤—Л—Е —Г–Ј–ї–∞—Е[28]:360. –Я—А–Є —Б–Љ–µ—И–∞–љ–љ–Њ–Љ –Є–љ—Д–∞—А–Ї—В–µ, –Ї–Њ—В–Њ—А—Л–є –≤—Б–µ–≥–і–∞ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ —Б–µ—А–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ –Љ–Њ–Ј–≥–∞, –Љ–Њ–ґ–љ–Њ –љ–∞–є—В–Є —Г—З–∞—Б—В–Ї–Є –Ї–∞–Ї –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ, —В–∞–Ї –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Д–∞–Ї—В–∞[28]:360. –°–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —Г –±–Њ–ї—М–љ—Л—Е –ї—О–і–µ–є —Б–Ї–ї–∞–і—Л–≤–∞–µ—В—Б—П –Є–Ј –Њ–±—Й–µ–Љ–Њ–Ј–≥–Њ–≤–Њ–є –Є –Њ—З–∞–≥–Њ–≤–Њ–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є. –Я—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ —В–µ—З–µ–љ–Є–µ –Є–љ—Б—Г–ї—М—В–∞ (–њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–µ –Є–ї–Є —Б—В—Г–њ–µ–љ–µ–Њ–±—А–∞–Ј–љ–Њ–µ –љ–∞—А–∞—Б—В–∞–љ–Є–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —З–∞—Б–Њ–≤ –Є–ї–Є –і–љ–µ–є) –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г 20 % –±–Њ–ї—М–љ—Л—Е –ї—О–і–µ–є —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –≤ –Ї–∞—А–Њ—В–Є–і–љ–Њ–Љ –±–∞—Б—Б–µ–є–љ–µ –Є —Г 40 % –±–Њ–ї—М–љ—Л—Е —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –≤ –≤–µ—А—В–µ–±—А–Њ–±–∞–Ј–Є–ї—П—А–љ–Њ–Љ –±–∞—Б—Б–µ–є–љ–µ. –Ю–љ–Њ —З–∞—Й–µ –≤—Л–Ј–≤–∞–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —А–∞–Ј–Љ–µ—А–∞ –≤–љ—Г—В—А–Є–∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —В—А–Њ–Љ–±–∞, –њ–Њ–≤—В–Њ—А–љ—Л–Љ–Є —Н–Љ–±–Њ–ї–Є—П–Љ–Є, –љ–∞—А–∞—Б—В–∞–љ–Є–µ–Љ –Њ—В—С–Ї–∞ –Љ–Њ–Ј–≥–∞, –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–є —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–µ–є –Є–љ—Д–∞—А–Ї—В–∞ –Є–ї–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –µ–≥–Њ —А–∞–Ј–Љ–µ—А–Њ–≤ –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–љ–Є–ґ–µ–љ–Є—П —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П[16]:237. –Я–Њ–≤—Л—И–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г 70вАФ80 % –±–Њ–ї—М–љ—Л—Е –ї—О–і–µ–є –≤ –њ–µ—А–≤—Л–µ –і–љ–Є –Є–љ—Б—Г–ї—М—В–∞. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –Є–Ј –љ–Є—Е –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Б–њ–Њ–љ—В–∞–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–∞–≤–ї–µ–љ–Є—П. –Ґ—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М –≤—Л–Ј–≤–∞–љ–Њ –Њ—В—С–Ї–Њ–Љ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ —Б—В—А–µ—Б—Б–Њ–Љ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–Љ —А–∞–Ј–≤–Є—В–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П[16]:237. –Ю–±—Й–µ–Љ–Њ–Ј–≥–Њ–≤—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л–Ю–±—Й–µ–Љ–Њ–Ј–≥–Њ–≤—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П –Є–љ—Б—Г–ї—М—В–Њ–≤ —Б—А–µ–і–љ–µ–є –Є —В—П–ґ—С–ї–Њ–є —Б—В–µ–њ–µ–љ–Є. –•–∞—А–∞–Ї—В–µ—А–љ—Л –љ–∞—А—Г—И–µ–љ–Є—П —Б–Њ–Ј–љ–∞–љ–Є—П вАФ –Њ–≥–ї—Г—И—С–љ–љ–Њ—Б—В—М, —Б–Њ–љ–ї–Є–≤–Њ—Б—В—М –Є–ї–Є –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є–µ, –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –њ–Њ—В–µ—А—П —Б–Њ–Ј–љ–∞–љ–Є—П. –Ґ–Є–њ–Є—З–љ–∞ –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П —В–Њ—И–љ–Њ—В–Њ–є –Є–ї–Є —А–≤–Њ—В–Њ–є, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, –±–Њ–ї—М –≤ –≥–ї–∞–Ј–љ—Л—Е —П–±–ї–Њ–Ї–∞—Е, —Г—Б–Є–ї–Є–≤–∞—О—Й–∞—П—Б—П –њ—А–Є –і–≤–Є–ґ–µ–љ–Є–Є –≥–ї–∞–Ј. –†–µ–ґ–µ –љ–∞–±–ї—О–і–∞—О—В—Б—П —Б—Г–і–Њ—А–Њ–ґ–љ—Л–µ —П–≤–ї–µ–љ–Є—П. –Т–Њ–Ј–Љ–Њ–ґ–љ—Л –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞: —З—Г–≤—Б—В–≤–Њ –ґ–∞—А–∞, –њ–Њ–≤—Л—И–µ–љ–љ–∞—П –њ–Њ—В–ї–Є–≤–Њ—Б—В—М, –Њ—Й—Г—Й–µ–љ–Є–µ —Б–µ—А–і—Ж–µ–±–Є–µ–љ–Є—П, —Б—Г—Е–Њ—Б—В—М –≤–Њ —А—В—Г[29][30]. –Ю—З–∞–≥–Њ–≤–∞—П –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞–Э–∞ —Д–Њ–љ–µ –Њ–±—Й–µ–Љ–Њ–Ј–≥–Њ–≤—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–љ—Б—Г–ї—М—В–∞ –њ–Њ—П–≤–ї—П—О—В—Б—П –Њ—З–∞–≥–Њ–≤—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –њ–Њ—А–∞–ґ–µ–љ–Є—П –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ —Г –Ї–∞–ґ–і–Њ–≥–Њ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —В–µ–Љ, –Ї–∞–Ї–Њ–є —Г—З–∞—Б—В–Њ–Ї –Љ–Њ–Ј–≥–∞ –њ–Њ—Б—В—А–∞–і–∞–ї –Є–Ј-–Ј–∞ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–∞—О—Й–µ–≥–Њ –µ–≥–Њ —Б–Њ—Б—Г–і–∞.  –Э–∞—А—Г—И–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –±–∞—Б—Б–µ–є–љ–µ –≤–љ—Г—В—А–µ–љ–љ–µ–є —Б–Њ–љ–љ–Њ–є –∞—А—В–µ—А–Є–Є (–Т–°–Р)–Ч–∞–Ї—Г–њ–Њ—А–Ї–∞ –Т–°–Р –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –≤ –µ—С –љ–∞—З–∞–ї–µ (–Њ–±–ї–∞—Б—В–Є –±–Є—Д—Г—А–Ї–∞—Ж–Є–Є –Њ–±—Й–µ–є —Б–Њ–љ–љ–Њ–є –∞—А—В–µ—А–Є–Є), –Ї–∞—А–Њ—В–Є–і–љ–Њ–Љ —Б–Є—Д–Њ–љ–µ –Є —Б—Г–њ—А–∞–Ї–ї–Є–љ–Њ–Є–і–љ–Њ–є —З–∞—Б—В–Є (—З–∞—Й–µ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —В—А–Њ–Љ–±–∞ –љ–∞ –Љ–µ—Б—В–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–Є) –Є –њ—А–Њ—В–µ–Ї–∞—В—М –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ –њ—А–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –Ї–Њ–ї–ї–∞—В–µ—А–∞–ї—М–љ–Њ–Љ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є–Є —З–µ—А–µ–Ј –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–є –Ї—А—Г–≥ –±–Њ–ї—М—И–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –і—А—Г–≥–Є–µ –∞–љ–∞—Б—В–Њ–Љ–Њ–Ј—Л. –Я—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –Ї–Њ–ї–ї–∞—В–µ—А–∞–ї—М–љ–Њ–Љ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є–Є –Є–ї–Є –≤ —Б–ї—Г—З–∞—П—Е –∞—А—В–µ—А–Є–Њ-–∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —Н–Љ–±–Њ–ї–Є–Є –≤–Њ–Ј–љ–Є–Ї–∞—О—В –≥–µ–Љ–Є- –Є–ї–Є –Љ–Њ–љ–Њ–њ–ї–µ–≥–Є—П, –∞—Д–∞–Ј–Є—П –Є –і—А—Г–≥–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞[16]:237. –†–∞–Ј–≤–Є—В–Є–µ –Љ–Њ–љ–Њ–Ї—Г–ї—П—А–љ–Њ–є —Б–ї–µ–њ–Њ—В—Л –љ–∞ –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ–µ –Є –≥–µ–Љ–Є–њ–∞—А–µ–Ј–∞ –љ–∞ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ–є (–Њ–Ї—Г–ї–Њ–њ–Є—А–∞–Љ–Є–і–љ—Л–є —Б–Є–љ–і—А–Њ–Љ) вАФ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ (–њ–∞—В–Њ–≥–љ–Њ–Љ–Њ–љ–Є—З–љ–Њ) –і–ї—П —Б—В–µ–љ–Њ–Ј–∞ –Є–ї–Є –Ј–∞–Ї—Г–њ–Њ—А–Ї–Є –Т–°–Р[31]. –Ю–Ї–Ї–ї—О–Ј–Є—П –њ–µ—А–µ–і–љ–µ–є –≤–Њ—А—Б–Є–љ—З–∞—В–Њ–є (—Е–Њ—А–Њ–Є–і–∞–ї—М–љ–Њ–є) –∞—А—В–µ—А–Є–Є–Ч–∞–Ї—Г–њ–Њ—А–Ї–∞ –њ–µ—А–µ–і–љ–µ–є –≤–Њ—А—Б–Є–љ—З–∞—В–Њ–є –∞—А—В–µ—А–Є–Є, –Њ—В—Е–Њ–і—П—Й–µ–є –Њ—В –Т–°–Р –і–Њ –µ—С –і–µ–ї–µ–љ–Є—П –љ–∞ —Б—А–µ–і–љ—О—О –Є –њ–µ—А–µ–і–љ—О—О –Љ–Њ–Ј–≥–Њ–≤—Л–µ –∞—А—В–µ—А–Є–Є –Њ–±—Л—З–љ–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –≤ –≤–Є–і–µ –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ–Њ–≥–Њ (–љ–∞ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ–є —Б—В–Њ—А–Њ–љ–µ –Њ—В –Њ–Ї–Ї–ї—О–Ј–Є–Є) –≥–µ–Љ–Є–њ–∞—А–µ–Ј–∞ –Є –≥–µ–Љ–Є–≥–Є–њ–∞–ї–≥–µ–Ј–Є–Є –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤–љ—Г—В—А–µ–љ–љ–µ–є –Ї–∞–њ—Б—Г–ї—Л. –Ш–љ–Њ–≥–і–∞ –Њ—В–Љ–µ—З–∞—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П —А–µ—З–Є –Є –Ј—А–Є—В–µ–ї—М–љ–Њ-–њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–є –Њ—А–Є–µ–љ—В–∞—Ж–Є–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є—И–µ–Љ–Є–Є —В–∞–ї–∞–Љ—Г—Б–∞, –∞ —В–∞–Ї–ґ–µ –≥–µ–Љ–Є–∞–љ–Њ–њ—Б–Є–Є –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –ї–∞—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–ї–µ–љ—З–∞—В–Њ–≥–Њ —В–µ–ї–∞[16]:238. –Ю–Ї–Ї–ї—О–Ј–Є—П –њ–µ—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є (–Я–Ь–Р)–Х—Б–ї–Є –Ј–∞–Ї—Г–њ–Њ—А–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–ї–∞ –і–Њ –Њ—В—Е–Њ–ґ–і–µ–љ–Є—П –њ–µ—А–µ–і–љ–µ–є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є –∞—А—В–µ—А–Є–Є, —В–Њ –Њ–љ–∞ –Љ–Њ–ґ–µ—В –њ—А–Њ—В–µ–Ї–∞—В—М –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Ї–Њ–ї–ї–∞—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Є–Ј –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ–є –Я–Ь–Р[16]:238. –Ш–љ—Д–∞—А–Ї—В –њ—А–Є –Њ–Ї–Ї–ї—О–Ј–Є–Є –Я–Ь–Р –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ—Л–Љ –њ–∞—А–∞–ї–Є—З–Њ–Љ –љ–Є–ґ–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –Є —Е–≤–∞—В–∞—В–µ–ї—М–љ—Л–Љ —А–µ—Д–ї–µ–Ї—Б–Њ–Љ. –•–∞—А–∞–Ї—В–µ—А–љ—Л —Б–њ–∞—Б—В–Є—З–љ–Њ—Б—В—М —Б –љ–µ–њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л–Љ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ–Љ –њ–∞—Б—Б–Є–≤–љ—Л–Љ –і–≤–Є–ґ–µ–љ–Є—П–Љ, –∞–±—Г–ї–Є—П, –∞–±–∞–Ј–Є—П, –њ–µ—А—Б–µ–≤–µ—А–∞—Ж–Є–Є –Є –љ–µ–і–µ—А–ґ–∞–љ–Є–µ –Љ–Њ—З–Є[31]. –Ч–∞–Ї—Г–њ–Њ—А–Ї–∞ –≤–Њ–Ј–≤—А–∞—В–љ–Њ–є –∞—А—В–µ—А–Є–Є –У—О–±–љ–µ—А–∞, –≤–µ—В–≤–Є –Я–Ь–Р, –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ—А–∞–ґ–µ–љ–Є—О —Е–≤–Њ—Б—В–∞—В–Њ–≥–Њ —П–і—А–∞ –Є –њ–µ—А–µ–і–љ–µ–є –љ–Њ–ґ–Ї–Є –≤–љ—Г—В—А–µ–љ–љ–µ–є –Ї–∞–њ—Б—Г–ї—Л, —З—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ—Л–є –њ–∞—А–µ–Ј —А—Г–Ї–Є, –ї–Є—Ж–∞ –Є —П–Ј—Л–Ї–∞, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–є—Б—П –і–Є–Ј–∞—А—В—А–Є–µ–є[16]:238. –Ю–Ї–Ї–ї—О–Ј–Є—П —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є (–°–Ь–Р)–Ф–ї—П –Њ–Ї–Ї–ї—О–Ј–Є–Є –°–Ь–Р —Е–∞—А–∞–Ї—В–µ—А–љ—Л –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ—Л–µ –≥–µ–Љ–Є–њ–ї–µ–≥–Є—П, –≥–µ–Љ–Є–≥–Є–њ–µ—Б—В–µ–Ј–Є—П, –≥–Њ–Љ–Њ–љ–Є–Љ–љ–∞—П –≥–µ–Љ–Є–∞–љ–Њ–њ—Б–Є—П. –Э–∞–±–ї—О–і–∞–µ—В—Б—П –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ—Л–є –њ–∞—А–µ–Ј –≤–Ј–Њ—А–∞. –Я—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –і–Њ–Љ–Є–љ–∞–љ—В–љ–Њ–≥–Њ –њ–Њ–ї—Г—И–∞—А–Є—П —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –∞—Д–∞–Ј–Є—П, –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –љ–µ–і–Њ–Љ–Є–љ–∞–љ—В–љ–Њ–≥–Њ вАФ –∞–њ—А–∞–Ї—Б–Є—П, –∞–≥–љ–Њ–Ј–Є—П, –∞—Б–Њ–Љ–∞—В–Њ–≥–љ–Њ–Ј–Є—П –Є –∞–љ–Њ–Ј–Њ–≥–љ–Њ–Ј–Є—П. –Я—А–Є –Њ–Ї–Ї–ї—О–Ј–Є–Є –Њ—В–і–µ–ї—М–љ—Л—Е –≤–µ—В–≤–µ–є –°–Ь–Р –≤–Њ–Ј–љ–Є–Ї–∞—О—В –њ–∞—А—Ж–Є–∞–ї—М–љ—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л: –Љ–Њ—В–Њ—А–љ–∞—П –∞—Д–∞–Ј–Є—П –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ—Л–Љ –њ–∞—А–µ–Ј–Њ–Љ –≤–µ—А—Е–љ–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –Є –ї–Є—Ж–µ–≤–Њ–≥–Њ –љ–µ—А–≤–∞ –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –≤–µ—А—Е–љ–Є—Е –≤–µ—В–≤–µ–є; —Б–µ–љ—Б–Њ—А–љ–∞—П –∞—Д–∞–Ј–Є—П –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –љ–Є–ґ–љ–Є—Е –≤–µ—В–≤–µ–є[31]. –Ю–Ї–Ї–ї—О–Ј–Є—П –Ј–∞–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є (–Ч–Ь–Р)–Я—А–Є –Њ–Ї–Ї–ї—О–Ј–Є–Є –Ј–∞–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —А–∞–Ј–≤–Є—В–Є–µ –Њ–і–љ–Њ–≥–Њ –Є–Ј –і–≤—Г—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤: —Б–Њ—З–µ—В–∞–љ–Є–µ –≥–Њ–Љ–Њ–љ–Є–Љ–љ–Њ–є –≥–µ–Љ–Є–∞–љ–Њ–њ—Б–Є–Є —Б –∞–Љ–љ–µ–Ј–Є–µ–є, –і–Є—Б–ї–µ–Ї—Б–Є–µ–є (–±–µ–Ј –і–Є—Б–≥—А–∞—Д–Є–Є) –Є –ї—С–≥–Ї–Њ–≥–Њ –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≥–µ–Љ–Є–њ–∞—А–µ–Ј–∞ —Б –≥–µ–Љ–Є–∞–љ–µ—Б—В–µ–Ј–Є–µ–є; –ї–Є–±–Њ —Б–Њ—З–µ—В–∞–љ–Є–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Є–њ—Б–Є–ї–∞—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –≥–ї–∞–Ј–Њ–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ—А–≤–∞ —Б –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ—Л–Љ–Є –љ–µ–њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л–Љ–Є –і–≤–Є–ґ–µ–љ–Є—П–Љ–Є –Є –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –≥–µ–Љ–Є–њ–ї–µ–≥–Є–µ–є –Є–ї–Є –∞—В–∞–Ї—Б–Є–µ–є[31]. –Э–∞—А—Г—И–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –±–∞–Ј–Є–ї—П—А–љ–Њ–є –Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ—Л—Е –∞—А—В–µ—А–Є—П—Е–Я—А–Є –Њ–Ї–Ї–ї—О–Ј–Є–Є –≤–µ—В–≤–µ–є –±–∞–Ј–Є–ї—П—А–љ–Њ–є –∞—А—В–µ—А–Є–Є (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–Њ–≤–љ—П –њ–Њ—А–∞–ґ–µ–љ–Є—П) –љ–∞–±–ї—О–і–∞—О—В—Б—П: –Є–њ—Б–Є–ї–∞—В–µ—А–∞–ї—М–љ–∞—П –∞—В–∞–Ї—Б–Є—П; –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ–∞—П –≥–µ–Љ–Є–њ–ї–µ–≥–Є—П –Є –≥–µ–Љ–Є–∞–љ–µ—Б—В–µ–Ј–Є—П; –Є–њ—Б–Є–ї–∞—В–µ—А–∞–ї—М–љ—Л–є –њ–∞—А–µ–Ј –≤–Ј–Њ—А–∞ —Б –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ–Њ–є –≥–µ–Љ–Є–њ–ї–µ–≥–Є–µ–є; –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Є–њ—Б–Є–ї–∞—В–µ—А–∞–ї—М–љ–Њ–≥–Њ –ї–Є—Ж–µ–≤–Њ–≥–Њ –љ–µ—А–≤–∞; –Љ–µ–ґ—К—П–і–µ—А–љ–∞—П –Њ—Д—В–∞–ї—М–Љ–Њ–њ–ї–µ–≥–Є—П; –љ–Є—Б—В–∞–≥–Љ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ–Љ, —В–Њ—И–љ–Њ—В–Њ–є –Є —А–≤–Њ—В–Њ–є; —И—Г–Љ –≤ —Г—И–∞—Е –Є –њ–Њ—В–µ—А—П —Б–ї—Г—Е–∞; –љ—С–±–љ–∞—П –Љ–Є–Њ–Ї–ї–Њ–љ–Є—П –Є –Њ—Б—Ж–Є–ї–ї–Њ–њ—Б–Є—П. –Я—А–Є –Њ–Ї–Ї–ї—О–Ј–Є–Є —Б—В–≤–Њ–ї–∞ –±–∞–Ј–Є–ї—П—А–љ–Њ–є –∞—А—В–µ—А–Є–Є –Є–ї–Є –Њ–±–µ–Є—Е –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ—Л—Е –∞—А—В–µ—А–Є–є –љ–∞–±–ї—О–і–∞–µ—В—Б—П —В–µ—В—А–∞–њ–ї–µ–≥–Є—П, –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–Є–є –≥–Њ—А–Є–Ј–Њ–љ—В–∞–ї—М–љ—Л–є –њ–∞—А–µ–Ј –≤–Ј–Њ—А–∞, –Ї–Њ–Љ–∞ –Є–ї–Є —Б–Є–љ–і—А–Њ–Љ –Є–Ј–Њ–ї—П—Ж–Є–Є (¬Ђ–Ј–∞–њ–µ—А—В–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞¬ї, –∞–љ–≥–ї. locked-in state). –Я–Њ—А–∞–ґ–µ–љ–Є–µ –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є –Є–ї–Є –Ј–∞–і–љ–µ–љ–Є–ґ–љ–µ–є –Љ–Њ–Ј–ґ–µ—З–Ї–Њ–≤–Њ–є –∞—А—В–µ—А–Є–Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–Є–љ–і—А–Њ–Љ–∞–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ—А–Њ–і–Њ–ї–≥–Њ–≤–∞—В–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –ї–∞—В–µ—А–∞–ї—М–љ—Л–є —Б–Є–љ–і—А–Њ–Љ –њ—А–Њ–і–Њ–ї–≥–Њ–≤–∞—В–Њ–≥–Њ –Љ–Њ–Ј–≥–∞: –љ–Є—Б—В–∞–≥–Љ, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, —В–Њ—И–љ–Њ—В–∞, —А–≤–Њ—В–∞, –і–Є—Б—Д–∞–≥–Є—П, –Њ—Е—А–Є–њ–ї–Њ—Б—В—М –≥–Њ–ї–Њ—Б–∞; –Є–њ—Б–Є–ї–∞—В–µ—А–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –љ–∞ –ї–Є—Ж–µ, —Б–Є–љ–і—А–Њ–Љ –У–Њ—А–љ–µ—А–∞ –Є –∞—В–∞–Ї—Б–Є—П; –Ї–Њ–љ—В—А–ї–∞—В–µ—А–∞–ї—М–љ–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ –±–Њ–ї–µ–≤–Њ–є –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є[31]. –Ы–∞–Ї—Г–љ–∞—А–љ—Л–µ –Є–љ—Д–∞—А–Ї—В—Л–Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤–Њ–Ј–љ–Є–Ї–∞—О—В –Њ–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ–Њ, —А–µ–ґ–µ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –њ–Њ—Б—В–µ–њ–µ–љ–љ—Л–Љ –љ–∞—А–∞—Б—В–∞–љ–Є–µ–Љ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є. –†–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ —Б–Њ–Ј–љ–∞–љ–Є—П, —Н–њ–Є–ї–µ–њ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–њ–∞–і–Ї–Є, –љ–∞—А—Г—И–µ–љ–Є—П –≤—Л—Б—И–Є—Е –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є –Є –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П –љ–µ —Е–∞—А–∞–Ї—В–µ—А–љ—Л. –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Њ–њ–Є—Б–∞–љ–Њ –±–Њ–ї–µ–µ 25 —Б–Є–љ–і—А–Њ–Љ–Њ–≤, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –ї–∞–Ї—Г–љ–∞—А–љ—Л–µ –Є–љ—Д–∞—А–Ї—В—Л, –Њ–і–љ–∞–Ї–Њ –љ–∞–Є–±–Њ–ї–µ–µ —В–Є–њ–Є—З–љ—Л –Є —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞—О—В—Б—П –њ—П—В—М –µ–≥–Њ –≤–∞—А–Є–∞–љ—В–Њ–≤:
 1. –Ј–∞–і–љ—П—П —Б–њ–Є–љ–∞–ї—М–љ–∞—П –≤–µ–љ–∞ 2. –њ–µ—А–µ–і–љ—П—П —Б–њ–Є–љ–∞–ї—М–љ–∞—П –≤–µ–љ–∞ 3. –Ј–∞–і–љ–µ–ї–∞—В–µ—А–∞–ї—М–љ–∞—П —Б–њ–Є–љ–∞–ї—М–љ–∞—П –≤–µ–љ–∞ 4. —А–∞–і–Є–Ї—Г–ї—П—А–љ–∞—П (–Є–ї–Є —Б–µ–≥–Љ–µ–љ—В–∞—А–љ–∞—П) –≤–µ–љ–∞ 5. –Ј–∞–і–љ–Є–µ —Б–њ–Є–љ–∞–ї—М–љ—Л–µ –∞—А—В–µ—А–Є–Є 6. –њ–µ—А–µ–і–љ—П—П —Б–њ–Є–љ–∞–ї—М–љ–∞—П –∞—А—В–µ—А–Є—П 7. —А–∞–і–Є–Ї—Г–ї—П—А–љ–∞—П (–Є–ї–Є —Б–µ–≥–Љ–µ–љ—В–∞—А–љ–∞—П) –∞—А—В–µ—А–Є—П .
–Ф–ї—П –љ–µ–±–Њ–ї—М—И–Є—Е, –≥–ї—Г–±–Є–љ–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –Є–љ—Д–∞—А–Ї—В–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–љ—Л –ї–∞–Ї—Г–љ–∞—А–љ—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л: –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–є –Љ–Њ—В–Њ—А–љ—Л–є –Є–љ—Б—Г–ї—М—В, –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–є —Б–µ–љ—Б–Њ—А–љ—Л–є –Є–љ—Б—Г–ї—М—В, —Б–Є–љ–і—А–Њ–Љ –і–Є–Ј–∞—А—В—А–Є—П/–љ–µ–ї–Њ–≤–Ї–∞—П –Ї–Є—Б—В—М, –Є–њ—Б–Є–ї–∞—В–µ—А–∞–ї—М–љ–∞—П –∞—В–∞–Ї—Б–Є—П —Б –њ–∞—А–µ–Ј–Њ–Љ –љ–Њ–≥–Є[31]. –°–њ–Є–љ–∞–ї—М–љ—Л–є –Є–љ—Б—Г–ї—М—В–°–њ–Є–љ–∞–ї—М–љ—Л–є –Є–љ—Б—Г–ї—М—В вАФ –Њ—Б—В—А–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ —Б–њ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П —Б –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ–Љ —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ–Љ –µ–≥–Њ —Д—Г–љ–Ї—Ж–Є–є. –Х–≥–Њ —З–∞—Б—В–Њ—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 1 % –Њ—В –≤—Б–µ—Е –Є–љ—Б—Г–ї—М—В–Њ–≤[32]. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ–Њ–≤—А–µ–ґ–і—С–љ–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —Г—А–Њ–≤–љ—П –µ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≤–Њ–Ј–љ–Є–Ї–∞—О—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–µ –Є –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –≤ —А—Г–Ї–∞—Е –Є –љ–Њ–≥–∞—Е —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є, –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є —В–∞–Ј–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤. –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞–Ф–ї—П –≤—Л–±–Њ—А–∞ –ї–µ—З–µ–±–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є —А–µ—И–∞—О—Й–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В —А–∞–љ–љ—П—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ, –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–Њ–≤ –Є —Б—Г–±–∞—А–∞—Е–љ–Њ–Є–і–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П. –Ґ–Њ—З–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —Е–∞—А–∞–Ї—В–µ—А–∞ –Є–љ—Б—Г–ї—М—В–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –ї–Є—И—М –≤ 70 % —Б–ї—Г—З–∞–µ–≤[12]. –§–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ј–∞–љ–Є–Љ–∞–µ—В –≤–∞–ґ–љ–Њ–µ –Љ–µ—Б—В–Њ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ. –Ю—Ж–µ–љ–Є–≤–∞—О—В—Б—П —Д—Г–љ–Ї—Ж–Є–Є –і—Л—Е–∞–љ–Є—П –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л (–≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М, –љ–∞—А—Г—И–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є –і–ї—П —Н–Ї—Б—В—А–µ–љ–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є), —З—В–Њ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–њ—А–µ–і–µ–ї–Є—В—М –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є —Е–∞—А–∞–Ї—В–µ—А –Є–љ—Б—Г–ї—М—В–∞ (–љ–∞–ї–Є—З–Є–µ –∞—А–Є—В–Љ–Є–Є –Є —И—Г–Љ–Њ–≤ –≤ —Б–µ—А–і—Ж–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М –Ї–∞—А–і–Є–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В; —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Є–є —И—Г–Љ –≤ –Њ–±–ї–∞—Б—В–Є –±–Є—Д—Г—А–Ї–∞—Ж–Є–Є –Њ–±—Й–µ–є —Б–Њ–љ–љ–Њ–є –∞—А—В–µ—А–Є–Є –≥–Њ–≤–Њ—А–Є—В –Њ –µ—С —Б—В–µ–љ–Њ–Ј–µ; —А–∞–Ј–љ–Є—Ж–∞ –≤ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–Љ –і–∞–≤–ї–µ–љ–Є–Є –Є –њ—Г–ї—М—Б–µ –љ–∞ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Л—Е —Б—В–Њ—А–Њ–љ–∞—Е —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —Б—В–µ–љ–Њ–Ј–µ –і—Г–≥–Є –∞–Њ—А—В—Л –Є –њ–Њ–і–Ї–ї—О—З–Є—З–љ—Л—Е –∞—А—В–µ—А–Є–є). –Я—А–Є –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Њ—Б–Љ–Њ—В—А–µ —Г—В–Њ—З–љ—П–µ—В—Б—П —Б–Њ—Б—В–Њ—П–љ–Є–µ –Є —Г—А–Њ–≤–µ–љ—М —Б–Њ–Ј–љ–∞–љ–Є—П; –њ—А–Њ–≤–Њ–і–Є—В—Б—П —В–Њ–њ–Є—З–µ—Б–Ї–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Њ—З–∞–≥–Њ–≤—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Љ–Њ–Ј–≥–∞. –Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ –њ—А–Є—З–Є–љ–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –і—Г–њ–ї–µ–Ї—Б–љ–Њ–µ –Є —В—А–Є–њ–ї–µ–Ї—Б–љ–Њ–µ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–µ—Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є –≥–Њ–ї–Њ–≤—Л –Є –Љ–Њ–Ј–≥–Њ–≤—Л—Е –∞—А—В–µ—А–Є–є. –≠—В–Њ—В –Љ–µ—В–Њ–і –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М —Б–Њ–љ–љ—Л–µ –∞—А—В–µ—А–Є–Є, –Є—Б—Б–ї–µ–і–Њ–≤–∞—В—М –Ї—А–Њ–≤–Њ—В–Њ–Ї —Б –њ–Њ–Љ–Њ—Й—М—О —Б–њ–µ–Ї—В—А–∞–ї—М–љ–Њ–є –і–Њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є–Є. –Ґ—А–∞–љ—Б–Ї—А–∞–љ–Є–∞–ї—М–љ–∞—П –і–Њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–њ—А–µ–і–µ–ї–Є—В—М —Б–Њ—Б—В–Њ—П–љ–Є–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ—Л—Е –∞—А—В–µ—А–Є–є, –Ї–Њ—Б–≤–µ–љ–љ–Њ –Њ—Ж–µ–љ–Є—В—М —Б–Ї–Њ—А–Њ—Б—В—М –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –љ–Є—Е. –Э–∞–Є–±–Њ–ї–µ–µ –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —П–≤–ї—П–µ—В—Б—П –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–±–љ–∞—А—Г–ґ–Є—В—М —Б—Г–ґ–µ–љ–Є—П –њ—А–Њ—Б–≤–µ—В–∞, –∞–љ–µ–≤—А–Є–Ј–Љ—Л –Є –і—А—Г–≥–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –∞—А—В–µ—А–Є—П—Е. –Р–љ–≥–Є–Њ–≥—А–∞—Д–Є—О, —Г—З–Є—В—Л–≤–∞—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, —Б–ї–µ–і—Г–µ—В –њ—А–Є–Љ–µ–љ—П—В—М –њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ. –Ґ–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –љ–µ—В—А–∞–≤–Љ–∞—В–Є—З–љ—Л–µ –Љ–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤—Л—Е —Б–Њ—Б—Г–і–Њ–≤ вАФ –Ь–†-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П –Є–ї–Є –Ъ–Ґ-–∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П. –Я–Њ–Љ–Є–Љ–Њ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –≤—Л—И–µ –Љ–µ—В–Њ–і–Њ–≤, –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –≠–Ъ–У –Є —Н—Е–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞—Д–Є–Є –і–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –ї—С–≥–Ї–Є—Е –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –ї—С–≥–Њ—З–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–∞—Б–њ–Є—А–∞—Ж–Є–Њ–љ–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П, –Ґ–≠–Ы–Р –Є –і—А.), –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–Њ–≤ –Ї—А–Њ–≤–Є –Є –і—А—Г–≥–Є—Е —А—Г—В–Є–љ–љ—Л—Е –∞–љ–∞–ї–Є–Ј–Њ–≤, –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ—Л, –≥–∞–Ј–Њ–≤–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –Ї—А–Њ–≤–Є. –Ю–±—П–Ј–∞—В–µ–ї—М–љ–∞ –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є—П —В–µ—А–∞–њ–µ–≤—В–∞ –Є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–∞[12][33]. –Ь–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–∞—П –Є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –Я—А–Є –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Њ–Ј–≥–∞ –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П (–Ь–†–Ґ) —П–≤–ї—П–µ—В—Б—П –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ —А–∞–љ–љ–µ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є, —З–µ–Љ –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П. –Э–∞ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е —В–Њ–Љ–Њ–≥—А–∞–Љ–Љ–∞—Е –≤ 80 % –љ–∞–±–ї—О–і–µ–љ–Є–є –≤ –њ–µ—А–≤—Л–µ 24 —З–∞—Б–∞ –њ–Њ—Б–ї–µ —А–∞–Ј–≤–Є—В–Є—П –Њ–Ї–Ї–ї—О–Ј–Є–Є —Б–Њ—Б—Г–і–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Г–ґ–µ —Б—В–∞–љ–Њ–≤—П—В—Б—П –≤–Є–і–Є–Љ—Л–Љ–Є. –Я—А–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Ї–Њ–љ—В—А–∞—Б—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –Њ–±–ї–∞—Б—В–Є –Є—И–µ–Љ–Є–Є –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –љ–∞ –Ґ1-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П—Е, —З—В–Њ –≥–Њ–≤–Њ—А–Є—В –Њ —Б–љ–Є–ґ–µ–љ–Є–Є –≤ –љ–Є—Е —Б–Ї–Њ—А–Њ—Б—В–Є –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –≠—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Њ–≥—Г—В —А–∞–Ј–≤–Є–≤–∞—В—М—Б—П —Г–ґ–µ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ –Њ–Ї–Ї–ї—О–Ј–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ї —А–∞–љ–љ–Є–Љ –Ь–†-–њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ –Њ—В–љ–Њ—Б—П—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–∞—А–µ–љ—Е–Є–Љ—Л –Љ–Њ–Ј–≥–∞, –≤—Л—А–∞–ґ–∞—О—Й–Є–µ—Б—П –≤ —Г—В–Њ–ї—Й–µ–љ–Є–Є –Є–Ј–≤–Є–ї–Є–љ –Є —Б—Г–ґ–µ–љ–Є–Є —Б—Г–±–∞—А–∞—Е–љ–Њ–Є–і–∞–ї—М–љ—Л—Е –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤ –љ–∞ –Ґ1-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е —В–Њ–Љ–Њ–≥—А–∞–Љ–Љ–∞—Е, –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Є–≥–љ–∞–ї–∞ –≤ —А–µ–ґ–Є–Љ–µ –Ґ2. –≠—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±—Л—З–љ–Њ –≤—Л—П–≤–ї—П—О—В—Б—П –љ–µ —А–∞–љ–µ–µ —З–µ–Љ —З–µ—А–µ–Ј 8 —З–∞—Б–Њ–≤ –њ–Њ—Б–ї–µ –Њ–Ї–Ї–ї—О–Ј–Є–Є[34]:347-348. –Я—А–Є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є (–Ъ–Ґ) –≥–Њ–ї–Њ–≤—Л –Њ–±–ї–∞—Б—В—М –≥–Є–њ–Њ–і–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є (–њ–Њ–љ–Є–ґ–µ–љ–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є) —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е –≤—Л—П–≤–ї—П–µ—В—Б—П —З–µ—А–µ–Ј 12вАФ24 —З —Б –Љ–Њ–Љ–µ–љ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞. –Я—А–Є –Љ–µ–љ—М—И–µ–є –і–∞–≤–љ–Њ—Б—В–Є –њ–Њ—А–∞–ґ–µ–љ–Є–µ –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –њ–Њ—З—В–Є –≤ –њ–Њ–ї–Њ–≤–Є–љ–µ —Б–ї—Г—З–∞–µ–≤. –Э–µ–±–Њ–ї—М—И–Є–µ –њ–Њ —А–∞–Ј–Љ–µ—А—Г –Є–љ—Д–∞—А–Ї—В—Л –Љ–Њ–Ј–≥–∞ (–Є–љ—Д–∞—А–Ї—В—Л –≤ –Љ–Њ–Ј–≥–Њ–≤–Њ–Љ —Б—В–≤–Њ–ї–µ –Є –ї–∞–Ї—Г–љ–∞—А–љ—Л–µ –Є–љ—Д–∞—А–Ї—В—Л) —З–∞—Б—В–Њ –љ–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В—Б—П –љ–∞ –±–µ—Б–Ї–Њ–љ—В—А–∞—Б—В–љ—Л—Е –Ъ–Ґ-–Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П—Е –і–∞–ґ–µ –љ–∞ 3вАФ4-–є –і–µ–љ—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–≤ –њ–µ—А–Є–Њ–і, –Ї–Њ–≥–і–∞ –Є–љ—Д–∞—А–Ї—В—Л –і—А—Г–≥–Є—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–є –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А—Г—О—В—Б—П –љ–∞–Є–ї—Г—З—И–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ), –Њ–і–љ–∞–Ї–Њ –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –њ—А–Є –Ъ–Ґ —Б –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ –Ъ–Ґ —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–Љ —Г—Б–Є–ї–µ–љ–Є–µ–Љ —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –љ–µ—П—Б–љ—Л—Е —Б–ї—Г—З–∞—П—Е –і–ї—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є[35]. –Т —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 3 —Б—Г—В–Њ–Ї —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Њ–Ј–≥–∞ –љ–∞ –Ь–†–Ґ —Б –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Є–Љ–µ—А–љ–Њ –≤ 30 % —Б–ї—Г—З–∞–µ–≤ –Љ–Њ–ґ–µ—В –љ–∞–±–ї—О–і–∞—В—М—Б—П —Г—Б–Є–ї–µ–љ–Є–µ —Б–Є–≥–љ–∞–ї–∞ –Њ—В —Б–Њ—Б–µ–і–љ–µ–є —В–≤—С—А–і–Њ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є. –Ю–і–љ–∞–Ї–Њ –≤ 10вАФ20 % –љ–∞–±–ї—О–і–µ–љ–Є–є –Ь–† —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П –љ–µ –≤—Л—П–≤–ї—П–µ—В –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є. –Ь–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–∞—П –∞–љ–≥–Є–Њ–≥—А–∞—Д–Є—П –≤—Л—П–≤–ї—П–µ—В –Њ–Ї–Ї–ї—О–Ј–Є—О –Є–ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Б—В–µ–љ–Њ–Ј –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Ї—А—Г–њ–љ—Л—Е –∞—А—В–µ—А–Є–∞–ї—М–љ—Л—Е —Б—В–≤–Њ–ї–Њ–≤[34]:348. –Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ–Њ—П–≤–Є–ї–Є—Б—М –љ–Њ–≤—Л–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –≤ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —А–∞–љ–љ–Є–µ —Б—А–Њ–Ї–Є. –Ъ –љ–Є–Љ –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є —В—А–∞–љ—Б–Ї—А–∞–љ–Є–∞–ї—М–љ—Г—О –і–Њ–њ–ї–µ—А–Њ–≥—А–∞—Д–Є—О, –Ь–†-—Б–њ–µ–Ї—В—А–Њ—Б–Ї–Њ–њ–Є—О, –і–Є—Д—Д—Г–Ј–Є–Њ–љ–љ—Л–µ –Є –њ–µ—А—Д—Г–Ј–Є–Њ–љ–љ—Л–µ –Ь–†-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П[34]:348. –Т –њ–Њ–і–Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –њ—А–Њ–Є—Б—Е–Њ–і—П—В –і–∞–ї—М–љ–µ–є—И–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П. –Т —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 2вАФ4 –і–љ–µ–є –љ–∞—З–Є–љ–∞–µ—В —Г–Љ–µ–љ—М—И–∞—В—М—Б—П –Є –Љ–Њ–ґ–µ—В —Б–Њ–≤—Б–µ–Љ –Є—Б—З–µ–Ј–љ—Г—В—М –≤–љ—Г—В—А–Є–∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –Є –Љ–µ–љ–Є–љ–≥–µ–∞–ї—М–љ–Њ–µ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–µ —Г—Б–Є–ї–µ–љ–Є–µ. –Т—Б–ї–µ–і –Ј–∞ —Н—В–Є–Љ –љ–∞—З–Є–љ–∞–µ—В –≤—Л—П–≤–ї—П—В—М—Б—П –њ–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ–Њ–µ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞ —Б—З—С—В —Г—Б–Є–ї–Є–≤–∞—О—Й–µ–≥–Њ—Б—П –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –≥–µ–Љ–∞—В–Њ-—Н–љ—Ж–µ—Д–∞–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –±–∞—А—М–µ—А–∞. –Ъ–Њ–љ—В—А–∞—Б—В–љ–Њ–µ —Г—Б–Є–ї–µ–љ–Є–µ –љ–∞ 3вАФ4 —Б—Г—В –Є–Љ–µ–µ—В —В–Є–њ–Є—З–љ—Г—О –Ї–∞—А—В–Є–љ—Г, –њ–Њ–≤—В–Њ—А—П—О—Й—Г—О –Ї–Њ–љ—Д–Є–≥—Г—А–∞—Ж–Є—О –Є–Ј–≤–Є–ї–Є–љ, —Б–Њ—Е—А–∞–љ—П—П—Б—М –Є–љ–Њ–≥–і–∞ –і–Њ 8вАФ10 –љ–µ–і[34]:348-349. –Ю—В—С–Ї –≤ –Ј–Њ–љ–µ –Є—И–µ–Љ–Є–Є –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б–Є–≥–љ–∞–ї–∞ –љ–∞ –Ґ1-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б–Є–≥–љ–∞–ї–∞ –љ–∞ –Ґ2-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П—Е. –Ш–љ–Њ–≥–і–∞ –≤ —В–µ—З–µ–љ–Є–µ –≤—В–Њ—А–Њ–є –љ–µ–і–µ–ї–Є –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –Є–љ—Д–∞—А–Ї—В–∞ –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є —Б–Є–≥–љ–∞–ї–∞ –љ–∞ –Ґ2-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е —В–Њ–Љ–Њ–≥—А–∞–Љ–Љ–∞—Е. –Э–∞—З–∞–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Є–є —Б–Є–≥–љ–∞–ї –Љ–Њ–ґ–µ—В –і–∞–ґ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О –Є—Б—З–µ–Ј–љ—Г—В—М. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ –≤ —Н—В–Є —Б—А–Њ–Ї–Є –Ь–†-—В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є —Б –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–Љ —Г—Б–Є–ї–µ–љ–Є–µ–Љ –≤—Л—П–≤–ї—П–µ—В –Њ–±—И–Є—А–љ—Л–µ –њ–Њ–ї—П –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –Ї–Њ–љ—В—А–∞—Б—В–∞, –і–∞–ґ–µ –≤ —В–µ—Е –Ј–Њ–љ–∞—Е, –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В—Б—П –∞–±—Б–Њ–ї—О—В–љ–Њ –Є–љ—В–∞–Ї—В–љ—Л–Љ–Є –љ–∞ –Ґ2-–Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П—Е[34]:349. –Т —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Д–∞—А–Ї—В–∞ –љ–∞ –Ъ–Ґ –Є –Ь–†–Ґ –≤ –±–∞—Б—Б–µ–є–љ–µ –Њ–Ї–Ї–ї—О–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—Г–і–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Е–Њ—А–Њ—И–Њ –Њ—В–≥—А–∞–љ–Є—З–µ–љ–љ–∞—П –Ј–Њ–љ–∞ —Н–љ—Ж–µ—Д–∞–ї–Њ–Љ–∞–ї—П—Ж–Є–Є, –Є–Љ–µ—О—Й–∞—П –њ–ї–Њ—В–љ–Њ—Б—В—М –љ–∞ –Ъ–Ґ –Є —Б–Є–≥–љ–∞–ї –љ–∞ –Ь–†–Ґ, –њ—А–Є–±–ї–Є–ґ–∞—О—Й–Є–є—Б—П –њ–Њ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ –Ї –ї–Є–Ї–≤–Њ—А—Г. –Ю—В–Љ–µ—З–∞–µ—В—Б—П —А–∞—Б—И–Є—А–µ–љ–Є–µ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –њ–Њ —Б–Њ—Б–µ–і—Б—В–≤—Г —Б—Г–±–∞—А–∞—Е–љ–Њ–Є–і–∞–ї—М–љ—Л—Е —Й–µ–ї–µ–є –Љ–Њ–Ј–≥–∞ –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ —Г—З–∞—Б—В–Ї–∞ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б –њ–Њ–і—В—П–≥–Є–≤–∞–љ–Є–µ–Љ –њ—А–Є–ї–µ–ґ–∞—Й–Є—Е –µ—С –Њ—В–і–µ–ї–Њ–≤ –Ї –Ј–Њ–љ–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞. –Ъ–Њ–љ—В—А–∞—Б—В–љ–Њ–µ —Г—Б–Є–ї–µ–љ–Є–µ –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Є—Б—З–µ–Ј–∞–µ—В —З–µ—А–µ–Ј 8вАФ10 –љ–µ–і–µ–ї—М –њ–Њ—Б–ї–µ —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П[34]:349. –Ы–∞–Ї—Г–љ–∞—А–љ—Л–µ –Є–љ—Д–∞—А–Ї—В—Л –Є–Љ–µ—О—В –Њ–Ї—А—Г–≥–ї—Г—О —Д–Њ—А–Љ—Г, –љ–Є–Ј–Ї–Є–є —Б–Є–≥–љ–∞–ї –љ–∞ –Ґ1-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е –Є –њ–Њ–≤—Л—И–µ–љ–љ—Г—О –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М —Б–Є–≥–љ–∞–ї–∞ –љ–∞ –Ґ2-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е —В–Њ–Љ–Њ–≥—А–∞–Љ–Љ–∞—Е. –Ш–Љ–µ—О—В —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–µ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –≤ –≥–ї—Г–±–Њ–Ї–Є—Е –Њ—В–і–µ–ї–∞—Е –Љ–Њ–Ј–≥–∞[34]:349-350. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞–Ф–ї—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Љ–Њ–ґ–µ—В –њ–Њ—В—А–µ–±–Њ–≤–∞—В—М—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –ї—О–Љ–±–∞–ї—М–љ–Њ–є –њ—Г–љ–Ї—Ж–Є–Є. –Ы—О–Љ–±–∞–ї—М–љ–∞—П –њ—Г–љ–Ї—Ж–Є—П –њ—А–Њ–≤–Њ–і–Є—В—Б—П –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є вАФ —Б–Љ–µ—Й–µ–љ–Є—П —Б—А–µ–і–Є–љ–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А –њ–Њ –і–∞–љ–љ—Л–Љ –Ъ–Ґ –Є/–Є–ї–Є –Ь–†–Ґ, –ї–Є–±–Њ —Б–Љ–µ—Й–µ–љ–Є—П —Б—А–µ–і–Є–љ–љ–Њ–≥–Њ –Ь-–≠—Е–Њ –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 5 –Љ–Љ (—З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –і–Є—Б–ї–Њ–Ї–∞—Ж–Є–Є –Љ–Њ–Ј–≥–∞)[36], —Б–Њ–≥–ї–∞—Б–љ–Њ —Н—Е–Њ—Н–љ—Ж–µ—Д–∞–ї–Њ–≥—А–∞—Д–Є–Є. –Я—А–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ –Є–љ—Б—Г–ї—М—В–µ —Б–њ–Є–љ–љ–Њ–Љ–Њ–Ј–≥–Њ–≤–∞—П –ґ–Є–і–Ї–Њ—Б—В—М –Њ–±—Л—З–љ–Њ –њ—А–Њ–Ј—А–∞—З–љ–∞, —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –±–µ–ї–Ї–∞ –Є –Ї–ї–µ—В–Њ—З–љ—Л—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤.
–Ы–µ—З–µ–љ–Є–µ–Т—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ —Б –Є–љ—Б—Г–ї—М—В–Њ–Љ, –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –µ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞, –њ—А–Њ–≤–Њ–і–Є—В—Б—П –±–∞–Ј–Є—Б–љ–∞—П —В–µ—А–∞–њ–Є—П. –Я–Њ–Љ–Є–Љ–Њ —Н—В–Њ–≥–Њ, –њ—А–Њ–≤–Њ–і–Є—В—Б—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —Б —Г—З—С—В–Њ–Љ –µ–≥–Њ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–і—В–Є–њ–∞[33]. –С–∞–Ј–Є—Б–љ–∞—П —В–µ—А–∞–њ–Є—П–Ґ–∞–Ї—В–Є–Ї–∞ –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞–њ—А–∞–≤–ї–µ–љ–∞ –љ–∞ –Њ–±—Й–Є–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П –њ–Њ —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –Є –ї–µ—З–µ–љ–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є[12]. –Ь–Є–љ–Є—Б—В–µ—А—Б—В–≤–Њ–Љ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –†–§ (2000) –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Њ—Б—В—А—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Б–ї–µ–і—Г—О—Й–µ–є –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є:
–°–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П–°–Њ–≥–ї–∞—Б–љ–Њ –Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –Љ–Є–љ–Є—Б—В–µ—А—Б—В–≤–∞ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –Ј–∞ 2000 –≥–Њ–і[33], —Б—В—А–∞—В–µ–≥–Є—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ —А–∞–љ–љ–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–і—В–Є–њ–∞ –Є–љ—Б—Г–ї—М—В–∞. –Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є–љ—Ж–Є–њ—Л –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤–Ї–ї—О—З–∞—О—В:
–Ю—Б–љ–Њ–≤–љ—Л–µ –Љ–µ—В–Њ–і—Л —А–µ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є:
–Ю—Б–љ–Њ–≤–љ—Л–µ –Љ–µ—В–Њ–і—Л –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—Ж–Є–Є:
–Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞ —В—А–µ–±—Г—О—В –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –ї–µ—З–µ–±–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ –±–Њ—А—М–±—Г —Б –Њ—В—С–Ї–Њ–Љ –Љ–Њ–Ј–≥–∞. –Я—А–Њ—В–Є–≤–Њ–Њ—В–µ—З–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –Є–љ—Б—Г–ї—М—В–∞—Е –≤–Ї–ї—О—З–∞–µ—В:
–Ґ—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П–Я—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є –±–Њ–ї—М–љ–Њ–≥–Њ –≤ —Б—А–Њ–Ї–Є –і–Њ 6 —З–∞—Б–Њ–≤ —Б –Љ–Њ–Љ–µ–љ—В–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ –Є–љ—Б—Г–ї—М—В–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —Б —Ж–µ–ї—М—О –ї–Є–Ј–Є—Б–∞ —В—А–Њ–Љ–±–∞ –Є–ї–Є —Н–Љ–±–Њ–ї–∞ –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ –Њ–љ–∞ –љ–∞–Є–±–Њ–ї–µ–µ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–∞ –њ—А–Є –Њ—Б—В—А–Њ–є –Ј–∞–Ї—Г–њ–Њ—А–Ї–µ —Б—А–µ–і–љ–µ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Є–ї–Є –±–∞–Ј–Є–ї—П—А–љ–Њ–є –∞—А—В–µ—А–Є–Є, –Ї–∞—А–і–Є–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Њ–Љ —В–Є–њ–µ –Є–љ—Б—Г–ї—М—В–∞[16]:250. –° 1995 –њ–Њ 2000 –≥–Њ–і –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ 10 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є[38][39][40][41][42][43][44][45][46][47] –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ –Є–љ—Б—Г–ї—М—В–µ. –°–Њ–≥–ї–∞—Б–љ–Њ –њ—А–Њ–≤–µ–і—С–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Є –Њ–њ—А–∞–≤–і–∞–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–Ї–∞–љ–µ–≤–Њ–≥–Њ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ (–≤ –і–Њ–Ј–µ 0,9 –Љ–≥/–Ї–≥, –Љ–∞–Ї—Б–Є–Љ—Г–Љ 90 –Љ–≥; 10 % –≤–≤–Њ–і–Є—В—Б—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ —Б—В—А—Г–є–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 1 –Љ–Є–љ—Г—В—Л, –∞ 90 % вАФ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ —З–∞—Б–∞) –≤ –њ–µ—А–≤—Л–µ 3 —З–∞—Б–∞ –њ–Њ—Б–ї–µ –њ–Њ—П–≤–ї–µ–љ–Є—П –њ–µ—А–≤—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–∞ –њ—А–Є –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –∞–љ–∞–Љ–љ–µ–Ј–µ. –Я–Њ—Б–ї–µ 3 –Є –і–Њ 6 —З–∞—Б–Њ–≤ –Њ—В –њ–Њ—П–≤–ї–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–љ—Б—Г–ї—М—В–∞ –њ–Њ–Ї–∞–Ј–∞–љ —В–Њ–ї—М–Ї–Њ –Є–љ—В—А–∞–∞—А—В–µ—А–Є–∞–ї—М–љ—Л–є (—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є) —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б —В–Ї–∞–љ–µ–≤—Л–Љ –∞–Ї—В–Є–≤–∞—В–Њ—А–Њ–Љ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б—В—А–µ–њ—В–Њ–Ї–Є–љ–∞–Ј—Л –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤ —Б–≤—П–Ј–Є —Б –љ–µ–і–Њ–њ—Г—Б—В–Є–Љ—Л–Љ —А–Є—Б–Ї–Њ–Љ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–є –Є —Б–Љ–µ—А—В–Є[48][49]. –Я—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –і–∞–љ–љ–Њ–Љ—Г –≤–Є–і—Г —В–µ—А–∞–њ–Є–Є –≤–Ї–ї—О—З–∞—О—В[16][50]:250:
–Р–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л –Є –∞–љ—В–Є–∞–≥–≥—А–µ–≥–∞–љ—В—Л–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –≤ –ї–µ—З–µ–љ–Є–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤–Њ. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–∞—Е[16]:250-251 –Њ–љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П —Б —Ж–µ–ї—М—О –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є –њ–Њ–≤—В–Њ—А–љ–Њ–є —Н–Љ–±–Њ–ї–Є–Є. –Ю–і–љ–∞–Ї–Њ –њ—А–Њ–≤–µ–і—С–љ–љ—Л–µ –љ–∞ –Њ—Б–љ–Њ–≤–µ –њ—А–Є–љ—Ж–Є–њ–Њ–≤ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ –≤ –њ–µ—А–≤—Л–µ 2 —Б—Г—В–Њ–Ї –Є–љ—Б—Г–ї—М—В–∞. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≥–µ–њ–∞—А–Є–љ–∞ –Є –і—А—Г–≥–Є—Е –њ–Њ–і–Њ–±–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–Є–≤–µ–ї–Є—А—Г–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–є –Є –і—А—Г–≥–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (—Г—А–Њ–≤–µ–љ—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Р)[51]. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–Њ–≤ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –і–∞–љ–љ—Л–Љ–Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л[51]. –° –Є—Е –њ–Њ–Љ–Њ—Й—М—О —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Є —А–Є—Б–Ї —Н–Љ–±–Њ–ї–Є–Є —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤. –Я—А–Є–Љ–µ–љ—П—О—В—Б—П –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ –њ–Њ 75вАФ300 –Љ–≥/—Б—Г—В –Є–ї–Є –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї—М –њ–Њ 75 –Љ–≥/—Б—Г—В. –Э–Њ–Њ—В—А–Њ–њ—Л–Т –ї–µ—З–µ–љ–Є–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–µ –і–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П –њ–Њ—А–∞–ґ–µ–љ–Є—П –Љ–Њ–Ј–≥–∞ –Є –Њ–±—А–∞—В–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –≤–Њ–Ј–љ–Є–Ї—И–Є—Е –≤ –љ—С–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є–є. –Э–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–Є—Б–Ї—Г—В–∞–±–µ–ї—М–љ–∞. –Я—А–Њ–≤–µ–і—С–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ –і–∞–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Њ–± —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –Є–ї–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –љ–Њ–Њ—В—А–Њ–њ–Њ–≤[52][53][54][55]. –Ю–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–±–ї–µ–Љ–∞ –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–µ —А–µ—И–µ–љ–∞. –Э–Њ–Њ—В—А–Њ–њ—Л –љ–∞—З–Є–љ–∞—О—В –љ–∞–Ј–љ–∞—З–∞—В—М –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л –Є–љ—Б—Г–ї—М—В–∞ (–≤ –њ–µ—А–Є–Њ–і ¬Ђ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–Ї–љ–∞¬ї). –¶–µ—А–µ–±—А–Њ–ї–Є–Ј–Є–љ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –≤ –±–Њ–ї—М—И–Є—Е –і–Њ–Ј–∞—Е (20вАФ50 –Љ–ї/—Б—Г—В), –≤–≤–Њ–і–Є–Љ—Л—Е 1 –Є–ї–Є 2 —А–∞–Ј–∞ –љ–∞ 100вАФ200 –Љ–ї –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ (–≤ —В–µ—З–µ–љ–Є–µ 60вАФ90 –Љ–Є–љ) –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 10вАФ15 –і–љ–µ–є. –Я–Є—А–∞—Ж–µ—В–∞–Љ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –≤ –і–Њ–Ј–µ 4вАФ12 –≥/—Б—Г—В[16]:251. –Р–љ—В–∞–≥–Њ–љ–Є—Б—В—Л –Ї–∞–ї—М—Ж–Є—П–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤–∞–Ј–Њ–∞–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—Б–љ–∞–±–ґ–µ–љ–Є—П –≤ –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–Ї–∞–љ–Є, —Е–Њ—В—П –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Њ–Љ–љ–Є—В–µ–ї—М–љ–∞. –Я—А–Є —Н—В–Њ–Љ –љ–µ–ї—М–Ј—П –Є—Б–Ї–ї—О—З–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ —Д–µ–љ–Њ–Љ–µ–љ–∞ ¬Ђ–≤–љ—Г—В—А–Є–Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Њ–±–Ї—А–∞–і—Л–≤–∞–љ–Є—П¬ї, –њ—А–Њ—П–≤–ї—П—О—Й–µ–≥–Њ—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Ј–Њ–љ–µ –Є—И–µ–Љ–Є–Є –Ј–∞ —Б—З—С—В —Г—Б–Є–ї–µ–љ–Є—П –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Ј–і–Њ—А–Њ–≤—Л—Е —В–Ї–∞–љ—П—Е. –¶–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Њ–њ—А–∞–≤–і—Л–≤–∞–µ—В—Б—П –Є—Е –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –і–≤—Г—Е –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –≤–∞–Ј–Њ–∞–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П. –Э–Є–Љ–Њ–і–Є–њ–Є–љ (–љ–Є–Љ–Њ—В–Њ–њ) –≤–≤–Њ–і—П—В –≤ –і–Њ–Ј–µ 4вАФ10 –Љ–≥ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ 2 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є –≤ —В–µ—З–µ–љ–Є–µ 7вАФ10 –і–љ–µ–є, –њ–Њ—Б–ї–µ —Н—В–Њ–≥–Њ (–Є–ї–Є —Б –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П) –љ–∞–Ј–љ–∞—З–∞—О—В –≤–љ—Г—В—А—М –њ–Њ 30вАФ60 –Љ–≥ 3вАФ4 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є –і—А—Г–≥–Є—Е –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Є–Њ–љ–Њ–≤ –Ї–∞–ї—М—Ж–Є—П[16]:251. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ –Є–љ—Б—Г–ї—М—В–µ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В[56]. –У–µ–Љ–Њ–і–Є–ї—О—Ж–Є—П –Є —Г–ї—Г—З—И–µ–љ–Є–µ —А–µ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –Ї—А–Њ–≤–Є–° —Ж–µ–ї—М—О –≥–µ–Љ–Њ–і–Є–ї—О—Ж–Є–Є –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л —А–µ–Њ–њ–Њ–ї–Є–≥–ї—О–Ї–Є–љ –Є–ї–Є –і—А—Г–≥–Є–µ –Є–љ—Д—Г–Ј–Є–Њ–љ–љ—Л–µ —А–∞—Б—В–≤–Њ—А—Л –њ–Њ 200вАФ400 –Љ–ї –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ 1вАФ2 —А–∞–Ј–∞ –≤ –і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ 5вАФ7 –і–љ–µ–є. –Ф–ї—П —Г–ї—Г—З—И–µ–љ–Є—П —А–µ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –Ї—А–Њ–≤–Є –њ—А–Є–Љ–µ–љ—П—О—В –њ–µ–љ—В–Њ–Ї—Б–Є—Д–Є–ї–ї–Є–љ –њ–Њ 200 –Љ–≥ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ 2 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є –≤ —В–µ—З–µ–љ–Є–µ 5вАФ7 –і–љ–µ–є, –∞ –Ј–∞—В–µ–Љ (–Є–ї–Є —Б –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П) –≤–љ—Г—В—А—М –њ–Њ 100вАФ200 –Љ–≥ 3вАФ4 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—В–Њ–є —В–µ—А–∞–њ–Є–Є –і–Є—Б–Ї—Г—В–∞–±–µ–ї—М–љ–∞[16]:252. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Ї–Њ—Е—А–µ–є–љ–Њ–≤—Б–Ї–Њ–≥–Њ —Б–Њ–Њ–±—Й–µ—Б—В–≤–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—В–Є—Е –≤–Є–і–Њ–≤ –ї–µ—З–µ–љ–Є—П –Њ—В—Б—Г—В—Б—В–≤—Г—О—В[57][58]. –У–Є–њ–µ—А–±–∞—А–Є—З–µ—Б–Ї–∞—П –Њ–Ї—Б–Є–≥–µ–љ–∞—Ж–Є—П–У–Є–њ–µ—А–±–∞—А–Є—З–µ—Б–Ї–∞—П –Њ–Ї—Б–Є–≥–µ–љ–∞—Ж–Є—П —П–≤–ї—П–µ—В—Б—П –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –±–Њ–ї—М–љ–Њ–є –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–є –Ї–∞–Љ–µ—А–µ –і—Л—И–Є—В —З–Є—Б—В—Л–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–Њ–Љ. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ –њ—А–Є —Н—В–Њ–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–∞—Б—Л—Й–µ–љ–Є–µ –Ї—А–Њ–≤–Є –Ї–Є—Б–ї–Њ—А–Њ–і–Њ–Љ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –µ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤ –Є—И–µ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Г—О —В–Ї–∞–љ—М –Љ–Њ–Ј–≥–∞. –Я–Њ –і–∞–љ–љ—Л–Љ –Ї–Њ–Ї—А–µ–є–љ–Њ–≤—Б–Ї–Њ–≥–Њ —Б–Њ—В—А—Г–і–љ–Є—З–µ—Б—В–≤–∞ –љ–∞ 2010 –≥–Њ–і –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –≤—Б–µ–≥–Њ –ї–Є—И—М 6 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є 283 –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ, –і–ї—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–≥–Њ –≤—Л–≤–Њ–і–∞ –Њ —В–Њ–Љ, –њ–Њ–≤—Л—И–∞–µ—В –ї–Є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –і–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –ї–µ—З–µ–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ. –Я—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–µ–љ–Њ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є —Г –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –≥–Є–њ–µ—А–±–∞—А–Є—З–µ—Б–Ї–∞—П –Њ–Ї—Б–Є–≥–µ–љ–∞—Ж–Є—П[59]. –Я—А–Њ–≥–љ–Њ–Ј–Ю–њ—А–µ–і–µ–ї—П–µ—В—Б—П –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Є –Њ–±—К—С–Љ–Њ–Љ –Є–љ—Д–∞—А–Ї—В–∞, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –Њ—В—С–Ї–∞ –Љ–Њ–Ј–≥–∞, –∞ —В–∞–Ї–ґ–µ –љ–∞–ї–Є—З–Є–µ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є/–Є–ї–Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ –Є–љ—Б—Г–ї—М—В–∞ (–њ–љ–µ–≤–Љ–Њ–љ–Є—П, –њ—А–Њ–ї–µ–ґ–љ–Є, —Г—А–Њ—Б–µ–њ—Б–Є—Б –Є –і—А.). –Т –њ–µ—А–≤—Л–µ 30 –і–љ–µ–є —Г–Љ–Є—А–∞–µ—В –Њ–Ї–Њ–ї–Њ 15вАФ25 % –±–Њ–ї—М–љ—Л—Е. –°–Љ–µ—А—В–љ–Њ—Б—В—М –≤—Л—И–µ –њ—А–Є –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–Љ –Є –Ї–∞—А–і–Є–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Њ–Љ –Є–љ—Б—Г–ї—М—В–∞—Е –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В —В–Њ–ї—М–Ї–Њ 2 % –њ—А–Є –ї–∞–Ї—Г–љ–∞—А–љ–Њ–Љ. –Ґ—П–ґ–µ—Б—В—М –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Є–љ—Б—Г–ї—М—В–∞ —З–∞—Б—В–Њ –Њ—Ж–µ–љ–Є–≤–∞—О—В, –Є—Б–њ–Њ–ї—М–Ј—Г—П —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Є–Ј–Љ–µ—А–Є—В–µ–ї–Є, –љ–∞–њ—А–Є–Љ–µ—А, —И–Ї–∞–ї—Г –Є–љ—Б—Г–ї—М—В–∞ –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ш–љ—Б—В–Є—В—Г—В–∞ –Ч–і–Њ—А–Њ–≤—М—П (NIH)[60]. –Я—А–Є—З–Є–љ–∞ —Б–Љ–µ—А—В–Є –≤ –њ–Њ–ї–Њ–≤–Є–љ–µ —Б–ї—Г—З–∞–µ–≤ вАФ –Њ—В—С–Ї –Љ–Њ–Ј–≥–∞ –Є –≤—Л–Ј–≤–∞–љ–љ–∞—П –Є–Љ –і–Є—Б–ї–Њ–Ї–∞—Ж–Є—П —Б—В—А—Г–Ї—В—Г—А –Љ–Њ–Ј–≥–∞, –≤ –Њ—Б—В–∞–ї—М–љ—Л—Е —Б–ї—Г—З–∞—П—Е вАФ –њ–љ–µ–≤–Љ–Њ–љ–Є—П, —Б–µ—А–і–µ—З–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Н–Љ–±–Њ–ї–Є—П –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є, –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Є–ї–Є —Б–µ–њ—В–Є—Ж–µ–Љ–Є—П. –Ч–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —З–∞—Б—В—М (40 %) –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ –њ–µ—А–≤—Л–µ 2 —Б—Г—В –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Б–≤—П–Ј–∞–љ–∞ —Б –Њ–±—И–Є—А–љ—Л–Љ–Є —А–∞–Ј–Љ–µ—А–∞–Љ–Є –Є–љ—Д–∞—А–Ї—В–∞ –Є –Њ—В—С–Ї–Њ–Љ –Љ–Њ–Ј–≥–∞. –Ш–Ј –Њ—Б—В–∞–≤—И–Є—Е—Б—П –≤ –ґ–Є–≤—Л—Е –Њ–Ї–Њ–ї–Њ 60вАФ70 % –±–Њ–ї—М–љ—Л—Е –Є–Љ–µ—О—В –Є–љ–≤–∞–ї–Є–і–Є–Ј–Є—А—Г—О—Й–Є–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –Ї –Ї–Њ–љ—Ж—Г –Љ–µ—Б—П—Ж–∞. –І–µ—А–µ–Ј 6 –Љ–µ—Б –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞ –Є–љ–≤–∞–ї–Є–і–Є–Ј–Є—А—Г—О—Й–Є–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –Њ—Б—В–∞—О—В—Б—П —Г 40 % –≤—Л–ґ–Є–≤—И–Є—Е –±–Њ–ї—М–љ—Л—Е, –Ї –Ї–Њ–љ—Ж—Г –≥–Њ–і–∞ вАФ —Г 30 %. –І–µ–Љ –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є—В–µ–ї–µ–љ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –і–µ—Д–Є—Ж–Є—В –Ї –Ї–Њ–љ—Ж—Г 1-–≥–Њ –Љ–µ—Б—П—Ж–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —В–µ–Љ –Љ–µ–љ–µ–µ –≤–µ—А–Њ—П—В–љ–Њ –њ–Њ–ї–љ–Њ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ. –Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –љ–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –њ–µ—А–≤—Л–µ 3 –Љ–µ—Б—П—Ж–∞ –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞, –њ—А–Є —Н—В–Њ–Љ —Д—Г–љ–Ї—Ж–Є—П –љ–Њ–≥–Є —З–∞—Б—В–Њ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –ї—Г—З—И–µ, —З–µ–Љ —Д—Г–љ–Ї—Ж–Є—П —А—Г–Ї–Є. –Я–Њ–ї–љ–Њ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–≤–Є–ґ–µ–љ–Є–є —А—Г–Ї–Є –Ї –Ї–Њ–љ—Ж—Г 1-–≥–Њ –Љ–µ—Б—П—Ж–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П вАФ –њ–ї–Њ—Е–Њ–є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–є –њ—А–Є–Ј–љ–∞–Ї. –°–њ—Г—Б—В—П –≥–Њ–і –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞ –і–∞–ї—М–љ–µ–є—И–µ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є –Љ–∞–ї–Њ–≤–µ—А–Њ—П—В–љ–Њ. –£ –±–Њ–ї—М–љ—Л—Е —Б –ї–∞–Ї—Г–љ–∞—А–љ—Л–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –ї—Г—З—И–µ–µ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ, —З–µ–Љ –њ—А–Є –і—А—Г–≥–Є—Е —В–Є–њ–∞—Е –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞[16]:252-253. –Т—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б—С–љ–љ–Њ–≥–Њ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ—А–Є–Љ–µ—А–љ–Њ 60вАФ70 % –Ї –Ї–Њ–љ—Ж—Г 1-–≥–Њ –≥–Њ–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, 50 % вАФ —З–µ—А–µ–Ј 5 –ї–µ—В –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞, 25 % вАФ —З–µ—А–µ–Ј 10 –ї–µ—В. –Ъ –њ–ї–Њ—Е–Є–Љ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –≤ –њ–µ—А–≤—Л–µ 5 –ї–µ—В –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞ –Њ—В–љ–Њ—Б—П—В –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ–Њ–≥–Њ, –њ–µ—А–µ–љ–µ—Б—С–љ–љ—Л–є –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, –Љ–µ—А—Ж–∞—В–µ–ї—М–љ—Г—О –∞—А–Є—В–Љ–Є—О, –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й—Г—О –Є–љ—Б—Г–ї—М—В—Г –Ј–∞—Б—В–Њ–є–љ—Г—О —Б–µ—А–і–µ—З–љ—Г—О –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М. –Я–Њ–≤—В–Њ—А–љ—Л–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –њ—А–Є–Љ–µ—А–љ–Њ —Г 30 % –±–Њ–ї—М–љ—Л—Е –≤ –њ–µ—А–Є–Њ–і 5 –ї–µ—В –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞[16]:253. –Т–ї–Є—П–љ–Є–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —Г –Є—Б—В–Њ—А–Є—З–µ—Б–Ї–Є—Е –ї–Є—З–љ–Њ—Б—В–µ–є –љ–∞ –Є—Б—В–Њ—А–Є—О–†–∞–Ј—А—Г—И–Є—В–µ–ї—М–љ—Л–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –≤–ї–Є—П–ї–Є –љ–∞ —Е–Њ–і –Љ–Є—А–Њ–≤–Њ–є –Є—Б—В–Њ—А–Є–Є. –Ы–Є–і–µ—А—Л –≥–Њ—Б—Г–і–∞—А—Б—В–≤ –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –±–Њ–ї–µ–Ј–љ—П–Љ —В–∞–Ї –ґ–µ, –Ї–∞–Ї –Є –њ—А–Њ—Б—В—Л–µ –ї—О–і–Є. –Ф–ґ–µ–є–Љ—Б –Ґ—Г–ї (–∞–љ–≥–ї. James F. Toole) –≤ —Б–≤–Њ–µ–є –Ї–љ–Є–≥–µ –Њ —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–Є—Б–∞–ї[61]:
–†—Г–Ј–≤–µ–ї—М—В, –≤–Є–і–Є–Љ–Њ, –њ–µ—А–µ–љ–µ—Б –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е —Н–њ–Є–Ј–Њ–і–Њ–≤ –≤–Њ –≤—А–µ–Љ—П —Б–≤–Њ–µ–≥–Њ –≤—В–Њ—А–Њ–≥–Њ —Б—А–Њ–Ї–∞ –љ–∞ –њ–Њ—Б—В—Г –њ—А–µ–Ј–Є–і–µ–љ—В–∞. –Э–∞ –ѓ–ї—В–Є–љ—Б–Ї–Њ–є –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є–Є –≤ 1945 –≥–Њ–і—Г –µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±—Л–ї–Њ —В—П–ґ—С–ї—Л–Љ. –Ы–Њ—А–і –Ь–Њ—А–∞–љ, –≤—А–∞—З –І–µ—А—З–Є–ї–ї—П, —В–∞–Ї –Њ–њ–Є—Б—Л–≤–∞–µ—В –†—Г–Ј–≤–µ–ї—М—В–∞[61]:
–Т—Г–і—А–Њ –Т–Є–ї—М—Б–Њ–љ, 28-–є –њ—А–µ–Ј–Є–і–µ–љ—В –°–®–Р, –Ј–∞–љ–Є–Љ–∞–≤—И–Є–є —Б–≤–Њ–є –њ–Њ—Б—В –≤–Њ –≤—А–µ–Љ—П –Я–µ—А–≤–Њ–є –Љ–Є—А–Њ–≤–Њ–є –≤–Њ–є–љ—Л, –њ–µ—А–µ–љ—С—Б –Є–љ—Б—Г–ї—М—В –≤ 1919 –≥–Њ–і—Г. –Т—Б–ї–µ–і—Б—В–≤–Є–µ –Є–љ—Б—Г–ї—М—В–∞ —Г –љ–µ–≥–Њ –њ–∞—А–∞–ї–Є–Ј–Њ–≤–∞–ї–Њ –≤—Б—О –ї–µ–≤—Г—О —Б—В–Њ—А–Њ–љ—Г —В–µ–ї–∞ –Є –Њ–љ –Њ—Б–ї–µ–њ –љ–∞ –Њ–і–Є–љ –≥–ї–∞–Ј. –Т–Є–ї—М—Б–Њ–љ —Б—В–∞–ї –љ–µ—В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ—Л–Љ –і–Њ –Ї–Њ–љ—Ж–∞ –њ—А–µ–Ј–Є–і–µ–љ—В—Б–Ї–Њ–≥–Њ —Б—А–Њ–Ї–∞. –Ю–љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —А—Г–Ї–Њ–≤–Њ–і–Є–ї —Б–≤–Њ–Є–Љ –Ї–∞–±–Є–љ–µ—В–Њ–Љ, –њ–Њ—Б—А–µ–і–љ–Є–Ї–Њ–Љ –Љ–µ–ґ–і—Г –њ—А–∞–≤–Є—В–µ–ї—М—Б—В–≤–Њ–Љ –Є –њ—А–µ–Ј–Є–і–µ–љ—В–Њ–Љ –±—Л–ї–∞ –Љ–Є—Б—Б–Є—Б –Т–Є–ї—М—Б–Њ–љ, –Ї–Њ—В–Њ—А–∞—П, –≤ –Ї–Њ–љ—Ж–µ –Ї–Њ–љ—Ж–Њ–≤, —Б—В–∞–ї–∞ –Ј–∞–љ–Є–Љ–∞—В—М—Б—П –њ–µ—А–µ–Љ–µ—Й–µ–љ–Є—П–Љ–Є –≤ –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є –∞–і–Љ–Є–љ–Є—Б—В—А–∞—Ж–Є–Є. –Т —Н—В–Њ –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–µ –≤—А–µ–Љ—П –Ј–∞–≤–µ—А—И–∞–ї–Њ—Б—М —Б–Њ–Ј–і–∞–љ–Є–µ –Ы–Є–≥–Є –Э–∞—Ж–Є–є. –Т–Є–ї—М—Б–Њ–љ –Ї–∞–Ї –∞–Ї—В–Є–≤–љ—Л–є –њ–Њ–±–Њ—А–љ–Є–Ї –µ—С —Б–Њ–Ј–і–∞–љ–Є—П –±—Л–ї –љ–µ—Б–њ–Њ—Б–Њ–±–µ–љ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –±–Њ–ї–µ–Ј–љ–Є —Г–±–µ–і–Є—В—М –Ї–Њ–љ–≥—А–µ—Б—Б –°–®–Р –≤ –≤–∞–ґ–љ–Њ—Б—В–Є –≤—Б—В—Г–њ–ї–µ–љ–Є—П –≤ –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є—Ж—Г –Ю–Ю–Э. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –°–®–Р —В–∞–Ї –Є –љ–µ –≤—Б—В—Г–њ–Є–ї–Є –≤ –Ы–Є–≥—Г –Э–∞—Ж–Є–є[61]. –Ш–Ј –њ—П—В–љ–∞–і—Ж–∞—В–Є –њ—А–µ–Ј–Є–і–µ–љ—В–Њ–≤ –°–®–Р —Б 1900 –≥–Њ–і–∞ –Њ—В –Ґ–µ–Њ–і–Њ—А–∞ –†—Г–Ј–≤–µ–ї—М—В–∞ –і–Њ –†–Њ–љ–∞–ї—М–і–∞ –†–µ–є–≥–∞–љ–∞ —В—А–Є–љ–∞–і—Ж–∞—В—М —Г–Љ–µ—А–ї–Є –Њ—В –Є–љ—Б—Г–ї—М—В–∞ –Є–ї–Є –±–Њ–ї–µ–Ј–љ–Є –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є, –Є—Б–Ї–ї—О—З–∞—П –У–µ—А–±–µ—А—В–∞ –У—Г–≤–µ—А–∞ –Є —Г–±–Є—В–Њ–≥–Њ –≤ –Ф–∞–ї–ї–∞—Б–µ –Ф–ґ–Њ–љ–∞ –Ъ–µ–љ–љ–µ–і–Є[61]. –•–Њ—В—П –љ–µ–Є–Ј–≤–µ—Б—В–µ–љ —А—П–і –і–µ—В–∞–ї–µ–є —Б–Љ–µ—А—В–Є –Т–ї–∞–і–Є–Љ–Є—А–∞ –Ы–µ–љ–Є–љ–∞, –љ–∞–Є–±–Њ–ї–µ–µ –Њ–±—Й–µ–µ –Љ–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ–Є—В –≤ —В–Њ–Љ, —З—В–Њ –Њ–љ–∞ –њ—А–Њ–Є–Ј–Њ—И–ї–∞ –Њ—В –Є–љ—Б—Г–ї—М—В–∞[61]. –Я—А–Є–Љ–µ—З–∞–љ–Є—П
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia