|
Ossitricloruro di vanadio
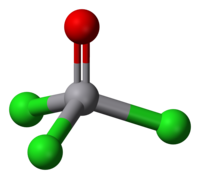
L'ossitricloruro di vanadio o tricloruro di vanadile[3] è il composto inorganico del vanadio pentavalente di formula VOCl3,[2] contenente il vanadile VO,[4] un gruppo piuttosto comune nella chimica del vanadio.[5] In condizioni normali è un liquido giallo chiaro, non infiammabile e distillabile.[6][7] Per alcuni aspetti del suo comportamento chimico è simile al tricloruro di fosforile POCl3, ad esso isoelettronico di valenza, ma ne differisce per essere decisamente ossidante, come gli altri composti di vanadio(V).[8] Struttura molecolare e proprietàIl tricloruro di vanadile è igroscopico e a contatto con l'umidità dell'aria si idrolizza rapidamente, come pure fa vigorosamente con l'acqua o, meno velocemente, con alcoli e solventi protici in genere.[9][10] È solubile in solventi organici aprotici polari come l'acetone (μ = 2,91 D), il diclorometano (μ = 1,62 D), l'etere etilico (1,15 D) e aprotici non polari, come esano, benzene e tetracloruro di carbonio (μ = 0).[11] Viene usato come reattivo in sintesi organica.[12] Il tricloruro di vanadile è un composto termodinamicamente molto stabile, ΔHƒ° = -701,76 ± 1,30 kJ/mol,[13] ma è anche un forte ossidante: in ambiente acido il suo potenziale standard di riduzione è E° = 1,0 V, cioè appena meno di quello del bromo (1,07 V).[14] Parallelamente, la capacità della molecola di catturare elettroni è testimoniata anche dalla sua affinità elettronica, riportata come > (3,60 ± 0,50) eV;[15] per confronto, quella di POCl3 è (1,41 ± 0,20) eV.[16] Configurazione elettronica e struttura molecolareIl vanadio in questo composto ha il suo massimo stato di ossidazione, +5, al quale corrisponde la configurazione elettronica 3 d 0, il che comporta che non ci sono elettroni spaiati e il composto è quindi diamagnetico.[10] La forma della molecola è un tetraedro quasi regolare, con simmetria molecolare C3v;[17] dato che i legami con i clori e e quello con l'ossigeno puntano da parti opposte, i loro momenti di dipolo tendono a sottrarsi vettorialmente e il momento dipolare complessivo della molecola risulta basso: in soluzione di CCl4 a 25 °C è riportato come μ = 0,3 D.[18] VOCl3 è un composto molecolare sia in fase vapore che allo stato solido cristallino.[19] Da un'indagine diffrattometrica ai raggi X su un monocristallo di VOCl3 risulta che la molecola nel reticolo cristallino ha simmetria Cs, minore di quella in fase gassosa (C3v). Il legame V=O è lungo 156,2 pm e i legami V–Cl 212,4 pm (medio); l'angolo medio O-V-Cl è di 107,2° e quello medio Cl-V-Cl è di 111,9°.[19] Da un'indagine di diffrazione elettronica in fase gassosa si trovano valori molto simili; il legame V=O risulta essere lungo 157,1 pm, quello V–Cl 213,7 pm; l'angolo O-V-Cl è di 107,8° e quello Cl-V-Cl è di 111,0°.[20][21] SintesiVOCl3 può essere sintetizzato in vari modi. Una procedura prevede la clorurazione di V2O5 mescolato a carbone e scaldato al calor rosso.[22] Questa stessa reazione si può effettuare anche partendo da V2O3.[23] Il carbone serve per catturare l'ossigeno, dando monossido di carbonio, in modo analogo a quanto succede nel processo Kroll per la sintesi di TiCl4:
Alternativamente, si riscalda con cautela fino a circa 400 °C una miscela di V2O5 e AlCl3 anidro; l'allumina formata è involatile, mentre il VOCl3 viene separato per distillazione:[24]
La clorurazione si può effettuare anche con SOCl2:[23]
Reattività Il tricloruro di vanadile è un composto stabile fino a circa 180 °C, solubile in etere etilico e acido acetico glaciale, in alcool etilico ed altri alcoli si scioglie ma reagisce (vide infra).[23] Risulta molto sensibile all'umidità. In presenza di quantità anche minime di acqua si idrolizza rapidamente formando anidride vanadica (pentossido di divanadio, rosso-arancio), che si idrata pochissimo, e acido cloridrico:[24]
Questa reazione è molto simile a quella di POCl3 e l'unica differenza è che la corrispondente anidride fosforica, diversamente dalla vanadica, è avidissima di acqua e si idrata immediatamente dando acido forforico. In presenza di alcoli la reazione è dello stesso tipo (alcoolisi, invece di idrolisi) e si formano alcossidi di vanadile, ossia ortovanadati alchilici, cioè esteri dell'acido ortovanadico[25] (molto poco stabile, H3VO4), che è analogo ad H3PO4:
Il tricloruro di vanadile si usa nella sintesi del dicloruro di vanadile (VOCl2, VIV) in una reazione di comproporzione:[26]
Nella reazione con l'anidride ipoclorosa viene trasformato in cloruro di diossovanadio (VO2Cl) e il cloro presente viene in parte ossidato a Cl2:[27]
VOCl3 è un acido di Lewis e forma addotti con basi di Lewis come acetonitrile e ammine. Nella formazione dell'addotto la coordinazione del vanadio diventa ottaedrica.[2] Un esempio è la reazione con trietilammina:
Con gli ammino N-ossidi si formano similmente complessi ottaedrici; ad esempio, con la piridina N-ossido (PyNO):[28]
Con diammine può raggiungere la coordinazione ottaedrica anche formando addotti 1:1, con formazione di un anello; nel caso della o-fenantrolina (Phen), un anello a cinque termini:[28]
Con anioni come specie donatrici il tricloruro di vanadile forma complessi stabili; con lo ione cloruro si ottengono sali dello ione complesso ossotetraclorovanadato(V), [O=VCl4] –, dove l'atomo di vanadio adotta una coordinazione piramidale a base quadrata, con l'atomo di ossigeno sul vertice;[29] ad esempio, con cloruri di ammonio quaternario, si ha:[30]
Come acido di Lewis, Il tricloruro di vanadile riesce anche a strappare uno ione cloruro dal pentacloruro di fosforo, formando il corrispondente sale di tetraclorofosfonio PCl4+:[29]
UsiVOCl3 è usato come catalizzatore nella produzione di gomme etilene-propilene (EPDM) e come materiale di partenza per la sintesi di composti organici di vanadio.[31] Tossicità / Indicazioni di sicurezzaVOCl3 è disponibile in commercio. Il composto è tossico per ingestione e inalazione. Risulta corrosivo per tutte le mucose, gli occhi e la cute. A contatto con acqua reagisce violentemente sviluppando acido cloridrico.[1] Note
Bibliografia
Altri progetti
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||