|
Cloruro di vanadio(III)
Il cloruro di vanadio(III) o tricloruro di vanadio è il composto inorganico binario con formula VCl3. In condizioni normali è un solido di colore viola scuro, molto igroscopico e sensibile all'ossidazione.[3] VCl3 è disponibile in commercio. Viene usato industrialmente come catalizzatore per produrre gomme e polietilene, e come precursore per la sintesi di altri composti di vanadio.[4] StoriaIl composto VCl3 fu ottenuto per la prima volta nel 1869 da Henry Enfield Roscoe, per decomposizione termica di VCl4.[5][6] Struttura molecolare e configurazione elettronica VCl3 è un solido polimerico. Allo stato solido possiede una struttura cristallina esagonale analoga a quella dello ioduro di bismuto, gruppo spaziale R3 con costanti di reticolo a = 601 pm e c = 1734 pm, sei unità di formula per cella elementare.[7] Gli atomi di vanadio risultano esacoordinati. La struttura può essere descritta come un impacchettamento compatto esagonale di anioni cloruro, mentre i cationi V3+ sono situati in uno strato sì e uno no, occupando i due terzi degli interstizi ottaedrici.[8][9] Lo ione V3+ ha configurazione elettronica d 2, e i due elettroni spaiati rendono paramagnetico il composto.[3] SintesiVCl3 si può preparare in vari modi.[10][11] Una possibilità è riscaldare VCl4 a 160-170 °C usando un flusso di gas inerte per allontanare il cloro:
Si può ottenere anche per sintesi diretta facendo reagire in un tubo sigillato cloro liquido con vanadio metallico:
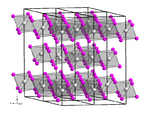
Alcune altre possibilità sono: ReattivitàVCl3 è un composto molto igroscopico e molto sensibile all'ossidazione. È anche molto sensibile alla presenza di ossigeno, che provoca la formazione di ossicloruri come VOCl, VOCl2 e VOCl3.[9][12] Sciolto in acqua forma lo ione esaaquo [V(H2O)6]3+.[3] Da queste soluzioni si può ottenere il sale idrato VCl3•6H2O che in realtà ha struttura trans-[V(H2O)4Cl2]Cl•2H2O.[2][13] In soluzione in presenza di altri leganti si formano complessi paramagnetici, vista la configurazione elettronica d2 dello ione V3+. In genere si formano complessi ottaedrici tipo [VL6]3+, [VCl2L4]+, [VCl3L3] o [VCl6]3–, ma sono possibili anche altre geometrie, come ad esempio [VCl4]– (tetraedrico) e [V(CN)7]4– (bipiramide pentagonale).[2] Tossicità / Indicazioni di sicurezzaVCl3 è disponibile in commercio. Il composto provoca gravi ustioni cutanee e gravi lesioni oculari. È nocivo per ingestione. Non ci sono evidenze di effetti cancerogeni. Non sono disponibili dati su effetti ambientali.[1] NoteBibliografia
Altri progetti
|
||||||||||||||||||||||||||||||||||||||||||||||||||||