|
Acido ipofosforoso
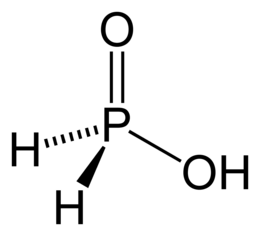
L'acido ipofosforoso, noto anche col nome acido fosfinico, è un ossiacido del fosforo e un potente agente riducente. È un composto incolore con una bassa temperatura di fusione. È solubile in acqua, diossano e alcoli. La formula molecolare dell'acido ipofosforoso è H3PO2 che, in maniera più descrittiva, viene rappresentata con la formula semistrutturale H2P(=O)(OH). Questa rappresentazione ne mette in luce il carattere di acido monoprotico: solo l'atomo di idrogeno legato all'ossigeno, che è molto più elettronegativo, può facilmente essere ceduto come H+. I sali che derivano da questo acido sono detti ipofosfiti o fosfinati. ProprietàL'acido anidro cristallizza in forma di scaglie incolori che fondono a 26,5 °C in un liquido incolore, e che sono solubili in acqua e molto solubili in alcool ed etere. Per riscaldamento si decompone, disproporzionandosi in fosfina e acido fosforoso. Equilibrio tautomerico e stati di valenzaL'acido ipofosforoso è soggetto ad un equilibrio tautomerico tra due forme che si interconvertono per migrazione di un protone tra l'atomo di fosforo e quello di ossigeno, con conseguente riorganizzazione elettronica interna dei legami: H2P(=O)(OH) (ac. fosfinico) ⇌ HP(OH)2 (ac. ipofosforoso) (Keq ≈ 1012) La prima, enormemente maggioritaria, è quella che viene detta propriamente «acido fosfinico», mentre il nome di «acido ipofosforoso» è riservato alla seconda. Inoltre, fa parte della serie degli ossiacidi semplici del fosforo, gli acidi monofosforici, dei quali questo acido è quello con meno atomi di ossigeno:
L'equilibrio tautomerico ora visto per l'acido fosfinico/ipofosforoso si ha, in maniera del tutto analoga, per l'acido fosfonico/fosforoso: HP(=O)(OH)2 (ac. fosfonico) ⇌ P(OH)3 (ac. fosforoso) (Keq ≈ 1010) Nel primo tautomero dell'acido fosfinico il fosforo è pentavalente, mentre nel secondo (acido ipofosforoso) è evidentemente trivalente; la stessa cosa accade anche nella coppia acido fosfonico (P pentavalente) e acido fosforoso (P trivalente). Infine, diversamente che nei due casi precedenti, per l'acido fosforico non c'è evidenza di alcuna tautomeria, l'unica formula di struttura è P(=O)(OH)3, dove il fosforo è pentavalente come negli altri due tautomeri principali degli altri acidi, il fosfinico e il fosfonico. Stati di ossidazioneRiguardo agli stati di ossidazione del fosforo nei primi due acidi c'è qualche incongruenza. Diverse fonti riportano il fosfinico come contenente PI e il fosfonico come contenente PIII, conformemente a un assunto tradizionale che il fosforo sia più elettronegativo dell'idrogeno. Tuttavia, la IUPAC raccomanda che la scala di elettronegatività da considerare per decidere gli stati di ossidazione debba essere specificamente quella di Allen, per la quale χ(H) = 2,30 e χ(P) = 2,25. Qesto comporta che, sia per il tautomero fosfinico (H3PO2) che per quello fosfonico (H3PO3), lo stato di ossidazione di P in essi sia +5, dato che P forma in entrambi i casi un totale di cinque legami con elementi (H o O) più elettronegativi, come accade nel caso ovvio dell'acido fosforico in cui tutti i legami del fosforo sono con l'ossigeno. Inoltre, anche in altre scale di elettronegatività H risulta più elettronegativo di P (Pauling, Mulliken, Allred-Rochow e Sanderson). A questo fa riscontro il calcolo della carica parziale di Bader assunta da un atomo H legato a P nella fosfina, pari a -0,61 e. mentre quella su P è +1,84 e. Per altro verso, questa uniformità degli stati di ossidazione dell'atomo centrale di fosforo ben si accorda con l'andamento dei pKa di questi tre acidi, che sono abbastanza simili (vide infra). Struttura molecolareLa struttura dell'acido fosfinico è tata indagata allo stato cristallino tramite diffrattometria ai raggi X. Si è trovato che la struttura è ortorombica, gruppo spaziale P21212 (o D23), con due molecole H3PO2 nella cella elementare. Le molecole sono disposte in catene a zig-zag nel cristallo, dove ciascuna molecola riceve un legame idrogeno O-H…O dalla precedente e ne dona un altro alla successiva. La distanza O…O rilevata in tali legami idrogeno molto corti è di 244 pm. Da indagini computazionali a livello B3LYP/6-31-G** per la molecola H2P(=O)(OH) risulta che la simmetria è C1 e le lunghezze (r) e gli angoli (∠) di legame sono come segue: r(P−O) = 162,8 pm; r(P=O) = 148,5 pm; r(O−H) = 96,9 pm; r(P−H) = 141,6 pm; r(P−H) = 141,0 pm; ∠(H−P−O) = 103,7°; ∠(H−P−O) = 97,0°; ∠(O−P=O) = 117,9°; ∠(H−P−H) = 103,6°; ∠(H−P=O) = 117,9°; ∠(P−O−H) = 111,9°. La molecola contiene l'importante frammento ≡P=O, il fosforile, un gruppo funzionale trivalente, molto polare e particolarmente stabile (D0 = ≈544 kJ/mol), presente anche nell'acido fosfonico e nell'acido fosforico, come pure negli alogenuri di fosforile (POF3, POCl3), ed anche nell'ossido di fosfina (H3PO); quest'ultima è una molecola molto instabile, ma importante in questo contesto perché considerata come primo membro della serie H3POn che termina con H3PO4. Per contro, il fosforile non è presente nel tautomero minoritario (ac. ipofosforoso, HP(OH)2) e nemmeno nell'altro tautomero (P(OH)3) dell'analogo acido fosforoso. Il legame P=O ha a lungo destato interesse in letteratura chimica per la questione della partecipazione o meno degli orbitali 3d del fosforo nel legame pi-greco in esso presente. La distanza P=O in questa molecola (148,5 pm) è simile a quella di 150 pm trovata sperimentalmente nell'acido fosfonico (HP(=O)(OH)2); è anche simile a quella calcolata di 147,0 pm per H3P=O e a quella di 148 pm ricavata dalla diffrazione elettronica in fase gassosa dell'ossido di trimetilfosfina (Me3P=O), ma è apprezzabilmente maggiore di quelle di 143,6 pm e 145,5 pm del fluoruro e del cloruro di fosforile (F3P=O e Cl3P=O), rispettivamente, dove a tale gruppo sono uniti tre atomi molto elettronegativi. Il legame singolo P−O è praticamente uguale al suo valore normale di 163 pm, ma apprezzabilmente maggiore del valore per l'acido fosfonico (155 pm). I legami P−H, simili tra loro, sono simili a quelli nell'acido fosfonico (139 pm) e sono anche simili al valore nella fosfina (142,1 pm, PH3). Il legame O−H è praticamente uguale al suo valore normale di 96 pm. Gli angoli formati dal frammento P=O con O e con H si avvicinano qui ai 120°, gli angoli analoghi nelle altre specie sono 117,5° in H3P=O, 112,3°in Me3P=O, 116,76° in F3P=O e 114,76° in Cl3P=O; gli altri angoli, tranne uno più piccolo, sono più prossimi al valore tetraedrico (109,5°). Proprietà acido-baseL'acido fosfinico, a differenza del fosfonico (biprotico) e del fosforico (triprotico) è un acido monoprotico che, in quanto solo parzialmente dissociato in soluzione acquosa, si colloca convenzionalmente tra gli acidi deboli. Il suo pKa è riportato come 1,24 e quindi è circa 3.000 volte più forte dell'acido acetico (pKa = 4,76); è marginalmente il più forte dei tre acidi semplici del fosforo già menzionati, la forza dei quali è comunque contenuta entro un solo ordine di grandezza: H3PO2 (pKa = 1,24) > H3PO3 (pKa = 2,00) > H3PO2 (pKa = 2,21) L'acido fosfinico in ambiente molto acido (H2SO4) può essere protonato, dando in tal modo il catione molecolare [H2P(OH)2]+, che è un derivato dello ione fosfonio [PH4]+: H2P(=O)(OH) + H+ ⇌ [H2P(OH)2]+ Keq ≈ 0,02 Preparazione e disponibilitàLa preparazione industriale dell'acido segue principalmente due metodi. Nel primo si sfrutta una reazione di disproporzione del fosforo elementare per ottenere i suoi sali, in particolare gli ipofosfiti dei metalli alcalini e alcalino terrosi. Questi sali si formano infatti per trattamento del fosforo bianco con una soluzione acquosa concentrata di un appropriato idrossido metallico (es: Ba(OH)2); si producono in tal modo ioni ipofosfito e fosfina la quale, essendo insolubile in mezzo acquoso, si svolge in forma gassosa dalla soluzione:
La successiva aggiunta alla soluzione di un acido minerale (non ossidante) protona l'ipofosfito e fornisce così l'acido ipofosforoso; in laboratorio una tipica preparazione impiega ipofosfito di bario monoidrato e acido solforico:
In alternativa, H3PO2 può formarsi attraverso una ossidazione della fosfina per trattamento con iodio in ambiente acquoso: UsiL'acido ipofosforoso è usato nell'industria farmaceutica, nei trattamenti delle acque, nel recupero di metalli preziosi o non-ferrosi. In chimica organica è conosciuto per il suo uso nella riduzione dei sali di diazonio, tramite la reazione di Sandmeyer. Derivati inorganici e organiciSi conoscono numerosi derivati nei quali i due idrogeni direttamente legati al fosforo sono sostituiti da gruppi R (alchili o arili). Questi derivati sono noti come acidi fosfinici [R2P(=O)(OH)]; i loro sali M+[R2P(=O)(O−)] e i loro esteri [R2P(=O)(OR')] sono noti come fosfinati. L'acido ipofosforoso può a volte formare complessi metallici. Uno di questi è Ni(O2PH2)2. Note
Voci correlateAltri progetti
Collegamenti esterni
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia