|
Réaction de BlaiseLa réaction de Blaise est une réaction organique de couplage qui permet de former un β-cétoester à partir de zinc métallique, d'un α-bromoester et d'un nitrile[1],[2],[3]. La réaction a été publiée pour la première fois par Edmond Blaise en 1901. Présentation synthétiqueAu cours de cette synthèse, une métaloimine intermédiaire est formée, puis hydrolysée pour donner le β-cétoester souhaité[4]. 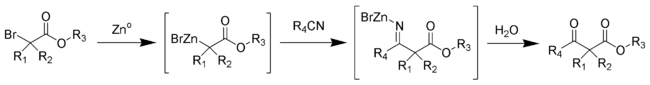 Les esters aliphatiques encombrés donnent en général des rendements plus élevés. Dans cette réaction, des groupements hydroxyles libres sont tolérés[5],[6], ce qui est rare lors de réactions faisant intervenir des organométalliques dérivés d'halogénures. Mécanisme détailléLe mécanisme de la réaction de Blaise passe par la formation d'un organozincique complexe avec le brome en α du carbonyle de l'ester. Cela rend le carbone en α nucléophile, permettant une attaque électrophile du carbone du nitrile. L'azote alors chargé négativement du nitrile interagit avec le monobromure de zinc cationique. Le β-ènaminoester (tautomère de l'imine intermédiaire sur le schéma ci-dessus) est isolé lors d'un traitement du milieu réactionnel par une solution aqueuse à 50 % de K2CO3. Si le β-cétoester est le produit désiré, l'addition d'acide chlorhydrique molaire permet l'hydrolyse du β-ènaminoester en β-cétoester.  Notes et références(en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Blaise reaction » (voir la liste des auteurs).
Voir aussiBibliographie
Article connexeLien externe
|
Portal di Ensiklopedia Dunia