|
COVID-19
COVID-19 (Akronym von englisch coronavirus disease 2019, deutsch Coronavirus-Krankheit-2019),[1][2][3][4] in den deutschsprachigen Ländern umgangssprachlich meist nur als Corona oder Covid bezeichnet, ist eine Infektionskrankheit (nach dem Recht bestimmter Länder meldepflichtig) mit einem breiten aber unspezifischen Symptomspektrum, die durch eine Infektion (Ansteckung) mit dem Betacoronavirus SARS-CoV-2 verursacht wird.[5] Das Virus wurde erstmals im Dezember 2019 in Wuhan (Volksrepublik China) beschrieben. Es verbreitete sich sehr schnell weltweit und ist Ursache der COVID-19-Pandemie. Bis zum 3. März 2024 wurden weltweit rund 774 Millionen COVID-Infizierte registriert, es wird aber in vielen Ländern eine hohe Dunkelziffer vermutet.[6] Laut einer Schätzung der Weltgesundheitsorganisation (WHO) gab es zwischen Anfang 2020 und Ende 2021 eine weltweite, durch COVID-19 verursachte Übersterblichkeit von 14,83 Millionen Toten.[7] Die Ansteckung erfolgt durch Tröpfcheninfektion sowie durch das Einatmen von Bioaerosolen, insbesondere bei längerer Aufenthaltsdauer in geschlossenen und ungenügend gelüfteten Räumen und hinreichender Konzentration der Viren. Das Robert Koch-Institut (RKI) hat die Möglichkeit einer Schmierinfektion an Schleimhäuten (Mund, Nase, Auge etc.) durch Kontakt mit kontaminierten Oberflächen nicht ausgeschlossen.[8][9] Zur Vermeidung einer Infektion werden räumliche Distanzierung („social distancing“), Kontaktbeschränkung, das Tragen einer medizinischen Schutzmaske und Hygienemaßnahmen empfohlen. Vieles deutet darauf hin, dass die Ausbreitung von COVID-19 zur weltweiten Pandemie insbesondere durch „Superspreading“ begünstigt wurde.[10] Die Inkubationszeit von COVID-19 beträgt durchschnittlich fünf bis sechs Tage; zwischen Ansteckung und dem Auftreten erster Symptome können aber auch bis zu zwei Wochen vergehen. Vereinzelt treten erste Symptome schon innerhalb von 24 Stunden nach der Ansteckung auf. Ein Infizierter kann jedoch bereits Tage vor dem Auftreten erster Symptome und auch noch nach deren Abklingen infektiös (ansteckend) sein.[11] Der Krankheitsverlauf ist unspezifisch und kann stark variieren. Laut Schätzung des RKI haben 55 bis 85 % der Infizierten spürbare Beschwerden und/oder zeigen erkennbare Anzeichen einer Erkrankung (Symptome) oder typische Symptomkombinationen (Syndrom) einer COVID-19-Erkrankung (Manifestationsindex). Die übrigen Infizierten sind beschwerdefrei und zeigen keine Symptome; sie sind asymptomatisch erkrankt, können aber dennoch das Virus weiterverbreiten.[11][12] Bei rund 81 % der registrierten Erkrankungen ist ein leichter Verlauf mit Fieber oder einer leichten Lungenentzündung, trockenem Husten und Müdigkeit zu beobachten. Weniger häufig sind eine verstopfte Nase, Kopfschmerzen, Halsschmerzen, Gliederschmerzen, Bindehautentzündungen, Durchfall, Erbrechen, Geschmacks- und Geruchsverlust, Hautausschlag oder Verfärbung von Fingern oder Zehen.[13] Bei etwa 14 % der Krankheitsfälle ist der Verlauf schwerer, und in etwa 5 % so schwer, dass eine Beatmung der Patienten auf einer Intensivstation erfolgen muss.[14] Die höchste Gefährdung schwer zu erkranken besteht für ältere Menschen und solche mit Vorerkrankungen oder unzureichendem Immunschutz.[15] Bei einem schweren Verlauf von COVID-19 tritt eine beidseitige Lungenentzündung und akutes Lungenversagen auf; die Betroffenen können sterben.[11] Beobachtet wurden außerdem krankhafte Veränderungen der Leber,[16] des zentralen Nervensystems,[17] der Nieren,[18] der Blutgefäße[19] und des Herzens.[20][21] Anhaltende Beschwerden nach der Erkrankung, auch „Long COVID“ genannt, kommen relativ häufig vor, sowohl bei anfänglich schwer Erkrankten[22] als auch bei jungen, gesunden,[23] anfänglich nur leicht Erkrankten. Sie können zu langanhaltenden chronischen Beschwerden in vielen Organsystemen führen.[24] Bei über 100.000 Teilnehmern von COVID-Impfstudien dagegen wurden (Stand Dezember 2020) keine Hinweise auf Long Covid beobachtet.[25][26][27] Long Covid ist Thema laufender Forschung.[28][29][30][31] COVID-19 wird seit Beginn der Pandemie intensiv erforscht und die Ergebnisse werden international geteilt. Um andere Fachwissenschaftler umgehend über neueste Forschungsergebnisse zu informieren, ist es üblich, aktuelle Studien als Preprints im Internet auf speziellen Servern zu veröffentlichen.[32] Veröffentlichungen in den Sozialen Medien, aber auch in Presse, Rundfunk und Fernsehen sollten nicht nur auf diesen ungeprüften Studien, sondern auf Veröffentlichungen reputabler und fachlich zuständiger Institutionen basieren, so z. B. des Robert Koch-Instituts, der Weltgesundheitsorganisation, des National Health Service (NHS) oder Centers for Disease Control and Prevention (CDC). Diesen liegen zum Teil Peer-Reviews der betreffenden Studien zu Grunde, auf die dort auch verwiesen wird. Bereits Ende des Jahres 2020 wurden in der Europäischen Union und in einigen Nicht-EU-Ländern COVID-Impfstoffe zugelassen und Impfkampagnen gestartet. Das Wissenschaftsmagazin Science erklärte die Entwicklung von Impfstoffen gegen das SARS-CoV-2 in nie dagewesener Geschwindigkeit zum wissenschaftlichen Durchbruch des Jahres (Breakthrough of the Year).[33] BezeichnungDie WHO legte am 11. Februar 2020 das Akronym »COVID-19« als offizielle Bezeichnung fest. Es stammt aus dem Englischen: CO für Corona, VI für Virus, D für Disease (Krankheit) und 19 für das Jahr der Erstbeschreibung 2019. Übertragungsweg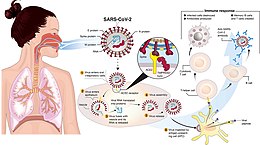 Ursache der Erkrankung ist das Betacoronavirus SARS-CoV-2, das erstmals im Januar 2020 aufgrund von Isolaten aus Pneumoniepatienten identifiziert wurde.[34] Das Virus wurde bisher im Sekret des Nasen- und Rachenraumes, im Sputum, im Stuhl, der Tränenflüssigkeit, im Blut, in Aerosolen und auf Oberflächen nachgewiesen.[11][35][36][37] Hauptübertragungsweg für SARS-CoV-2 ist die respiratorische Aufnahme virushaltiger Flüssigkeitspartikel (Atmen, Husten, Sprechen, Niesen). Weitere Ansteckungswege (Stuhl, Tränenflüssigkeit, Blut) sind nicht abschließend geklärt. Am 20. Januar 2020 gab die chinesische Gesundheitskommission bekannt, dass eine Mensch-zu-Mensch-Übertragung möglich sei,[38][39] insbesondere wenn zwei Personen engen Kontakt zueinander haben (weniger als 1,8 m Abstand[40] bzw. weniger als 1,5 m Abstand[11]). Aerosol- und Tröpfcheninfektion Es wird angenommen, dass sich das Virus wie andere Erreger von Atemwegserkrankungen hauptsächlich durch virushaltige Partikel verbreitet. Diese werden von Infizierten beim Atmen, Husten, Niesen, Sprechen und Singen freigesetzt und dann von gesunden Personen aufgenommen. Der Übergang zwischen Aerosol- und Tröpfcheninfektion ist fließend.[41] Die Weltgesundheitsorganisation (WHO) definiert Tröpfchen als Partikel mit einem Durchmesser von 5 bis 10 Mikrometer (μm).[42] Auf Grund ihrer Größe sinken Tröpfchen anders als die viel kleineren Aerosolpartikel relativ schnell zu Boden. Diese sind nur ca. 0,001 bis 5 μm groß und verteilen sich mit den Luftströmungen in Räumen und Gebäuden auch über größere Distanzen; abhängig von ihrer Größe und Dichte können sie dort sehr lange in der Luft verbleiben. Das Risiko für eine Übertragung durch Aerosole ist bei Tätigkeiten mit hohem Partikelausstoß wie lautem Sprechen oder Singen in kleinen, schlecht gelüfteten Räumen wesentlich höher als im Freien.[41] Deshalb müssen insbesondere für Wohnungen, Büros, Klassenräume, Wohnanlagen und Betreuungseinrichtungen wirkungsvolle Maßnahmen zur Vorbeugung einer Infektion festgelegt und auch umgesetzt werden.[43][44] In klimatisierten Innenräumen, z. B. in Krankenhäusern, können Tröpfchen im Größenbereich von 5 bis 40 μm – bedingt durch ihr aerodynamisches Verhalten als „jet riders“ (Transport mit Luft-Jet und Air Conditioning-induzierter Luftbewegung, Ausfallen in größerer Distanz, schlechte Elimination mit Ventilation) – ganz besonders gut Krankheitserreger übertragen.[45] Im Freien finden so gut wie keine Infektionen durch Aerosolpartikel statt. Allerdings können Tröpfcheninfektionen auftreten, insbesondere in Menschenansammlungen, wenn Mindestabstände nicht eingehalten oder keine Masken getragen werden, oder beides.[44] Die Forschungsgruppe um Lidia Morawska und Donald K. Milton wies 2019 nach, dass bei kurzen oder mittleren Entfernungen in Innenräumen ein erhebliches Infektionsrisiko durch Mikrotröpfchen besteht, und empfahl Schutzmaßnahmen, um die Übertragung durch die Luft zu mindern.[46] Im Juli 2020 publizierten sie zusammen mit 239 internationalen Forschern einen entsprechenden Appell.[47] Regelmäßiges Lüften vor allem in Krankenhäusern, Altenheimen und Schulen, Luftreinigung und das Vermeiden von überfüllten Verkehrsmitteln und anderen Innenräumen wurde dringend angeraten. Eine biophysikalische Studie des MIT stellte Anfang 2020 experimentell fest, dass Flüssigkeitspartikel beim Husten oder Niesen ohne mechanische Barriere bis zu acht Meter weit verbreitet werden können. Dies stellt das aus dem frühen zwanzigsten Jahrhundert stammende Tröpfcheninfektionsparadigma in Frage.[48] Anhand einer Auswertung von Virusgenomen bei Superspreaderevents schätzen Forscher, dass die meisten Infektionen ab einer Übertragung von rund 1.000 Viruspartikeln erfolgen. Es seien aber auch Infektionen durch geringere Virusdosen möglich.[49] Chinesische Forscher schrieben im Februar 2020 aufgrund von quantitativen Analysen von RT-PCR-Untersuchungen des Nasopharynx, das Virus sei wie Influenza auch durch Aerosole übertragbar.[50][51] Eine Studie des US-amerikanischen NIAID stützt diese Ansicht anhand quantitativer Viruslastbestimmung in Aerosolen. Die Untersuchung hat gezeigt, dass die Viren in Aerosolen, die durch einen maschinellen Vernebler erzeugt wurden, wenigstens drei Stunden lang entwicklungsfähig und damit infektiös blieben. Es dauerte etwa 66 Minuten, bis die Hälfte der Viren ihre Ansteckungsfähigkeit in Aerosolen verloren.[52] Eine Metastudie von 24 Studien zeigte, dass von 473 untersuchten Luftproben aus Krankenhäusern mit COVID-Patienten 17 % Erbmaterial des Virus enthielten und in 9 % der untersuchten Proben das Virus in Kultur angezüchtet werden konnte. Dabei wiesen sowohl Luftproben aus Patientennähe als auch entfernt vom Patienten genommene Luftproben virushaltige Aerosole auf.[53] Bei 3 von 63 Patienten mit COVID-19-Pneumonie waren Abstriche von den Augenbindehäuten PCR-positiv. Die Studienautoren bemerkten jedoch, dass keine klinischen Daten auf den Verbreitungsweg hindeuten würden.[54] Das Robert Koch-Institut schreibt (Stand 17. August 2021) dazu: In drei (von 63 untersuchten) Patienten mit COVID-19-Pneumonie waren Konjunktivalproben PCR-positiv […]. Dies ist jedoch kein Beleg [dafür], dass Konjunktiven als Eintrittspforte fungieren können.[55] In einer Tierstudie (März 2020) konnte ein Rhesusaffe über die Augenbindehäute mit SARS-CoV-2 infiziert werden und zeigte einen milden Krankheitsverlauf.[56] Bei manchen untersuchten Patienten mit Krankheitssymptomen war die Virenmenge in der Nase höher als im Rachen; das Auftreten gerade in den oberen Atemwegen unterscheidet SARS-CoV-2 damit von dem SARS-verursachenden SARS-CoV-1.[50] Probenuntersuchungen der dem Münchener Cluster zugehörigen Patienten zeigen, dass die vorhandene Viruslast im Nasen-Rachen-Raum um den Faktor 1000 höher war als bei zuvor bekannten Coronavirus-Erkrankungen wie SARS und MERS.[57] Eine Studie konnte keinen Unterschied der Viruslast unter den verschiedenen Altersgruppen feststellen.[58] KontaktübertragungVorläufige Laboruntersuchungen an SARS-CoV-2 zeigten 2020, dass das Virus auf Kunststoff und rostfreiem Stahl bis zu drei Tage infektiös bleiben kann, jedoch nicht länger als einen Tag auf Pappe oder länger als vier Stunden auf Kupfer.[52] UV-Licht tötet die Viren in kurzer Zeit. Laut Robert Koch-Institut sei eine Infektion durch kontaminierte Oberflächen „insbesondere in der unmittelbaren Umgebung des Infizierten nicht auszuschließen“.[11] Das ECDC schrieb im März 2020, das Virus könnte durch von Tröpfchen bedeckte Oberflächen übertragen werden.[60] Die US-amerikanischen National Institutes of Health schrieben im März 2020 nach quantitativen Untersuchungen der Viruslast in verschiedenen Szenarien, eine Übertragung durch kontaminierte Gegenstände und Oberflächen könne stattfinden, da das Virus mehrere Stunden (in speziellen Fällen sogar bis zu drei Tage) nach der Kontamination außerhalb des menschlichen Körpers nachweisbar ist.[52][61] Untersuchungen mittels Viruskultur zeigten, dass, abhängig von den Umweltbedingungen, auch nach dem Aufenthalt des Virus auf Gegenständen eine Infektiosität besteht.[62] Die prinzipielle Möglichkeit einer Übertragung wurde inzwischen (2022) dahingehend bewertet, dass die Wahrscheinlichkeit einer Kontaktinfektion etwa 1000-mal geringer ist als durch Aerosole und Tröpfcheninfektion. Damit sind Kontaktübertragungen für das Pandemiegeschehen von COVID-19 bedeutungslos.[59] Stillen und MuttermilchDas SARS-CoV-2 wird bei infizierten Müttern nicht in der Muttermilch nachgewiesen.[63] Dagegen werden in der Muttermilch der infizierten Frauen spezifische Antikörper gegen SARS-CoV-2 gefunden, die das Baby oder Kleinkind bei einer eventuellen Infektion schützen können.[63] Die Empfehlung der WHO seit Anfang der Pandemie lautet: Auch bei SARS-CoV-2 Infektion soll das Stillen weiter gefördert und unterstützt werden.[64] Obwohl das Virus nicht durch Muttermilch übertragen wird, ist das Infektionsrisiko durch Aerosole zu minimieren, deswegen wird bei einer COVID-19-Erkrankung der Mutter auch beim Stillen das Tragen einer Maske, häufiges Händewaschen und häufiges Desinfizieren von Oberflächen empfohlen.[65] Die WHO betonte, es sei besonders wichtig, dass Neugeborene nicht systematisch von ihren Müttern getrennt werden, wenn ein Verdacht auf COVID-19 besteht.[66] Andere ÜbertragungswegeForscher aus Singapur empfehlen aufgrund des Virusnachweises im Stuhl und des Nachweises von infektionsfähigen Coronaviren im Abwasser von zwei chinesischen Krankenhäusern während der SARS-Pandemie 2002/2003, den Stuhl der Patienten als infektiös zu behandeln. Um die Möglichkeit eines fäkal-oralen Infektionswegs neben Tröpfchen- und Aerosol-Infektionen auszuschließen, seien weitere Untersuchungen sowohl der Virusausscheidung der Patienten als auch der potentiell kontaminierten Umwelt notwendig.[67] Probenuntersuchungen mittels Viruskultur der dem Münchener Cluster zugehörigen 16 Patienten zeigen hingegen, dass deren Stuhl nicht virulent war, obschon sich Virus-RNA nachweisen ließ.[57] Dahingegen berichten chinesische Forscher von zwei Fällen ohne Durchfallbeschwerden, bei denen mittels Viruskultur und Elektronenmikroskopie vermehrungsfähiges Virus im Stuhl nachgewiesen werden konnte.[68] Dies konnte von einer anderen Forschungsgruppe bestätigt werden.[69] Ein Zellkulturmodell mit Virus-RNA-haltigen Abwasserproben konnte kein vermehrungsfähiges Virus nachweisen.[70] Eine Übertragung im Mutterleib ist in mehreren Einzelfällen nachgewiesen.[71][72] BasisreproduktionszahlDie Auswertung der Daten der ersten 425 Fälle in Wuhan ergab eine Basisreproduktionszahl von 2,2[73] – was bedeutet, dass jeder Infizierte im Durchschnitt 2,2 andere Personen angesteckt hatte. Eine Modellrechnung mit chinesischen und ausländischen Patientendaten vom 31. Dezember 2019 bis zum 28. Januar 2020 ergab einen Wert von 2,68.[74] Eine Auswertung des frühen Stadiums des Ausbruchs auf dem Kreuzfahrtschiff Diamond Princess kam auf einen Wert von 2,28.[75] Im Vergleich hierzu wurde für SARS eine Basisreproduktionszahl von 2,3 bis 2,6 berechnet.[76] Eine vergleichende Auswertung von 12 Studien, die bis zum 7. Februar 2020 veröffentlicht wurden, kommt zu dem Ergebnis, dass die Basisreproduktionszahl höher liegt, als bisher von der WHO angenommen, deren Schätzung bei 1,4 bis 2,5 liegt.[39] Die Wissenschaftler aus Schweden, China und Deutschland schätzten, dass die Basisreproduktionszahl im Mittel bei 3,28, im Median bei 2,79 (bei einem Interquartilabstand von 1,16) liegt – und somit über dem Wert bei SARS, den sie mit 2 bis 5 angeben. Aufgrund der unzureichenden Datenlage sind die aktuellen Schätzungen der mittleren Basisreproduktionszahl möglicherweise verzerrt.[77] In einem am 7. April 2020 veröffentlichten Artikel schätzen die Centers for Disease Control and Prevention die Basisreproduktionszahl ohne eindämmende Maßnahmen auf 5,7 bei einem 95 %-Konfidenzintervall von 3,8 bis 8,9.[78][79] Eine internationale Studie, die 539 Sozialkontakte eines Patienten untersuchte, stellte fest, dass dieser eine Patient 2 von 7 engen Sozialkontakten, und 3 von 473 flüchtigen Sozialkontakten angesteckt hatte.[80] In einem von Christophe Fraser, Luca Ferretti und Kollegen entwickelten mathematischen Infektionsmodell[81] kann die Basisreproduktionszahl (nach den Autoren beim Wert 2,0) aufgeteilt werden nach der Art der Übertragung: präsymptomatisch, asymptomatisch, symptomatisch und über Umweltkontakt (z. B. Schmierinfektion). Danach ist der Wert von allein aus präsymptomatischer Übertragung 0,9 (entsprechend 46 Prozent an dem Gesamtwert von ), also fast ausreichend, um eine Epidemie am Laufen zu halten. Der Beitrag der symptomatischen Überträger ist nach den Autoren 0,8, der asymptomatischen 0,1 und der Umwelt 0,2. Die Generationszeit ist nach der Studie im Mittel 5,0 Tage. Die Studie untersuchte mit ihrer mathematischen Simulation auch die Erfolgsaussichten der Isolation symptomatischer Individuen und der manuellen Kontaktverfolgung und kam zu dem Schluss, dass sie nicht schnell genug sind, um die Epidemie zu stoppen. (Sie empfehlen die Verwendung von Apps auf Mobiltelefonen.) SuperspreadingDie Neigung von COVID-19 zum Superspreading wird durch Überdispersion angezeigt. Überdispersion beschreibt das Phänomen einer hohen individuen-spezifischen Variation in der Verteilung der Anzahl der Sekundärübertragungen, die zu „Superverbreitungsereignissen“ führen kann. Der Grad an Überdispersion lässt sich durch ein statistisches Modell schätzen, bei dem die Verteilung der Sekundärübertragungen durch den Überdispersionsparameter und die Basisreproduktionszahl charakterisiert wird.[82] Der Überdispersionsparameter quantifiziert die Variabilität in der Anzahl der Sekundärfälle und kann als Maß für die Wirkung von Superspreading interpretiert werden. Je kleiner der geschätzte Überdispersionsparameter, desto stärker ist die Wirkung von Superspreading.[83] Die Interpretation des geschätzten Überdispersionsparameters wird vereinfacht, indem sich auf den Anteil der Individuen konzentriert wird, der für 80 % der Sekundärübertragungen verantwortlich ist (ein empirisches Muster, bekannt als 80/20-Regel). Wenn der Überdispersionsparameter klein ist (), approximiert er den Anteil infizierter Personen, die 80 % der Infektionen verursachen. Beispielsweise würde ein geschätzter Überdispersionsparameter von 0,1 bedeuten, dass die infektiösesten 10 % der Personen etwa 80 % der Infektionen verursachen.[84] Julien Riou und Christian Althaus kamen durch Simulationen zu dem Schluss, dass der geschätzte Überdispersionsparameter bei COVID-19 etwas höher sei als der bei SARS-CoV und MERS-CoV.[85] In einem Preprint von Gabriel Leung und Kollegen, in dem Kontaktpersonennachverfolgungsdaten verwendet wurden, um SARS-CoV-2-Cluster in Hongkong zu identifizieren und zu charakterisieren, wurde der Überdispersionsparameter auf 0,45 geschätzt (95 %-Konfidenzintervall: [0,31–0,76]). Dies stelle eine beträchtliche individuelle Heterogenität in der Übertragbarkeit von SARS-CoV-2 dar und ist damit mit einem hohen Potenzial für zukünftiges Superspreading verbunden, allerdings nach ihren Resultaten weniger stark als bei SARS-CoV und MERS-CoV.[86] Spätere Studien gehen von einem geschätzten Überdispersionsparameter von etwa 0,1 aus.[84] Es gibt empirische Belege dafür, dass die Verteilung der Anzahl der Sekundärübertragungen „fette Verteilungsenden“ aufweist. Außergewöhnliche Übertragungsereignisse sind daher zwar extreme, aber dennoch wahrscheinliche Ereignisse, die einen beträchtlichen Beitrag zur Gesamtübertragung leisten (siehe dazu ausführlich in Überdispersion#Anwendung in der Epidemiologie). Inkubationszeit, Serielles Intervall und Zeitspanne der Infektiosität InkubationszeitDie Inkubationszeit (also der Zeitraum zwischen Ansteckung und Beginn der Erkrankung) kann laut Informationen des Robert Koch-Instituts (RKI) bis zu 14 Tage betragen.[87] Das RKI und auch eine statistische Auswertung mehrerer Berichte von Infektionen in einem Haushalt oder in anderer enger räumlicher Begrenzung (sogenannte Cluster) haben die Inkubationszeit auf 5–6 Tage im Median beziffert.[88] In Korea wurde anhand der Daten von 303 Patienten mit einem Durchschnittsalter von 25 Jahren der Zeitraum zwischen erstem Positivtest und Krankheitssymptomen zu 15 Tagen (Ø) ermittelt. Die Abklingzeit bis zum Negativtest betrug bei symptomatischen 19,5 und bei asymptomatischen Patienten 17 Tage.[89] Eine Analyse der ersten 425 in Wuhan gemeldeten Fälle ergab eine Inkubationszeit von im Mittel 5,2 Tagen und ein Durchschnittsalter von 59 Jahren. Die Autoren vermuteten, dass bereits Mitte Dezember 2019 im Umfeld des Fischmarktes Übertragungen von Mensch zu Mensch stattfanden.[73] Infektiosität während der Inkubationszeit und im Verlauf mit oder ohne SymptomeEine Ansteckung anderer Menschen während der Inkubationszeit ist trotz beschwerdefreien Gesundheitszustands möglich. Tests auf die Viruslast im Sputum von Patienten legen außerdem den Verdacht nahe, dass manche Patienten auch während der Ausheilung bei klinischer Besserung weiterhin vorübergehend infektiös sein können.[90] In einer Gruppe von 126 aus Wuhan nach Deutschland Evakuierten zeigten sich zwei Patienten in der RT-PCR des Rachenabstrichs positiv, die keine oder nur sehr unspezifische Beschwerden aufwiesen.[91] Ebenso ist ein Fall eines subjektiv asymptomatischen zehnjährigen Jungen in Shenzhen beschrieben, dessen Blutbild und Entzündungszeichen im Labor unauffällig waren. In der weiteren Untersuchung zeigten sich jedoch radiologische Befunde vereinbar mit einer Pneumonie, und im Rachenabstrich ließ sich Virus-RNA nachweisen.[35] In einer Untersuchung einer dreiköpfigen Familie aus Guangzhou im Februar 2020 waren alle Familienmitglieder PCR-positiv, aber nur der Vater zeigte Symptome. Die Autoren hielten es hypothetisch für möglich, dass nicht der Vater der Patient 1 gewesen sein könnte, sondern ebenso auch die anderen beiden asymptomatischen Personen hierfür in Frage kommen, und warnten aufgrund dessen vor einer Verbreitungsgefahr des Virus durch beschwerdefreie Patienten in frühen Infektionsstadien.[92] Messungen der Viruslast im Sekret des Nasenrachenraums von 14 mit COVID-19 diagnostizierten Patienten ergaben eine ähnlich hohe Viruslast bei symptomfreien Patienten (einer von 14 Untersuchten) und solchen mit Symptomen (13 von 14 Untersuchten, von denen zehn leicht bis mittelschwer erkrankten und drei so schwer, dass sie intensivmedizisch behandelt werden mussten).[50] Aufgrund von quantitativen Virusuntersuchungen im Sekret des Nasenrachenraums bei Patienten mit sehr leichten Symptomen schlossen die Forscher der Virologie der Charité und des Instituts für Mikrobiologie der Bundeswehr, dass auch bereits bei sehr milden Erkrankungssymptomen eine hohe Infektionsfähigkeit besteht.[93][94] Auch das Robert Koch-Institut hat über einzelne Fälle berichtet, bei denen sich Betroffene möglicherweise bei infizierten Personen angesteckt haben, die noch keine oder keine spezifischen Symptome hatten.[95] Zum gleichen Ergebnis kamen chinesische Fallbeobachtungen, bei denen asymptomatische Patienten im häuslichen Umfeld andere Menschen ansteckten.[96][97] Eine weitere Studie aus China kam anhand von Kontaktpersonennachverfolgung und der Analyse des Virusgenoms zu der Vermutung, dass die Bildung eines Infektionsclusters auf eine asymptomatische Person zurückging. Die vermutete asymptomatische Patientin 1 kehrte am 19. März 2020 aus den USA zurück und wurde aufgefordert, sich in häusliche Quarantäne zu begeben. Sie wohnte im selben Haus, befand sich jedoch nie in körperlicher Nähe mit den später Infizierten und wurde selbst nie PCR-positiv getestet. Etwa 20 Tage nach der vermuteten Ansteckung des Clusters war ihr IgG-Wert positiv, für die Autoren ein Hinweis („indicating“), dass sie früher mit SARS-CoV-2 infiziert war. Die Autoren glaubten („we believe“) deshalb, dass sie die asymptomatisch Infizierte war und dass Patient 2 durch Kontakt mit Oberflächen im Aufzug des Gebäudes, in dem beide wohnten, infiziert wurde. Außerdem zeigte eine Analyse des Virusgenoms, dass es sich vom bisher in China zirkulierenden Genom unterschied – für die Autoren ein Hinweis („indicating“), dass es aus dem Ausland stammte und vermutlich („suggesting“) Patient 1 der Ursprung des Infektionsbaums war.[98] In einer Studie an 191 Krankenhauspatienten zeigten chinesische Forscher bei den 137 Überlebenden ein positives Testergebnis der RT-PCR für im Mittel zwanzig Tage mit einer Streuung zwischen acht und 37 Tagen.[99] Eine Analyse von Infektionen in Singapur und Tianjin ergab, dass 48 % bis 62 % der Infektionen von Menschen übertragen wurden, die COVID-19-infiziert waren, aber noch keine Symptome zeigten.[100] Ein wesentlicher Unterschied zum SARS-Coronavirus ist, dass Patienten schon einige Tage vor Einsetzen der Krankheitssymptome infektiös sein können (beim SARS-Coronavirus waren die Patienten hingegen erst nach Auftreten der Symptome infektiös). Die Infektion lässt sich daher schwerer erkennen und schwieriger eindämmen. Bei Quarantänemaßnahmen reicht es deswegen nicht aus, nur die klinisch auffälligen Personen zu isolieren.[101] Eine im April 2020 veröffentlichte chinesische Untersuchung[102] bestätigte die große Rolle von präsymptomatischer Übertragung bei COVID-19. Aus den Daten berechneten sie (wie sich später zeigte, mit einem Rechenfehler, siehe unten), dass bei den untersuchten Fällen die Infektiosität 2 bis 3 Tage vor Ausbildung von Symptomen begann. Untersucht wurden 94 Fälle aus einem Krankenhaus in Guangzhou, bei denen der zeitliche Verlauf der Viruslast im Rachen ermittelt wurde. Sie war bei Symptombeginn schon ausgeprägt und zeigte danach einen Abfall. Außerdem wurden 77 Fälle von Paaren aus einer Infektionskette innerhalb und außerhalb von China untersucht. Diese zeigte, dass die Infektion bei 44 Prozent vor Ausbildung von Symptomen beim Infizierenden stattfand. Die Infektionsperiode begann im Mittel 2,3 Tage vor Symptombeginn und hatte einen Höhepunkt 0,7 Tage vor Symptombeginn. Innerhalb einer Woche nahm die Infektiosität rasch ab. Das serielle Intervall betrug im Mittel 5,8 Tage. Bei einer Nachuntersuchung der Daten von Leung und Kollegen fand ein Team um Sebastian Bonhoeffer von der ETH Zürich einen Fehler im Computerprogramm, durch den zwei Datenpunkte versehentlich wegfielen. Tatsächlich begann die infektiöse Periode etwa 5 Tage vor Beginn der Symptome. Der Anteil präsymptomatischer Ansteckungsfälle von rund 45 Prozent bleibt aber gleich.[103][104] Leung und Kollegen haben den Fehler eingeräumt. Die Korrektur hat auch Auswirkung auf das Kontakt-Tracing, das auf 5 bis 6 Tage vor Symptombeginn (statt wie bisher 2 bis 3 Tage) ausgedehnt werden müsste. Infektiosität von GenesenenÄrzte der Sun-Yat-sen-Universität in Guangzhou berichten von einem Fall, der nach einem milden Verlauf und zwei negativen RT-PCR-Ergebnissen aus Abstrichmaterial erneut ohne Beschwerden einen positiven Virusnachweis ergeben habe. Die Studienautoren empfehlen routinemäßige Tests und eine zweiwöchige Quarantäne auch bei beschwerdefreien Ausgeheilten, um potenzielle Neuinfektionen zu verhindern.[105] Eine Studie aus Peking stellte im März 2020 bei 22 von 133 entlassenen Patienten bei negativem Rachenabstrich weiterhin nachweisbare Virus-RNA im Stuhl oder im Sputum fest. Die Autoren empfahlen zum Ausschluss einer Infektionsgefahr durch entlassene Patienten über den Rachenabstrich hinausgehende RT-PCR-Testung.[106] Die Weltgesundheitsorganisation gab in ihrem wöchentlichen „Epidemiological Update“ im August 2021 zum Risiko einer erneuten Infektion an, bei der in Deutschland vorherrschenden Delta-Variante werde eine Reduzierung der Immunität berichtet.[107] Serielles IntervallDas serielle Intervall, das heißt der zeitliche Abstand vom Beginn der Erkrankung einer Person zum Beginn der Erkrankung einer von ihr infizierten Person in einer Infektionskette, betrug nach einer im Januar 2020 veröffentlichten chinesischen Studie mit 425 Patienten im Mittel 7,5 Tage (Standardabweichung 3,4 Tage),[73] nach einer anderen Studie mit 28 Fällen 4 Tage.[11][108] Auch eine Studie mit 468 bestätigten Infektionspaaren aus ganz China im Januar/Februar 2020 kam auf ein serielles Intervall von im Mittel 3,96 Tagen (95 %-Konfidenzintervall 3,53 bis 4,39 Tage, Standardabweichung 4,75 Tage).[109] Darunter waren auch 59 Fälle (12,6 Prozent der Fälle), in denen die Symptome beim Infizierten früher auftraten als bei der infizierenden Person. In einer Studie zu 312 Übertragungen wurde als Mittelwert des seriellen Intervalles 4,46 Tage angegeben. Darin wurden Übertragungen bereits am ersten Tag nach der Ansteckung festgestellt. Am dritten Tag war das Übertragungsrisiko am höchsten. Nach 10 Tagen sank das Übertragungsrisiko deutlich ab, war aber immer noch vorhanden.[110] Krankheitsentstehung bei COVID-19Das COVID-19 auslösende Virus SARS-CoV-2 dringt wie SARS-CoV-1 bei SARS über eine Bindung an das in der Zellmembran verankerte Enzym ACE2 in die menschliche Zelle ein.[111] Dabei interagiert das virale Spike-Glykoprotein mit ACE2. Für diesen Prozess ist die Mitwirkung der Serinprotease TMPRSS2 notwendig.[112] Im Versuch mit HeLa-Zellen, die ACE2 des Menschen, der Chinesischen Hufeisennase (Rhinolophus sinicus), einer Schleichkatzenart, des Hausschweins und der Maus exprimieren, konnte SARS-CoV-2 das jeweilige ACE2-Protein als Rezeptor nutzen, um in die Zelle einzudringen, nur bei dem Maus-ACE2 gelang dies nicht, ebenso wenig bei HeLa-Zellen, die kein ACE2 bildeten. An Rezeptoren, die von anderen Coronaviren genutzt werden, findet keine Bindung von SARS-CoV-2 statt.[111] Das Protein LRRC15 ist vermutlich ein Resistenzfaktor gegen SARS-CoV-2 und hemmt dessen Vermehrung. Eine reverse Suche in einer humanen Zelltypen- und Genexpressions-Datenbank (Human Cell Atlas, kurz: HCA) nach Zelltypen und Geweben, bei denen neben ACE2 auch TMPRSS2 auf Membranoberflächen vorhanden ist, zeigte, dass in der Nasenschleimhaut vor allem den Becherzellen, aber auch den Flimmerepithelen die höchsten Konzentrationen dieser beiden Proteine auftreten. Daher werden diese Zellen als Eintrittspforte für SARS-CoV-2 angesehen und auch als Reservoir vermutet.[113][114] Die Proteine werden ebenso in den Hornhaut-Zellen des Auges, in der Darmschleimhaut sowie im Herz in Perizyten der Blutkapillaren, Herzmuskelzellen und Fibroblasten gebildet. Dabei bleibt die erste Phase des Befalls im Nasenrachen nahezu symptomfrei, während bei Übergang in eine schwere Verlaufsform überwiegend die Lunge angegriffen wird, da ein Großteil der ACE-2 exprimierenden Zellen des Menschen in den Typ-II-Pneumozyten der Lunge vorkommt.[115][116] Als weitere Gründe für die besondere Anfälligkeit der Lunge wird ihre große Oberfläche angegeben,[116] außerdem exprimieren die Pneumozyt-Typ-II-Zellen diverse Gene, die die Replikation und Transmission von SARS-CoV-2 begünstigen.[115] Bei Untersuchungen an kryokonservierten Lungengewebsproben von Nichtinfizierten konnte auch gezeigt werden, dass Lungengewebe kaum ACE2 sowie die Transmembranprotease TMPRSS2 ausbildet, die Pneumozyten Typ II in der Lunge hingegen vermehrt. Diese Vorläuferzellen waren bei Männern und in fortgeschrittenem Alter tendenziell vermehrt nachzuweisen. Neben unterschiedlichen ACE2-Werten bei Männern und Frauen wird eine Ursache für die unterschiedliche Schwere der Erkrankung im geschlechtsspezifischen Hormonhaushalt vermutet: „Östrogen fördert eine Immunantwort, Testosteron dagegen unterdrückt sie“.[117] Eine Rolle der im Lungenepithel und benachbarten Gewebezellen gebildeten Proprotease Furin, die bei anderen Coronaviren dem Virus den Zellzutritt vereinfacht, wird diskutiert, da es am Spike-Protein von SARS-CoV-2 eine Furin-spezifische Trennstelle gibt. Außer in der Lunge wurde ACE-2 auch im Dünn- und Dickdarm, in den Atemwegen und in den Nieren nachgewiesen.[118] Eine Vermehrung des Virus in Darmzellen[119] und Inselzellen der Bauchspeicheldrüse wurde bestätigt.[120] Durch Untersuchung von Lungengewebe mittels Biopsien oder Autopsien konnte ein diffuser Schaden an den Lungenbläschen nachgewiesen werden. Dieser zeigte sich in der Bildung hyaliner Membranen, der Verdickung der Alveolarwände und der Einwanderung von einkernigen Immunzellen und Makrophagen. Elektronenmikroskopisch ließen sich Viruspartikel in den Pneumozyten Typ 2 und den Zellen der Bronchien nachweisen. Neben den Veränderungen in der Lunge wurden auch Nekrosen der Lymphknoten am Lungenhilus, Lebervergrößerungen mit Entzündungszellinfiltrat, Atrophien der Milz und bei einzelnen Patienten vereinzelte degenerierte Nervenzellen des Gehirns beobachtet. Ob die Schäden außerhalb der Lunge direkt dem Virus oder der allgemeinen Belastung des Organismus durch die Erkrankung zuzuschreiben sind bleibt unklar.[121] In einer anderen Obduktionensserie zeigten sich herdförmige kleinste Thromben in den Lungenkapillaren auch in Abwesenheit von größeren Thrombosen im Organismus. Darüber hinaus zeigte sich bei fortgeschrittener Erkrankung auch ein fibrotischer Umbau der Lungenareale. Eine diffuse alveoläre Schädigung wie beim klassischen ARDS zeigte sich nur bei Patienten, die auch invasiv beatmet worden waren. Die Autoren schlossen daraus, dass die Bildung der Blutgerinnsel in den kleinsten Blutgefäßen den führenden Mechanismus der COVID-assoziierten Lungenschädigung darstellte.[122] Das Eindringen des Virus in die Riechsinneszellen über die Nasenschleimhaut ist nachgewiesen. Eine Ausbreitung des Virus über diese Nervenzellen in das zentrale Nervensystem wird vermutet.[123] In einigen wenigen Fällen wurde das Auftreten eines Guillain-Barré-Syndroms diagnostiziert, das oft mit Virusinfektionen assoziiert ist. Die Patienten waren PCR-positiv – ein Liquornachweis gelang nicht. In der Bildgebung waren die Cauda equina sowie der Nervus facialis auffällig darstellbar. Symptomatisch zeigten sich Parästhesien und Paresen (motorische Ausfälle).[124] In einem weiteren Fallbericht wurde eine virusinduzierte Encephalitis auch durch positiven PCR-Nachweis in der Cerebrospinalflüssigkeit bestätigt.[125] Die Deutsche Gesellschaft für Neurologie (DGN) empfiehlt in einer eigens für die COVID-Erkrankung herausgegebenen Leitlinie eine fortlaufende Kontrolle besonders stationär, aber auch ambulant versorgter Patienten auf Frühzeichen neurologischer Mitbeteiligung.[126]  Italienische Intensivmediziner haben im April 2020 aufgrund ihrer klinischen Beobachtungen für das Vorhandensein zweier Erscheinungsformen der COVID-19-Viruspneumonie plädiert. Die Pneumonie beginne meist mit dem L-Typ, der sich durch ein geringes Vorhandensein eines Ödems im Gewebe auszeichne. Bei einem Teil der Patienten erfolge der Übergang in einen H-Typ, der sich durch ein Ödem im Gewebe auszeichne. Die Forscher plädieren für eine unterschiedliche Vorgehensweise bei der Beatmung dieser zwei Typen.[127] Bei Vorliegen extrem erniedrigter Sauerstoffsättigung, die auf eine massive Gasaustauschstörung schließen lässt und in Verbindung mit einer Bildgebung eindeutig auf ein akutes Lungenversagen (ARDS) deutet, weichen deutsche Pneumologen mittlerweile auch von bisherigen Leitlinien ab und empfehlen zunächst eine lungenschonendere nichtinvasive Beatmung (NIV) mit O2-Anreicherung.[128] Weitere führende Pneumologen regten ebenfalls aufgrund der vermehrten Endothelschäden befallener Lungengefäße an, nicht die klassische Beatmungsstrategie für ein entzündliches Pneumonitis-ARDS, sondern bei noch gegebener Elastizität mit an das von ihnen zur Unterscheidung als CARDS benannte klinische Bild bei COVID durch adaptierte Tidalvolumina und Expirationsdrucke (PEEP) anzupassen.[129] Eine feingewebliche Untersuchung an sechs verstorbenen Patienten zeigte bei den fortgeschrittenen Lungenerkrankungen, die klinisch dem H-Typ zuzuordnen sind, die Ausbildung von Fibrinballen in den Lungenbläschen mit einem Infiltrat aus T-Lymphozyten und Plasmazellen sowie einer Hyperplasie der Typ-II-Pneumozyten. In den Blutgefäßen fanden sich Zeichen einer Endothelschädigung mit Ausbildung von Vakuolen im Zellplasma sowie der Unterbrechung der Verbindungen zwischen den Endothelzellen. Die Autoren stellten die Hypothese auf, dass der H-Typ als spätere Verlaufsform der COVID-Lungenkrankheit feingeweblich das Bild einer akut-fibrinösen organisierenden Pneumonie zeige.[130] Eine Untersuchung der Lungen von sieben Verstorbenen zeigte eine deutlich erhöhte Gefäßneubildung durch Lumenteilung in den befallenen Lungengefäßabschnitten. Die Autoren stellten die Hypothese auf, dass die krankhaft gesteigerte Gefäßneubildung zum Lungenschaden beitrage.[131] Beim Übergang von milden zu schweren Verläufen wird mittlerweile ein virusinduzierter septischer Schock angenommen, der auf einem immunologischen Mechanismus basiert. Bei milden Fällen gelinge es dem Immunsystem, die Virusvermehrung in der Lunge rasch aufzuhalten. Bei schweren Fällen gelänge dies aber durch die virusbedingte Dysfunktion der direkt infizierten T-Zellen nicht. Die Virusvermehrung in den Lungenepithelzellen und auch den Innenschichtzellen der Lungenkapillaren führe zu einem Kapillarleck, das zur Einlagerung von Flüssigkeit in den Lungenbläschen führe. Durch die unkontrollierte Virusvermehrung komme es zu einer weiteren Einwanderung von Monozyten und Granulozyten. Dabei waren entzündungsverstärkende Zytokine und Chemokine einschließlich TNF-α, Interleukin-1β, IL-6, CXCL10, CCL2 und MIP-1α signifikant erhöht, wodurch sich Immunzellen am Ort einer Entzündung ansammeln und die Immunantwort verstärkt wird. Die Entzündungsreaktion in der Lunge führe zusammen mit dem Übergreifen des Virus auf andere Organe zu einer überschießenden Immunreaktion im Sinne des Zytokinsturms, der wiederum lokal zu weiterer Zellschädigung führt und im Anschluss die Lymphozytenzahl – besonders CD4+- und CD8+-T-Zellen – reduziert (Lymphopenie).[132] Bei milden Verläufen wurde kein signifikanter Abfall von Effektor-T-Zellen beobachtet. Bei schweren Verläufen korreliert deren Wiederanstieg mit der Heilung der Erkrankung.[133] Ebenso fand sich in einer kleinen Studie, dass überlebende Patienten vor allem IgG-Antikörper gegen das Spike-Protein bilden und an der Erkrankung Verstorbene vor allem IgG-Antikörper gegen das Nucleocapsid ausbilden.[134] Als weiterer Mechanismus wird eine direkte Freisetzung des spezifischen Transkriptionsfaktors NF-κB angesehen, die wiederum IL-6 hochreguliert. Zusätzlich ist durch die infektionsbedingte Reduktion von ACE2 ein Anstieg von Serum-AngII beobachtbar, was wiederum über die AngII-AT1R-Achse auch NF-κB, Disintegrin und die Sekretase ADAM17 (englisch ADAM metallopeptidase domain 17) aktiviert, die die reife Form der Liganden des epidermalen Wachstumsfaktor-Rezeptors (EGFR) und TNFα, sowie zwei NF-κB-Stimulatoren erzeugt.[135] Die ADAM17-Induzierung verarbeitet auch die Membranform von IL-6Rα zur löslichen Form (sIL-6Rα), gefolgt von der gp130-vermittelten Aktivierung von STAT3 über den IL-6/sIL-6Rα-Komplex in IL-6Rα-negativen Zellen, wie Fibroblasten, Endothel- und Epithelzellen.[136] So kann eine SARS-CoV-2-Infektion im Atemtrakt sowohl NF-κB als auch STAT3 aktivieren, was wiederum den IL-6-Verstärker (englisch IL-6 amplifier, kurz IL-6 Amp) in Gang setzt, einem Mechanismus für die weitere Überaktivierung von NF-κB durch STAT3, was zu unterschiedlichen Entzündungs- und Autoimmunkrankheiten führt.[136] Dabei wird der IL-6-Verstärker in einer positiven Rückkopplungsschleife durch die Induzierung verschiedener entzündungsfördernder Zytokine und Chemokine, einschließlich Interleukin-6, und die Rekrutierung von lymphoiden und myeloischen Zellen, wie zum Beispiel aktivierte T-Zellen und Makrophagen, verstärkt. Dieser Prozess wird als Zytokinsturm bezeichnet und ist die Ursache für das akute Lungenversagen bei einer SARS-CoV-2-Infektion. Da IL-6 als wichtiger Marker für Seneszenz gilt, könnte der IL-6-Verstärker auch für die höhere Mortalität unter Älteren angesehen werden.[137] Vergleichende Untersuchungen mit anderen Formen des akuten Lungenversagens und Entzündungssyndromen kommen jedoch zu dem Schluss, dass die Menge der freigesetzten Entzündungsmediatoren bei einer schweren COVID-19-Erkrankung deutlich niedriger ist als bei anderen mit einem Zytokinsturm vergesellschafteten Erkrankungen. Dies wird als Hinweis gewertet, dass auch andere Mechanismen der Krankheitsentstehung wie Gefäßentzündung, direkte virale Schädigung oder durch das Virus induzierte Immunschwäche stark zur Schwere der Erkrankung beitragen.[138] Interferon-1 ist ein zentraler Regler der zellulären Immunantwort gegen Viren. Im Gegensatz zu anderen respiratorischen Viren zeichnet sich COVID durch eine Verminderung von Interferon-1 und Interferon-3 aus.[139] Ebenso wurde eine Verminderung der Produktion von Interferon-1 durch das Virusprotein Orf9b im Zellmodell nachgewiesen.[140] In einer Studie wurden bei 3,5 % Prozent untersuchter COVID-Patienten mit schwerem Verlauf angeborene Defekte der Interferon-1-Bildung festgestellt.[141] Interferon alpha spielt eine komplexe, janus-artige Rolle für die Pathogenese von COVID-19. Obwohl es die Elimination virusbefallener Zellen fördert, reguliert es auch die Expression von ACE-2 hoch, so dass es zugleich den Eintritt von SARS-Cov2-Viren in Zellen und deren Replikation erleichtert[114][142]. Ein Wettbewerb negativer (über den protektiven Effekt von Interferon Alpha) und positiver Rückkoppelungen (über Hochregulation von ACE-2) ist daher entscheidend für den Verlauf der Erkrankung[143]. Forscher aus Wuhan haben im März 2020 in einer Studie auch von Herzmuskelschäden berichtet. Bei rund einem Fünftel der 416 untersuchten hospitalisierten Patienten zeigte sich neben der Lungenschädigung auch eine Schädigung des Herzmuskels. Die Ursache der Herzschädigung sei noch nicht klar. Sie vermuteten eine negative Wirkung der im Rahmen der Pneumonie ausgelösten Entzündungsreaktion[144] sowie eine direkte Infektion und erhöhter Stress des Herzens durch die mangelnde Sauerstoffversorgung und die höhere Kreislaufbelastung. Bei Autopsien zeigten sich Entzündungsinfiltrate, die mit Regionen von Zelluntergang korrelierten. Das Bild der Herzmuskelschädigung war in diesen Fällen vereinbar mit einer Myokarditis.[28] Deren Ausbildung ohne bekannte koronare Vorerkrankung wurde auch ohne Beteiligung der üblichen Pneumonitis beobachtet.[145] Mit dem Alter steigt die Expression von ACE2 und TMPRSS2 in Herzmuskelzellen an, über die der Zellzutritt erfolgt. Die Schädigung der Kardiomyozyten ist korreliert mit dem Anstieg von Troponin, einem typischen Marker für Herzinfarkt. Resultiert eine Pumpschwäche des linken Ventrikels, könne das die verminderten Überlebenschancen Älterer erklären. Diese Zusammenhänge, sowie eine höhere Expression eines IL-6 Rezeptors auf Kardiomyozyten im Alter, der für den Zytokinsturm verantwortlich ist, wurde bei postmortem Untersuchungen des Herzens von Patienten gefunden, die nicht an kardialen Erkrankungen, aber auch nicht durch SARS-CoV-2 verstarben.[146] Im Fall zweier relativ junger und nicht vorerkrankter Patienten, die aufgrund geschilderter Symptome einen grippeähnlichen Infekt durchgemacht hatten, zeigte sich 4 Wochen später Atemnot, die den Verdacht einer Herzmuskelfunktionsstörung nahelegte. PCR-Tests der zur Verdachtsabklärung entnommenen Biopsate waren positiv, sodass die Herzerkrankung als Folge einer SARS-CoV-2-Infektion vermutet wird.[147] In einer weiteren Fallserie wurde in Gewebeproben von 104 Patienten, die wegen des Verdachts einer Myokarditis oder anderer entzündlicher Herzkrankheiten untersucht wurden, bei 5 von ihnen das Virusgenom von SARS-CoV-2 nachgewiesen. Bei allen – zwischen 36 und 62 Jahre alt – war es zu einer deutlichen Pumpschwäche gekommen und Troponin bei 4 der 5 Patienten erhöht. Die Studie legt nahe, dass nach einer COVID-19-Erkrankung mit einer Herzbeteiligung zu rechnen ist, obwohl der direkte Nachweis, dass das Virus den Herzmuskel angreift, noch nicht erbracht sei.[148] Ebenso konnte eine Virusvermehrung in den Nierenkanälchen mit akuter Schädigung des Tubulus durch die nachfolgende Entzündungsreaktion an einzelnen Obduktionsfällen nachgewiesen werden.[18] In seltenen Einzelfällen tritt bei Kleinkindern vermehrt das Kawasaki-Syndrom auf, eine Gefäßentzündung bei der als Begleitsymptom z. B. Hautausschläge auftreten. Ein direkter Zusammenhang mit einer SARS-CoV-2 Infektion wird vermutet.[149][150] Von der WHO wurde dieses Krankheitsbild multisystem inflammatory syndrome in children (MIS-C) benannt.[151] Mit Stand 1. Juli sind weltweit mehr als 1000 Kinder mit diesem eher seltenen Syndrom erkrankt. In einer Studie wurden 186 Fälle diagnostiziert, wobei das Durchschnittsalter bei 8,3 Jahren lag. Die Inzidenz beträgt 2 auf 100.000. Die ersten Anzeichen etwa 2 bis 4 Wochen nach Infektion bestehen in hohem Fieber, Tachykardie, gastrointestinalen Symptomen, Hautausschlag sowie konjunktivalen Injektionen. CRP war bei allen, außerdem D-Dimer-Werte und Troponin bei den meisten erhöht. Etwa die Hälfte zeigte Zeichen einer Myokarditis, 80 % mussten intensiv behandelt werden. Zwei Kinder verstarben.[152] Klinische Symptome und laborchemische Krankheitszeichen
Nach einer Inkubationszeit (siehe oben) von durchschnittlich 5 bis 6 Tagen (in seltenen Fällen bis zu 14 Tagen) treten als häufigste Symptome Husten, Fieber, Schnupfen sowie Geruchs- und Geschmacksverlust auf. Häufig leiden die Erkrankten zudem an Abgeschlagenheit sowie Hals-, Muskel-, Rücken-, Kopf- und Gliederschmerzen.[156] Allgemein manifestiert sich die Krankheit oft in einem schweren Krankheitsgefühl.[157] Weitere Symptome können dabei Übelkeit, Appetitlosigkeit, Erbrechen, Bauchschmerzen und Durchfall sowie Bindehautentzündungen, Hautausschläge und Lymphknotenschwellungen sein.[158] Es gibt aber auch Fälle von asymptomatischen Verläufen, insbesondere bei Geimpften. Deren Anteil ist jedoch nicht abschließend geklärt.[159] Schwere VerläufeIm weiteren Verlauf entwickelt sich, meist ab der zweiten Krankheitswoche, bei etwa 14 Prozent der Patienten[159] eine schwere Atemnot aufgrund einer Infektion der unteren Atemwege bis zur Lungenentzündung.[160] Diese kann mit Brustschmerzen im Sinne einer Pleuritis einhergehen und „bis zum Versagen der Atem- und Kreislauffunktion fortschreiten“ (ARDS),[158] welche unter Umständen eine intensivmedizinische künstliche Beatmung und externe Sauerstoffaufsättigung des Blutes erforderlich macht[156] (ca. 5 % aller Fälle).[161] Die längste dokumentierte Beatmung fand bei einem über 70-jährigen Patienten aus New York City über einen Zeitraum von 850 Tagen statt.[162] „Einige schwer Erkrankte entwickeln acht bis 15 Tage nach Erkrankungsbeginn eine Verschlechterung ihres Krankheitszustandes infolge schwerer Entzündungsreaktionen (Hyperinflammationssyndrom). In der Folge können mehrere Organe versagen. Viele der [davon] Betroffenen versterben.“[158] Im Bericht des Chinesischen Zentrums für Krankheitskontrolle und -prävention (englisch Chinese Center for Disease Control and Prevention, kurz: CCDC) über 44.415 Fälle aus Wuhan erfolgt die Klassifizierung als leichter Krankheitsverlauf, wenn keine oder nur eine leichte Lungenentzündung vorliegt, für einen schweren Krankheitsverlauf sind Pneumonie (Lungenentzündung), Dyspnoe (Atemnot), eine Atemfrequenz von ≥ 30 Atemzüge pro Minute, eine Sauerstoffsättigung des Blutes ≤ 93 % und weitere klinische Anzeichen typisch, bei einem kritischen Krankheitsverlauf ist mit Atemversagen, septischem Schock und/oder Multiorganversagen zu rechnen. Der Fallbericht stellte 81 % leichte Krankheitsverläufe, 14 % schwere Krankheitsverläufe und bei 5 % einen kritischen Krankheitsverlauf fest.[14] Bei einem leichten Verlauf bestehen laut RKI häufig keine Symptome,[11] oder sie klingen laut WHO innerhalb von zwei Wochen ab.[163] Bei Menschen mit einem schweren Krankheitsverlauf dauere es zwischen drei und sechs Wochen, bis sie sich von der Krankheit erholen.[163] Die Mehrheit der Krankenhauseinweisungen der ersten Patienten erfolgte nach rund einwöchiger symptomatischer Krankheit aufgrund einer Verschlechterung des Zustandes. In den Fällen, in denen eine intensivmedizinische Behandlung notwendig wurde, ergab sich deren Notwendigkeit nach rund zehn Tagen nach Symptombeginn.[160] In einer epidemiologischen Studie von 99 hospitalisierten Fällen fanden bei 13 Patienten eine nicht-invasive Beatmung, bei vier Patienten eine invasive Beatmung, bei neun Patienten eine Dialyse aufgrund eines Nierenversagens und bei drei Patienten eine extrakorporale Lungenunterstützung (ECLA) Anwendung.[164] Klinische Beobachtungen schildern häufig geringe Beschwerden trotz apparativ messbarer Ateminsuffizienz. So zeigten sich Patienten, die aufgrund einer geringen Sauerstoffsättigung eigentlich beatmungspflichtig waren, oft erst noch relativ beschwerdefrei,[165] ehe sich ihr Befinden aufgrund der Sauerstoffschuld im Organismus rapide verschlechterte.[166] Etwa 85 % der schwer erkrankten COVID-19-Patienten entwickeln eine Lymphopenie, das heißt einen Mangel an Lymphozyten im Blut.[167] Bei tödlich verlaufenden Erkrankungen kam es zu einer anhaltenden Lymphopenie. Die schwer erkrankten Patienten entwickeln häufig zudem eine Hyperzytokinämie (Zytokinsturm).[168] Ein Zytokinsturm entsteht durch eine Überreaktion des Immunsystems. Diese Überreaktion ist durch einen deutlichen Anstieg von entzündungsrelevanten Zytokinen wie beispielsweise Interleukin-6, Interleukin-8, Interleukin-1β und TNF-α gekennzeichnet. Die verstärkte Freisetzung dieser Zytokine führt zu einer Überproduktion von Immunzellen, vor allem im Lungengewebe. Dort werden von den Immunzellen weitere Zytokine ausgeschüttet (Mitkopplung). Diese unkontrollierte Immunantwort führt zu schweren entzündlichen Erkrankungen wie beispielsweise Lungenentzündung, Atemnot und Entzündungen der Atemwege.[169][170] Zytokinsturm und Lymphopenie werden als „lymphopenische ambulant erworbene Pneumonie“ (englisch lymphopenic community acquired pneumonia, L-CAP) zusammengefasst. L-CAP ist mit schwerem Krankheitsverlauf, erhöhter Sterblichkeit und fehlgesteuerter Immunantwort verbunden. Man geht davon aus, dass eine frühzeitige Erkennung dieses immunologischen Phänotyps nützlich sein könnte, um Patienten mit schweren Verläufen rechtzeitig identifizieren zu können.[171] Laborchemisch erwiesen sich sehr hohe Ferritinwerte sowie stark erhöhtes Interleukin-6[99] oder auch erhöhte Werte der LDH, des D-Dimers und eine andauernde Verminderung der Lymphozyten als Faktoren für eine ungünstige Prognose.[172] Die Mehrheit der Patienten zeigte dabei die für schwere Virusinfekte typische Kombination aus einer Verminderung der Anzahl der gesamten weißen Blutzellen, einer Verminderung der Lymphozyten-Anzahl und einer Erhöhung laborchemischer Entzündungsparameter (wie CRP und BSG). Einfluss auf VorerkrankungenEine akute Infektion mit dem Coronavirus SARS-CoV-2 kann auch bestehende Vorerkrankungen wie Herz- und Lungenleiden, Bluthochdruck und Diabetes verschlimmern. Hinweise deuten darauf hin, dass bei Ansteckung mit SARS-CoV-2 – wie durch andere Infektionen und Erkrankungen auch – Autoimmunerkrankungen verursacht oder ausgelöst werden können.[173] So überprüfen Experten derzeit, ob die Infektion sogar die Entstehung eines Typ-1-Diabetes begünstigen kann.[174] Weitere Ausprägungen und KomplikationenSARS-CoV-2 befällt regelmäßig auch das neurologische System. Neben den häufigen Symptomen des Geruchs- und Geschmacksverlustes kann dies auch zu Schwindel, Verwirrtheit, Somnolenz und anderen neuropsychiatrischen Symptome, wie die SARS-CoV-2 assoziierte (Meningo-)Enzephalopathien, führen. Auch „Schlaganfälle, Fälle von Guillain-Barré- und Miller-Fisher-Syndrom sind beschrieben“.[156] An der Johns-Hopkins-Universität wurde an Gewebeproben von 23 COVID-19-freien Patienten die höchste Expression des Enzyms ACE2 in dem Areal der Nase nachgewiesen, das für das Riechen verantwortlich ist, und so den Geruchsverlust bei Infektion erklärt.[175] Oft ist das Herz-Kreislauf-System betroffen. So konnten auch bei Kindern und „Patienten mit mildem oder moderatem Verlauf“ erhöhte Herzenzyme bzw. Troponin nachgewiesen werden. „Insbesondere bei schweren Infektionen der Atemwege erleidet eine Reihe von Patienten kardiovaskuläre Erkrankungen, einschließlich Herzmuskelschädigungen, Myokarditis, Herzinfarkt, Herzinsuffizienz, Herzrhythmusstörungen und venösen thromboembolischen Ereignissen. Die pathologisch erhöhte Blutgerinnung geht bei schweren COVID-19-Verläufen mit einem erhöhten Risiko für Thromboembolien, u. a. in den unteren Extremitäten, sowie Lungenarterien- und zerebrovaskulären Embolien und möglichen Folgeschäden einher.“[156] Berichtet wird außerdem über Fälle von Leberfunktionsstörungen und (insbesondere bei beatmungspflichtigen Patienten) akutem, teils dialysepflichtigem, Nierenversagen. Hinzu kommen zahlreiche dermatologische Manifestationen, wie juckende, morbilliforme Ausschläge, Papeln, Rötungen, Nesselsucht und Frostbeulen-ähnliche Hautläsionen. „In seltenen Fällen sind schwere Durchblutungsstörungen in den Akren bis hin zum Gangrän beschrieben.“[156] „Bei Kindern und Jugendlichen wurden seltene Fälle eines Pädiatrischen Inflammatorischen Multisystemischen Syndroms (PIMS) beobachtet.“[158] Phasen und Dauer des KrankheitsverlaufsAufgrund klinischer Beobachtungen und laborchemischer Untersuchungen wird ein dreiphasiges Krankheitsbild postuliert: Auf eine frühe Infektionsphase folge nach rund fünf Tagen eine Phase, in der die Lungenerkrankung vorherrscht. In milden Verläufen (ca. 81 % der Fälle) klingen die Symptome meist nach rund zwei Wochen wieder ab.[159] Bei einem weiteren Fortschreiten der Erkrankung kann es jedoch um den zehnten Tag nach Symptombeginn zu einer Phase kommen, die durch eine überschießende Immunantwort mit weiterer zunehmender Schädigung der Lunge sowie auch des Herzmuskels gekennzeichnet sei. In der letzten Phase kann es auch zur Erhöhung von Troponin und BNP als Ausdruck der Herzmuskelschädigung und des Funktionsverlusts des Organs kommen.[28] Zu nahezu identischer Einschätzung dieses Drei-Phasen-Verlaufs, der frühen Infektion, der pulmonalen Manifestation und der schweren hyperinflammatorischen Phase mit jeweils differenzierten Therapieempfehlungen zur maschinellen Beatmung während der einzelnen Stadien kommt ein diagnostisch-therapeutischer Leitfaden deutscher Lungenärzte.[128] Schwere Fälle dauern oft mehrere Monate an, teilweise kommt es auch zu sogenannten Long-COVID-Symptomen.[159] Bekannte Risikogruppen für schwere VerläufeRisikogruppen für schwere Krankheitsverläufe sind nach Aussage des Robert Koch-Instituts insbesondere ältere Menschen, Männer, Raucher, Übergewichtige,[176] Menschen mit Trisomie 21 sowie „Personen mit bestimmten Vorerkrankungen:
Eine Mitte Februar 2020 veröffentlichte Auswertung der englischsprachigen und chinesischen Fachartikel kommt zu dem Ergebnis, dass alle Bevölkerungsgruppen infiziert werden können. Von den Infizierten waren 72 % über 40 Jahre alt, 64 % waren männlich. 40 % der Patienten hatten chronische Erkrankungen wie Diabetes mellitus und Bluthochdruck.[177] Dies bestätigt der Bericht der von der WHO in China durchgeführten „gemeinschaftlichen Mission“ (englisch WHO-China joint mission), der weiterhin noch Herz-Kreislauf-Erkrankungen, chronische Atemwegserkrankungen und Krebs nennt.[178] Laut Epidemiologischem Bulletin 19/2021 des RKI steigt nach Auswertung von rund 94.000 Krankheitsfällen das Risiko für einen schweren Verlauf einer COVID-19-Erkrankung beim Vorliegen bestimmter Risikofaktoren:[179] Demnach sind die fünf größten Risikofaktoren hämatoonkologische Erkrankungen (31,5 %), metastasierte solide Tumorerkrankungen mit Therapie (28,2 %), Demenz (24,3 %), metastasierte solide Tumorerkrankungen ohne Therapie (23,3 %) und Herzinsuffizienz (21,7 %). Zusätzlich legen die Ergebnisse der Global Burden of Disease (GBD)-Studie 2019 einen statistisch signifikanten Zusammenhang zwischen dem bereits vor der COVID-19-Pandemie bestehenden Gesundheitsprofil der Weltbevölkerung und der Schwere gesundheitlicher Komplikationen in deren weiteren Verlauf nahe.[180][181] Zudem werden Mangel- bzw. Fehlernährung und Luftverschmutzung hinsichtlich höherer Sterblichkeitsraten in Indien diskutiert.[182] Luftverschmutzung durch z. B. Stickoxide oder Feinstpartikel PM2.5 (Feinstaub) korreliert als Risikofaktor nicht nur mit Lungenkrankheiten, Herzinfarkt, Schlaganfall, sondern auch sehr deutlich mit schweren Verläufen von COVID-19.[183] Schwere Krankheitsverläufe treten aber auch bei Jüngeren und bei Patienten ohne Vorerkrankung auf. Ein Bericht der Centers for Disease Control and Prevention (CDC) zur Altersverteilung in den USA kam zu dem Schluss, dass schwere Verläufe, die eine Hospitalisierung oder intensivmedizinische Versorgung erfordern, bei Erwachsenen jeden Alters auftreten können. Zwar seien besonders Ältere betroffen, allerdings waren 20 % der Hospitalisierten und 12 % der intensivmedizinisch Behandelten des untersuchten Kollektivs 20–44 Jahre alt. Menschen unter 20 zeigten hingegen so gut wie keine schweren Verläufe.[184] Laut einer Metastudie vom Dezember 2020 erkrankten zwar Männer und Frauen etwa gleich häufig an COVID-19; bei Männern war ein schwerer Krankheitsverlauf aber dreimal häufiger als bei Frauen.[185][186] Soziale FaktorenDas CDC berichtete, dass Schwarze oder Afroamerikaner in den USA überdurchschnittlich betroffen sind. In einer Auswertung der Daten bis Anfang August 2020 hatte die Gruppe der „Black or African American People“ demnach eine 4,7-fache Hospitalisierungs- und eine 2,1-fache Todesrate.[187] Laut einer in The Lancet am 30. April 2021 publizierten Beobachtungskohortenstudie[188] hat COVID-19 ethnische Minderheiten in Großbritannien überproportional betroffen. Laut Public Health England starb eine zwei- bis viermal so hohe Rate von Angehörigen ethnischer Minderheiten wie in der weißen Bevölkerung. Mögliche Gründe waren eine höhere Prävalenz von Komorbiditäten im Zusammenhang mit schlechten COVID-19-Ergebnissen (z. B. Typ-2-Diabetes bei britischen Südasiaten), eine größere soziale Benachteiligung, große Haushalte mit mehreren Generationen und beengte Wohnverhältnisse, Unterschiede beim beruflichen Expositionsrisiko sowie der verzögerte Zugang zur Gesundheitsversorgung. Kinder und Jugendliche„Bei Kindern verläuft eine Erkrankung meist ohne Krankheitszeichen oder mild.“[158] Eine Studie an Kindern aus Wuhan stellte eine bestätigte Infektion bei 171 von 1.391 untersuchten Kindern fest. Nur eine Minderheit der Kinder zeigte Fieber oder andere Symptome. Von den infizierten Kindern verstarb ein 10 Monate alter Säugling, der auch an einer Invagination litt. Die Studienautoren werteten die Ergebnisse als einen Hinweis auf einen milderen Verlauf bei Kindern und wiesen auf die Möglichkeit der Übertragung der Erkrankung durch Kinder mit wenig Krankheitszeichen hin.[189] Auch in einer Studie in Island, bei der insgesamt 19.996 Personen auf eine aktive Infektion getestet wurden, zeigten sich Kinder deutlich unterrepräsentiert.[190] Eine Analyse von 2.135 Patienten im Kindesalter in China, die aufgrund eines positiven Tests oder der klinischen Beschwerden als COVID-19 klassifiziert wurden, ergab eine Rate von schweren und kritischen Verläufen von rund sechs Prozent. Gehäuft traten diese bei Säuglingen und Kindern im Vorschulalter auf.[191] Eine südkoreanische Studie, welche die Kontaktverfolgung von rund 60.000 Kontaktpersonen nachvollzog, kam zu dem Schluss, dass das Risiko, von einem Haushaltsmitglied im Alter von 10 bis 19 Jahren angesteckt zu werden, hoch sei. Die niedrigere Rate der Infektionen in Haushalten mit Klein- und Grundschulkindern wurde auf die im Studienzeitraum herrschenden Schulschließungen zurückgeführt. Im Ergebnis zeigte die großangelegte Studie, dass das Übertragungsmuster von SARS-CoV-2 dem anderer Atemwegsviren ähnelt.[192] GenetikIm September 2020 veröffentlichten Forscher des Max-Planck-Instituts Leipzig eine Studie, die neben Alter und Vorerkrankungen einen genetischen Faktor als Determinante für einen schweren Krankheitsverlauf postulierte. Eine gewisse Gruppe von Genen auf Chromosom 3 sorge laut den Autoren Zeberg und Pääbo für ein dreimal höheres Risiko, dass im Verlauf der Krankheit eine künstliche Beatmung nötig wird. Es handle sich dabei um eine von den Neandertalern ererbte Genvariante. Über den Grund der Korrelation zwischen diesen Genen und dem Krankheitsverlauf ist noch nichts bekannt.[193][194] Ende Februar 2021 wurde in diesem Kontext eine russische Studie veröffentlicht, die die Beschaffenheit der T-Lymphozyten auf den Zelloberflächen für den Krankheitsverlauf in Teilen verantwortlich macht. Die individuelle genetische Zusammensetzung des HLA-Systems spiele bei der Immunantwort auf das Virus eine fundamentale Rolle. Gewisse Allele des HLA-I scheinen das Virus besser detektieren zu können und das Immunsystem könne schneller reagieren.[195] Eine Studie an 323 COVID-19-Patienten ergab, dass eine erhöhte Konzentration von Perfluorbutansäure im Körper mit einem gesteigerten Risiko eines schwereren Verlaufs einer COVID-19-Infektion korreliert ist.[196][197] SchwangereMit der Ausbreitung neuer COVID-Varianten hat der Anteil der Schwangeren mit schweren Covid-Verläufen deutlich zugenommen. Die meisten Schwangeren mit schweren COVID-Verläufen waren übergewichtig.[198] Die Deutsche Gesellschaft für perinatale Medizin hat bis zum 29. Juli 2021 2686 Schwangere registriert, die mit Covid-19 in einem deutschen Krankenhaus aufgenommen wurden. 106 von ihnen mussten auf einer Intensivstation behandelt werden oder starben.[199] In Großbritannien wird daher die Corona-Impfung seit Mitte April 2021 allen schwangeren Frauen empfohlen.[199][200] Am 11. August 2021 hat die US-Behörde CDC Schwangeren empfohlen, sich impfen zu lassen.[201][202] Das Nationale Impfgremium (NIG) der Republik Österreich hat am 27. April 2021 die COVID-Impfung für Schwangere (mit MRNA-Impfstoffen) empfohlen.[203] DiagnostikFalldefinition und Vorgehensweise bei der DiagnostikDie Falldefinitionen des Robert Koch-Instituts wurden am 24. März 2020 geändert,[204] auf der Website des Robert Koch-Instituts ist ein Flussschema zu finden, wie im medizinischen Bereich mit COVID-19-Verdachtsfällen umzugehen ist:[205] Ebenso wurde dort ein Flussschema für Bürger bereitgestellt, mit Hinweisen zum Verhalten bei Erkrankungssymptomen.[206] Begründete VerdachtsfällePersonen
werden vom Robert Koch-Institut als begründeter Verdachtsfall eingestuft und den zuständigen Gesundheitsämtern gemeldet.[205] Fälle unter differenzialdiagnostischer AbklärungPersonen
werden vom Robert Koch-Institut als Fall unter differenzialdiagnostischer Abklärung eingestuft und sollen zunächst nicht gemeldet werden.[205] In beiden Fällen wird nach Schwere der Erkrankung, Risikofaktoren und Umfeld entschieden, ob eine ambulante oder eine stationäre Versorgung notwendig ist. Bei einer stationären Einweisung wird in jedem Fall eine labortechnische Diagnose durchgeführt, bei der ambulanten Versorgung ist sie Bestandteil der Differentialdiagnose, bei Personen ohne bekannte Risikofaktoren jedoch nur, sofern die Testkapazitäten dies erlauben.[205] Ohne labortechnische Verfahren (also nur anhand der Symptome) ist eine Abgrenzung von anderen Viruserkrankungen wie Influenza „schwierig bis unmöglich“.[207] Auch andere Erreger und Diagnosen können das Krankheitsbild beeinflussen (siehe Syndrome, Komorbidität und Multimorbidität), beispielsweise Erkältungsviren wie Rhino-, Entero- und Mastadenoviren, Paramyxoviridae oder andere Coronaviren. Sie können durch eine Differentialdiagnose mit mikrobiologischem Befund ein- oder ausgeschlossen werden. Definition: »COVID-19-Fall«Ein COVID-19-Fall liegt nach Definition der Weltgesundheitsorganisation (WHO) vor, wenn durch Labortests bei einer Person eine Infektion mit dem Coronavirus SARS-CoV-2 nachgewiesen wurde – ungeachtet klinischer Anzeichen und Symptome – und demzufolge auch wenn eine Corona-Infektion asymptomatisch (ohne erkennbare Symptome) verläuft.[208] Darüber hinaus definiert die WHO auch noch den Verdachtsfall und den wahrscheinlichen Fall. Sie weist darauf hin, dass sich diese Definitionen angesichts neuer Erkenntnisse ändern können und dass die Mitgliedsstaaten die Definitionen an ihre besondere epidemische Lage anpassen können.[208] In Deutschland werden COVID-19-Fälle von den Gesundheitsämtern entsprechend den folgenden Falldefinitionen an das Robert Koch-Institut (RKI) übermittelt:[204]
Fälle der Kategorie 1 sind begründete Verdachtsfälle, Fälle der Kategorien 2 bis 4 sind laborbestätigte COVID-19-Fälle und werden vom Robert Koch-Institut gemeinsam als Fallzahlen veröffentlicht,[204] zur Meldepflicht siehe Abschnitt Meldepflicht, ICD-10-Einordnung, Berufskrankheit. Diese Referenzdefinition des RKI entspricht der WHO-Falldefinition. Zu den COVID-19-Todesfällen werden sowohl Personen gezählt, die unmittelbar an einer COVID-19-Erkrankung verstarben, als auch Corona-Infizierte mit Vorerkrankungen, bei denen sich die genaue Todesursache nicht abschließend nachweisen lässt.[210] Labordiagnostischer Nachweis Laut RKI erfolgt der labordiagnostische, direkte Erregernachweis durch Nukleinsäurenachweis (z. B. RT-PCR, real-time quantitative Reverse-Transkriptase-Polymerase-Kettenreaktion).[204][211] Auch die Erregerisolierung in einer Zellkultur ist möglich,[204] wird aber von der WHO nicht für die Routinediagnostik empfohlen.[212] (Siehe auch: → Abschnitt: Labordiagnostischer Nachweis) Das Virus ist im Sputum, im Trachealsekret, in der bronchoalveolären Spülflüssigkeit und im Nasenrachen-Abstrich sowie im Stuhl direkt nachzuweisen.[213] Die Laboruntersuchung führte in Deutschland erstmals das Konsiliarlabor für Coronaviren an der Charité in Berlin durch, mittlerweile sind zahlreiche andere Labore in Deutschland dazu in der Lage.[214] Bei positivem Befund liegt nun ein laborbestätigter COVID-19-Fall vor.[205] Ist der Befund zwar negativ, besteht aber ein anhaltend hoher Verdacht auf eine Infektion mit SARS-CoV-2, wird empfohlen, die Diagnostik zu wiederholen. Erste Erfahrungen mit COVID-19 aus China zeigten, dass gerade zu Beginn der Infektion nur etwa 70 % der Patienten positiv in der RT-PCR-Testung waren, während es insgesamt 94 % nach der zweiten Testung waren.[215] Für einen indirekten Nachweis (Antikörpernachweis)[101] soll das Blutserum betroffener Personen aufbewahrt werden.[205][212] (Stand: 13. April 2020) RT-PCR-TestDie Nachweismethode ist die real-time quantitative Reverse-Transkriptase-Polymerase-Kettenreaktion, abgekürzt auch als qRT-PCR, RT-qPCR oder nur als PCR-Test bezeichnet. Sie basiert auf der Detektion von zwei Nukleotidsequenzen, bezeichnet als E Gen und RdRp Gen. Ein positiver PCR-Test ist nicht gleichbedeutend mit Infektiosität: Der PCR-Test ist bei der empfohlenen Abstrich-Technik stets, in einigen Fällen mehrere Wochen, länger positiv als vermehrungsfähige Viren nachweisbar sind.[216][217][218] Ein unter anderem in diesem Fall hoher Ct-Wert (> 30) deutet auf eine geringe Viruslast und somit geringe Ansteckungsfähigkeit hin, die ein Argument für die Entlassung aus einer Quarantäne sein kann.[219] Beachtet werden muss jedoch auch, dass zu Beginn der Infektion die Viruslast ebenfalls gering und der Ct-Wert hoch ist, sodass der Patient in wenigen Tagen hochansteckend werden kann.[220] 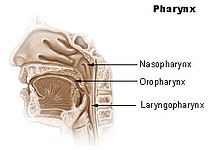 Die Wahrscheinlichkeit, mit Hilfe des RT-PCR-Tests einen Kranken auch korrekt als infiziert zu erkennen, hängt maßgeblich von der Entnahmeart des Materials ab (zum Unterschied zwischen „infiziert“ und „Infektion“ siehe dort). Der wegen seiner einfachen Durchführbarkeit meist praktizierte nasale Abstrich zeigte in einer kleinen chinesischen Studie bei 205 Patienten eine Sensitivität von 63 %. Der Nachweis aus der bronchoalveolären Spülflüssigkeit (bronchoalveoläre Lavage, BAL) erkannte das Virus in 93 % der Krankheitsfälle. Ebenso konnte bei wenigen Patienten auch ein Nachweis im Blut als Zeichen einer systemischen Infektion, einer Infektion bei der sich die Krankheitserreger durch Einschwemmung per Blutbahn über ein gesamtes Organsystem oder den ganzen Organismus ausbreiten, erbracht werden.[221] Eine chinesische Studie an 1014 Patienten mit Lungenerkrankung während des Ausbruchs der Epidemie in Wuhan zeigte, dass positive (mit COVID-19 vereinbare) Computertomogramme (CTs) bei rund 88 % der Patienten nachgewiesen wurden und lediglich 59 % mittels PCR-Test. Bei den 413 mit RT-PCR negativ getesteten Personen wiesen sodann 75 % positive CT-Ergebnisse auf. Studienergebnis war, dass CTs als primäres Werkzeug zum sicheren Nachweis von COVID-19 taugen und eine höhere Diagnose-Sensitivität dafür aufweisen als ein RT-PCR-Test.[222] Es ist daher wichtig, bei Proben der oberen Atemwege einen Abstrich des Nasenrachens (Nasopharynx) oder des Mundrachens Oropharynx (siehe Abbildung) zu nehmen. Nach Möglichkeit sollte dies durch eine Probe der unteren Atemwege (bronchoalveoläre Lavage, Sputum, Trachealsekret) ergänzt werden.[212][223] Der mit Rachenabstrichen vorgenommene PCR-Test ist nur in der ersten Woche zuverlässig. Anschließend kann das Virus im Rachen verschwinden, während es sich in der Lunge weiter vermehrt (entgegen der landläufigen Meinung „wandert“ das Virus nicht in die Lunge, sondern wird mit jedem Atemzug mit den inhalierten erregerbehafteten Tröpfchen in den gesamten Atemtrakt befördert, wo selbige an jeder Schleimhaut haften bleiben können, das Virus oder Bruchstücke davon sind bloß im Rachen nicht mehr nachweisbar, weil der lymphatische Rachenring als Teil des lymphatischen Systems seiner Aufgabe als Abwehrbarriere der oberen Atemwege nachgekommen ist). Bei Infizierten, die in der zweiten Krankheitswoche getestet werden, ist der PCR-Test anhand des Rachenabstrichs nicht zuverlässig positiv respektive auf den Gesamtstatus bezogen nicht zuverlässig negativ. Hilfsweise kann dann Probenmaterial per Absaugkatheter aus den tiefen Atemwegen entnommen oder ausgehustetes Material (Sputum) herangezogen werden.[224] Neben Fehlern bei der Probenahme können falsch-negative Ergebnisse durch eine zu geringe Viruslast im Probenmaterial, das Testkit oder bei dessen Verwendung auftreten.[215] Die Sensitivität der Abstrichuntersuchung ist dabei abhängig vom Zeitpunkt nach der Exposition mit dem Erreger. Am Tag des Symptombeginns testen rund 40 % der Patienten. Am achten Tag nach Exposition zeigte sich die beste Sensitivität mit rund 80 %.[225] Antikörpertest Das Virus kann auch durch eine Genomanalyse (RNA-Sequenzierung des Genoms) identifiziert werden.[212] Die NAAT-Methode (Nucleic Acid Amplification Technology) beruht ebenfalls auf der RT-PCR; das fertig zusammengestellte Assay ist jedoch einfacher in der Handhabung und lässt sich von entsprechend ausgestatteten Routine-Laboratorien verwenden.[212] Seit Februar 2020 gibt es ein derartiges Assay (Testkit) mit der Bezeichnung Centers for Disease Control and Prevention (CDC) 2019-Novel Coronavirus (2019-nCoV) Real-Time Reverse Transcriptase (RT)-PCR Diagnostic Panel.[226] Der Antikörpernachweis als serologische Untersuchung wurde nach Angabe der WHO seit Mitte Januar 2020 entwickelt. In einer bisher nur als Preprint im April 2020 veröffentlichten Studie wurden drei kommerzielle ELISA-Tests und sechs kommerzielle Lateral-Flow-Tests evaluiert. Für die drei ELISA-Tests wurde die diagnostische Sensitivität (Richtig-positiv-Rate) zwischen 67 % und 93 % ermittelt, die Spezifität (Richtig-negativ-Rate) lag zwischen 93 % und 100 %. Falsch positive Ergebnisse gab es durch Kreuzreaktivität mit Serumproben, die Antikörper gegen andere Coronaviren (z. B. Humanes Coronavirus HKU1) sowie weitere Viren enthielten.[227] Weitere Details sind im Abschnitt Antikörpernachweis im Artikel zum Virus beschrieben. Antigen-Schnelltests Seit Herbst 2020 sind Antigen-Schnelltests verfügbar, die auf Proteine des SARS-CoV-2 reagieren. Sie werden in der Regel wie PCR-Tests aus in Nasen-Rachen-Abstrichen gewonnenem Material durchgeführt. Die Sensitivität dieser Tests ist geringer als die von PCR-Tests, die als Referenzmethode gelten.[228] Ihr Vorteil liegt in der geringeren Zeit des Testablaufs von 15 bis 30 Minuten, zudem können einige der Tests vor Ort durchgeführt werden.[229] Eine im November vorveröffentlichte Studie verglich sieben Antigen-Tests mit PCR-Tests und beschrieb, dass die Sensitivität der Tests sich mit Viruskonzentrationen deckte, wie sie typischerweise in der ersten Woche mit Symptomen beobachtet würde, die bei den meisten Patienten der Zeit der Infektiosität entspräche.[229] Laut Robert Koch-Institut bedarf ein positives Testergebnis zur Vermeidung falsch-positiver Befunde einer Nachtestung mittels PCR.[228] Ein negatives Ergebnis im Antigentest schließt eine Infektion nicht aus, insbesondere, wenn eine niedrige Viruslast vorliegt, wie z. B. in der frühen Inkubationsphase oder ab der zweiten Woche nach Symptombeginn bzw. in der späten Phase der Infektion.[228] Als Alternative werden die gegenüber Antigen-Schnelltests erheblich sensitiveren und bei der Probenentnahme zudem mit einem geringeren Expositionsrisiko verbundenen PCR-Pooltests diskutiert. Hierbei werden die Probentupfer 30 Sekunden gelutscht (ugs.: Lolli-Test). Anschließend werden die Tupfer z. B. aller Schüler einer Schulklasse in einem einzigen Probenbehälter zusammengeführt (Pool) und dann kollektiv einem PCR-Test unterzogen (PCR-Pooltest). Im Falle eines positiven Ergebnisses werden dann alle Schüler der betroffenen Klassen einzeln mittels PCR getestet, um so die infizierten Schüler zu ermitteln.[230] Bildgebende Verfahren  Ob ein Mensch mit dem Virus infiziert ist, lässt sich durch die Bildgebung nicht feststellen. Jedoch lassen sich bei Patienten, deren Krankheit so schwer ist, dass sie eine Lungenentzündung hervorruft, diese bildgebend nachweisen. In der Bildgebung zeigen sich im CT milchglasartige Verdickungen, wie sie auch bei anderen viralen Lungenentzündungen vorkommen.[231][232] Diese Veränderungen lassen sich aufgrund ihrer oft pleuranahen Lage auch sonographisch darstellen.[233] Einige Wissenschaftler vertreten die Ansicht, die Diagnostik COVID-19-typischer Lungenschäden mittels Bildgebung sei der Diagnostik per RT-PCR überlegen, da die CT-Bildgebung schneller erfolgen kann und die Veränderungen zuverlässiger entdeckt werden als durch den fehleranfälligeren Abstrichtest.[215] Radiologen aus Changsha berichteten aus einer Fallserie von 167 Patienten über fünf Patienten, bei denen zum Zeitpunkt einer durch Computertomographie gesicherten Lungenentzündung die RT-PCR für das Virus negativ ausfiel und der Virusnachweis erst nach mehrmaligen Tests im Verlauf der Erkrankung gelang.[234] In Zeiten einer Epidemie kann es als Triage-Strategie bei einem gehäuften Auftreten der Patienten sinnvoll sein, Verdachtsfälle mit typischer Bildgebung auch bei negativer RT-PCR wie COVID-19-Fälle zu behandeln, um die Einleitung einer Therapie nicht zu verzögern.[232] Behandlungsmöglichkeiten Eine echte kausale Therapie für COVID-19 gibt es, wie bei den meisten viralen Infektionen, bis heute nicht. Die meisten Behandlungsmethoden beschränken sich daher auf die Linderung von Symptomen (etwa durch Schmerzmittel und Entzündungshemmer wie Dexamethason), die Zufuhr zusätzlichen Sauerstoffs (non-invasive BIPAP-Beatmung), sowie die Unterstützung der Immunabwehr. Allerdings sind mittlerweile auch einige experimentelle virostatische / antivirale Medikamente sowie Antikörperpräparate zugelassen, die bei rechtzeitiger Gabe einen milderen Verlauf befördern können. Zudem werden Lungen- und Herz-Kreislauf-Medikamente sowie dämpfende Immunmodulatoren zum Schutz der Organe eingesetzt.[235] Im Falle eines schweren Verlaufs mit akutem Lungenversagen erfolgt eine intensivmedizinische, maschinelle Beatmung im künstlichen Koma nach Intubation (ggfs. in Bauchlagerung). Hierbei gelten die üblichen Prinzipien der Beatmungstherapie bei Viruspneumonie. Es wird eine konservative Volumentherapie empfohlen, um eine Überwässerung des Patienten und die Gefahr eines zusätzlichen Lungenödems zu vermeiden. Im Rahmen des erweiterten hämodynamischen Monitorings sollte der Blutfluss kontinuierlich überwacht sowie nach Möglichkeit das extravaskuläre Lungenwasser bestimmt werden. Eine non-invasive Beatmung über hochvolumigen Sauerstoff birgt die Gefahr einer Aerosolierung des Virus und damit eine erhöhte Ansteckungsgefahr für das am Patienten arbeitende Personal.[236] Die European Respiratory Society (ERS) empfiehlt die Verabreichung systemischer Corticosteroide bei Patienten, die eine zusätzliche Sauerstoff- oder Beatmungsunterstützung erfordern. Aufgrund des erhöhten Thrombose- und Lungenembolierisikos bei COVID-Patienten[237] wird zudem eine Antikoagulation (Blutgerinnungshemmung) mittels niedermolekularem oder unfraktioniertem Heparin bei allen krankenhauspflichtigen COVID-Patienten über den gesamten Krankheitsverlauf empfohlen. Diese sollte möglichst frühzeitig nach Aufnahme eingeleitet werden. Eine Blutgerinnungshemmung in voller therapeutischer Dosis wird bei allen stationär behandelten Patienten mit Risikofaktoren für ein thrombotisches Ereignis empfohlen. Bei einer Verschlechterung zur Intensivpflichtigkeit soll diese nach Ausschluss einer Thrombose jedoch wieder auf eine prophylaktische Dosis zurückgefahren werden. Eine Empfehlung zur routinemäßigen Antikoagulation ambulant behandelter Patienten besteht nicht.[238] Am 5. Oktober 2021 erschien eine S3-Leitlinie der AWMF mit Empfehlungen zur stationären Therapie von Patienten mit COVID-19,[239] die am 1. März 2022 aktualisiert wurde, u. a. um Empfehlungen zur ambulanten Therapie in der Frühphase.[240][241] Auf der Website der EMA findet sich eine ständig aktualisierte Übersicht über den Zulassungsstand der derzeit untersuchten Arzneimittel.[242] Übersicht über (experimentelle) Medikamente
Bedingt empfohlen wird von der ERS eine monoklonale Antikörperbehandlung mit Interleukin-6-Rezeptor-Antagonisten und die Assistierte Spontanatmung oder CPAP-Beatmung bei Patienten mit Hypoxämie. Unter Vorbehalt spricht sie sich gegen die Verwendung von Azithromycin, Colchicin und Remdesivir aus, insbesondere bei Patienten, die intubiert beatmet werden müssen. Nicht empfohlen wird Remdesivir bei Patienten, die eine ergänzende Sauerstoffgabe benötigen.[287] Antikörperreiches Plasma genesener Patienten scheint geeignet, Akutfälle zu therapieren, kann aber einen Erfolg nur in der Frühphase der Erkrankung belegen.[288] Bisher gibt es keine Zulassung für den Einsatz von Rekonvaleszentenplasma. Es gibt jedoch Hinweise auf einen möglichen günstigen klinischen Effekt und eine geringere Sterblichkeit bei Patienten mit schwerer Erkrankung. Ebenso wird eine frühere Viruselimination erreicht. Das RKI empfiehlt den Einsatz von Rekonvaleszentenplasma im Rahmen von kontrollierten klinischen Studien oder individuellen Heilversuchen in Rücksprache mit einem erfahrenen Zentrum.[238] Nach Leitlinie der DIVI soll Rekonvaleszentenplasma bei Krankenhauspatienten nicht eingesetzt werden. Ob einige Patientengruppen davon profitieren könnten, sei aufgrund der Datenlage unklar.[289] Die frühzeitige inhalatorische Gabe puderförmigem Budesonid in hoher Dosierung konnte in einer Studie eine Verkürzung der Erkrankungsdauer und eine Senkung der Wahrscheinlichkeit einer Krankenhausaufnahme belegen. Dies konnte jedoch bisher nicht reproduziert werden. Aufgrund der Datenlage rät die Fachgruppe COVRIIN beim RKI vom Einsatz des Medikaments bei COVID-19 ab.[250] Die Leitlinie der US-amerikanischen NIH bewertet die Datenlage als nicht ausreichend um eine Empfehlung für oder gegen den Einsatz des Medikaments zu geben.[290] Verschiedene Studien erforschten, ob Vitamin D zur Behandlung einer akuten COVID-19-Erkrankung geeignet ist. Nach Einschätzung von Gesundheitsbehörden z. B. in USA, England und Deutschland sowie eines Cochrane-Metaanalyse gab es hierfür Anfang 2021 keine ausreichende Evidenz.[291][292][250][293] Auch eine Metastudie über 11 Kohortenstudien und zwei klinische Studien fand Ende 2021 keinen Zusammenhang.[294] 331 Therapeutika sind derzeit noch in der Erprobung (Stand: 20. Juni 2021)[295], wie beispielsweise EXO-CD24, Sotrovimab oder Molnupiravir. Zudem werden mehr als 634 verschiedene Medikamente darauf erprobt, ob sie auf die eine oder andere Weise hilfreich gegen Covid-19 sein können.[235][296] HeilungsaussichtInfizierten-Verstorbenen-Anteil je Lebensalter (blaue Kurve) – Metastudie Ende 2020 Hier fehlt eine Grafik, die leider im Moment aus technischen Gründen nicht angezeigt werden kann. Wir arbeiten daran!
Abschätzung des SterberisikosEs gibt drei verschiedene Kennzahlen, um das Sterberisiko der Erkrankung zu beschreiben:

Risiko Krankenhaus-Einweisung ggü. 40–44-Jährigen (dunkelblau), Hier fehlt eine Grafik, die leider im Moment aus technischen Gründen nicht angezeigt werden kann. Wir arbeiten daran!
Abschätzung des Risikos der KrankenhauseinweisungVor allem mit höherem Alter nimmt das Risiko einer Krankenhaus-Einweisung durch COVID-19 zu, gegenüber 40–44-Jährigen auf das Fünffache (s. Abb.). Neben dem Alter erhöhen vorhandene Vorerkrankungen wie Down-Syndrom, geistige Behinderung, Nierentransplantation, Lungentransplantation, Nierenversagen mit Dialyse und Lungenkrebs das Risiko auf das Drei− bis Siebenfache, so eine Studie vom September 2021 auf Basis der 66 Millionen Einwohner Frankreichs.[305] Forschungsstand zu SpätfolgenAus den radiologischen Befunden eines Fallberichts haben taiwanische Ärzte geschlossen, dass wie bei SARS Spätfolgen an der Lunge im Sinne von fibrotischen Veränderungen möglich sind.[29][30] Aufgrund eines Falles von durch SARS-CoV-2 ausgelöster viraler Encephalitis und der Erfahrungen mit anderen Coronaviren stellen Forscher aus Peking die Möglichkeit einer Langzeitpersistenz des Virus in Nervenzellen in den Raum, welche zu neurologischen Folgeerkrankungen führen könnte.[31] Ein Review über COVID-19 und die Beteiligung am Herzen von US-amerikanischen Ärzten zieht die Möglichkeit von herzbedingten Spätfolgen in Betracht und beruft sich dabei auf die Erfahrungen mit SARS sowie einen italienischen Fallbericht einer tödlich verlaufenden Herzmuskelentzündung nach Ausheilung der Erkrankung.[28] In einer Studie an 100 Patienten zeigte eine Mehrheit der Patienten in der Magnetresonanztomografie auch nach symptomatischer Ausheilung von COVID-19 eine messbare Entzündung des Herzmuskels. Wegen der kleinen Untersuchungsgruppe und der Art der Auswahl der Untersuchten ist aber unklar, inwieweit diese Patienten für die Gesamtzahl der Erkrankungen repräsentativ sind.[306] Eine Studie an 384 aus dem Krankenhaus Entlassenen stellte rund zwei Monate nach der Entlassung eine hohe Rate von Patienten fest, die weiterhin Beschwerden hatten. Mehr als die Hälfte klagte über Müdigkeit, rund die Hälfte über Atemnot und etwa ein Drittel über anhaltenden Husten. Bei rund einem Drittel fand man bei einer Blutuntersuchung erhöhte D-Dimer-Werte, eine Folge von Blutgerinnung und darauf folgender Fibrinolyse (Gerinnselauflösung). Bei 38 % zeigten sich abnorme Röntgenbefunde, bei 9 % waren diese schlechter als zum Entlasszeitpunkt.[307] Wie bei anderen Infektionskrankheiten mit Lungenentzündung kann die Genesung lange dauern. Nach einer akuten Erkrankung können Wochen oder Monate später noch Beschwerden vorhanden sein oder neu auftreten. Neben organspezifischen Langzeitfolgen, die aus der Behandlung einer schweren Erkrankung resultieren, werden längerfristige Müdigkeitserscheinungen, Gedächtnis- und Wortfindungsstörungen, Schwindel und Übelkeit auch bei milderen Verläufen beobachtet. Daten aus England deuten darauf hin, dass rund 40 % der Krankenhauspatienten längerfristig medizinische Hilfe benötigen und rund 10 % der nicht im Krankenhaus Behandelten mehr als vier Wochen Beschwerden haben.[308] Nach einer Studie von Forschern des University College London hielten die Symptome bei etwa 2 % der an Covid-19 Erkrankten länger als 12 Wochen an.[309] ImmunitätEine durchgemachte Infektion mit SARS-CoV-2 induziert eine Immunantwort gegen das Virus. Antikörper verschiedener Klassen sind im Mittel rund zwei Wochen nach Beschwerdebeginn feststellbar. Diese umfassen Antikörper gegen das Spike-Protein und auch das Nukleokapsid des Virus.[310] Rund ein Zehntel der Infizierten bildet keine messbaren Antikörper. Die Höhe der Antikörperspiegel korreliert mit der Krankheitsschwere.[311] Ebenso lassen sich auch gegen das Spike-Protein reaktive T-Zellen und B-Zellen nachweisen. Rund sechs bis acht Monate nach der Erkrankung lassen sich diese Parameter weiterhin nachweisen, wobei die Menge der Antikörper rasch absinkt. Es ist weiterhin unklar, inwieweit diese Parameter einen Schutz gegen eine Infektion oder schwere Erkrankung verleihen. Antikörper, die das Virus im Laborversuch neutralisieren, werden mit einem Schutz gegen eine schwere Erkrankung in Verbindung gebracht. Ein Schwellenwert, ab dem sie vor einer schweren Erkrankung oder Infektion schützen, ist bisher nicht gesichert.[310] Wiederansteckungen nach durchgemachter Infektion sind möglich. Dies ist abzugrenzen von Personen, bei denen sich nach durchgemachter Erkrankung noch länger Erbmaterial des Virus nachweisen lässt. Das CDC trifft die Aussage, dass die Dauer der Immunität noch unklar sei, empfiehlt aber drei Monate nach gesicherter Infektion keine erneute Testung auf das Erbmaterial des Virus.[312] Das ECDC ordnet die Datenlage dergestalt ein, dass ein vor Infektion schützender Effekt der durchgemachten Infektion von 81–100 % über einen Zeitraum von fünf bis sieben Monaten nachgewiesen ist.[311] Auf Basis der Daten aus dem deutschen Meldesystem berichtet das RKI, dass gemeldete Wiederansteckungen seltene Ereignisse sind. Aufgrund der Erfahrungen mit anderen Coronaviren sei es jedoch denkbar, dass nicht-diagnostizierte Wiederansteckungen nicht ungewöhnlich sein könnten.[310] Eine frühe Bildung von virusreaktiven T-Zellen scheint mit einem leichten Krankheitsverlauf zu korrelieren. Dagegen wurden Störungen der B-Zell-Reifung bei schweren Verläufen beobachtet.[310] Im Laborversuch konnten Kreuzreaktivitäten zwischen anderen beim Menschen vorkommenden Coronaviren sowohl auf Ebene der Antikörper als auch der zellulären Immunantwort nachgewiesen werden. Die Studienlage, inwieweit dies die Ansteckungswahrscheinlichkeit oder den Krankheitsverlauf beeinflusst, ist widersprüchlich.[310] VorbeugungIndividuelle Hygienemaßnahmen  Empfehlungen des deutschen Robert Koch-Instituts (RKI)Das Robert Koch-Institut (RKI) veröffentlichte am 28. Januar 2020 Empfehlungen, wie jeder Einzelne sich und andere vor einer Ansteckung mit SARS-CoV-2 schützen kann:
Angesichts einer sich anbahnenden 3. Welle in Deutschland gab das RKI am 31. März 2021 aktualisierte Empfehlungen für den Alltag heraus. In Form von acht „Tipps“ wurde betont[316]:
Zusätzliche Empfehlungen der Weltgesundheitsorganisation (WHO)Die Weltgesundheitsorganisation (WHO) empfiehlt zusätzlich:[317]
Hinweise des deutschen Bundesministeriums für Gesundheit (BMG)Bei Symptomen oder Beschwerden, die auf eine Infektion mit dem Coronavirus hinweisen könnten, sollte zunächst der Hausarzt angerufen werden; außerhalb der Öffnungszeiten der Hausarztpraxis kann in Deutschland der ärztliche Bereitschaftsdienst angerufen werden: »Rufnummer: 116 117«. Außerdem sollte man sich zuhause isolieren, um nicht weitere Menschen anzustecken.[319][320][321] Bei akuten Notfällen soll der Notruf: »Rufnummer: 112« angerufen werden. Das deutsche Bundesministerium für Gesundheit (BMG) warnt, dass niemand aus Angst vor einer Infektion mit SARS-CoV-2 („Coronavirus“) bei schwerwiegenden Krankheitssymptomen auf ärztliche Behandlung verzichten soll: „In den letzten Wochen haben wir beobachtet, dass sich deutlich weniger Patientinnen und Patienten z. B. mit einem akuten Herzinfarkt vorstellen. Dabei zählt gerade beim Infarkt jede Minute. Die Wahrscheinlichkeit, an einem Herzinfarkt zu sterben ist hoch, wenn man sich nicht rechtzeitig meldet. Die Wahrscheinlichkeit, sich [beim Arzt oder im Krankenhaus] mit dem Coronavirus zu infizieren, ist gering.“[322] Empfehlungen der deutschen Bundeszentrale für gesundheitliche Aufklärung (BZgA)Die Bundeszentrale für gesundheitliche Aufklärung empfiehlt, sich beim Husten, Niesen oder Naseputzen sofort von anderen Menschen abzuwenden und möglichst in ein Taschentuch zu niesen/husten, das danach sofort entsorgt werden muss, sowie sich anschließend gründlich die Hände zu waschen.[323] Corona-Apps zur KontaktverfolgungIm Verlauf des Jahres 2020 wurden mehrere Corona-Apps zur Kontaktverfolgung entwickelt, um Infektionsketten nachzuvollziehen. In Deutschland sind dies die Corona-Warn-App und die Luca-App, deren Gebrauch vom RKI dringend empfohlen wird. Empfehlungen von VirologenDer Virologe Christian Drosten hat empfohlen, insbesondere in den Tagen vor einem Familientreffen mit älteren Menschen soziale Kontakte weitgehend zu verringern, indem man zum Beispiel Besprechungen vermeidet oder im Home-Office arbeitet („Vorquarantäne“).[324] WHO-Studie, Juni 2020Mit einer Studie, die durch die WHO in Auftrag gegeben wurde, wurde systematisch der optimale Einsatz der genannten Schutzmaßnahmen untersucht. Ein internationales Forscherteam hat erstmals untersucht, wie sich körperliche Distanz, Gesichtsmasken und Augenschutz auf die Verbreitung von COVID-19 auswirken. Die Recherche ergab 172 Beobachtungsstudien in 16 Ländern und sechs Kontinenten ohne randomisierte kontrollierte Studien und 44 relevante Vergleichsstudien im Gesundheitswesen und außerhalb des Gesundheitswesens (n = 25.697 Patienten). Die Übertragung von Viren war bei einer physischen Entfernung von 1 m oder mehr geringer als bei einer Entfernung von weniger als 1 m. Der Schutz erhöhte sich, wenn die Entfernung vergrößert wurde. Die Verwendung von Gesichtsmasken kann zu einer starken Verringerung des Infektionsrisikos führen mit stärkeren Assoziationen zu N95 oder ähnlichen Atemschutzmasken (FFP2) im Vergleich zu chirurgischen Einwegmasken oder ähnlichen, beispielsweise wiederverwendbaren Masken. Die Ergebnisse dieser systematischen Überprüfung und Metaanalyse unterstützen eine physische Distanzierung von 1 m oder mehr und liefern quantitative Schätzungen für Modelle und Kontaktverfolgungen, um die politischen Entscheider zu informieren. So betrug das Infektionsrisiko bei Personen, die mehr als einen Meter von der infizierten Person entfernt stehen, 3 Prozent gegenüber 13 Prozent bei einer Entfernung von einem Meter. Mit jedem weiteren Meter Distanz (bis 3 Meter Abstand) wurde das Risiko noch einmal halbiert. Eine körperliche Distanz von mehr als 1 Meter sowohl im Gesundheitswesen als auch in der Gesellschaft reduziert das Ansteckungsrisiko um 82 Prozent. Mit Augenschutz betrug das Infektions- oder Übertragungsrisiko 6 Prozent gegenüber 16 Prozent ohne Augenschutz. Für den Augenschutz ermittelten die Forscher insgesamt eine Schutzwirkung von 78 Prozent. Ein Mund-Nasen-Schutz senkt das Infektionsrisiko laut der Studie um 85 Prozent. Teilchen filtrierende Masken wie N95 (etwa „gauze masks“ oder wiederverwendbare Masken mit 12 bis 16 Lagen Baumwollstoff) könnten Beschäftigten in Gesundheitseinrichtungen möglicherweise einen besseren Schutz bieten als OP-Masken. Baumwollstoffmasken seien dabei auch für die Bevölkerung geeignet. Diese erreichten in einer Unteranalyse eine Schutzwirkung von 96 Prozent. Keine dieser Interventionen biete jedoch, selbst wenn sie richtig eingesetzt und kombiniert werden, einen vollständigen Schutz vor einer Infektion.[325] Flächenreinigung und Desinfektion Da die in Seife und Reinigungsmittel üblicherweise enthaltenen Tenside die Fetthülle von Coronaviren zerstören, reichen diese Tenside im Alltag aus, um Hände und andere Oberflächen weitgehend von Krankheitserregern zu befreien.[326][327] Eine routinemäßige Flächendesinfektion in häuslichen und öffentlichen Bereichen wird vom RKI nicht empfohlen; eine im Einzelfall nötige Desinfektion sollte als Wisch- und nicht als Sprühdesinfektion durchgeführt werden, da letztere weniger effektiv sei und das Desinfektionsmittel eingeatmet werden könne. Alkoholbasierte Produkte sollten aus Brandschutzgründen nur auf kleinen Flächen angewendet werden.[326] Schutzmaske als Mittel zur Prävention
Eine experimentelle Studie von 2008 kommt zu dem Schluss, dass jede Art von Alltagsmaske selbst bei ungenügendem Sitz oder bei improvisiertem Material eine Virusexposition möglicherweise vermindert. Die Autoren schließen daraus, dass das generelle Tragen von Masken durch die Bevölkerung die Übertragung von Atemwegserkrankungen vermindern könne.[328] In Ostasien gilt die Verwendung von Masken für die Allgemeinbevölkerung als zentrales Element der Prävention. Im März 2020 empfahlen Mediziner aus Hong Kong anderen Ländern, diese Praxis ebenso einzuführen.[329] Die US-amerikanische CDC empfahl unter Berufung auf die aktuelle Studienlage[330] allen Bürgern, in der Öffentlichkeit Mund und Nase zu bedecken.[331][332] Eine Übersicht über den Umgang mit und die Einschätzung von Gesichtsmasken in verschiedenen Ländern hat die Zeitschrift The Lancet erstellt.[333] Obwohl die Wirksamkeit einer Mund-Nasen-Bedeckung als allgemeine Hygienemaßnahme kaum angezweifelt wird, ist die wissenschaftliche Datenlage mit randomisierten Vergleichsuntersuchungen, die dies statistisch zweifelsfrei für SARS-CoV-2 nachweisen, bisher eher dürftig.[95][334][335] Eine im April 2020 vorläufig veröffentlichte Metaanalyse einer internationalen Forschergruppe kam zu dem Schluss, dass das Tragen von Mund-Nasen-Masken die Übertragung von Atemwegserkrankungen und die Ausbreitung von Atemwegsinfektionen durch Gesundheitspersonal, aber auch unter der Bevölkerung erheblich reduzieren könne. Die Studienautoren sprachen sich explizit für den Schutz durch Masken aus, um die Übertragung von Atemwegsviren und damit die Ausbreitung von Atemwegserkrankungen zu verhindern oder zumindest zu behindern.[336] Für die optimale Wirksamkeit ist es wichtig, dass die Mund-Nasen-Bedeckung korrekt sitzt, d. h. enganliegend getragen wird, bei Durchfeuchtung gewechselt wird und dass während des Tragens keine (unbewussten) Manipulationen daran vorgenommen werden.[337] Nach Angaben der WHO kann allerdings das Tragen einer Maske in Situationen, in denen dies nicht empfohlen ist, ein falsches Sicherheitsgefühl erzeugen, durch das zentrale Hygienemaßnahmen wie eine gute Händehygiene vernachlässigt werden können.[338] Zu unterscheiden ist zwischen dem Schutz des Trägers (Eigenschutz) und dem Schutz der Umgebung (Fremdschutz). Masken mit Ausatemventil schützen den Träger, nicht aber die Umgebung. (Zu diesem Unterschied je nach Maskentyp siehe die Tabelle hier und die Grafik hier.) Das Bundesinstitut für Arzneimittel und Medizinprodukte weist darauf hin, dass Alltagsmasken (im Gegensatz zu medizinischem Mund-Nasen-Schutz und Atemschutzmasken) nicht normiert sind und daher eine ausreichende Schutzwirkung gegen eine Übertragung von SARS-CoV-2 nicht garantiert werden kann. Dementsprechend könnten sich Träger nicht darauf verlassen, dass sie oder andere durch das Tragen solcher Masken vor einer Übertragung des Erregers geschützt seien, und müssen weiter die Abstandsregeln beachten.[339] Die Gesellschaft für Virologie hat gemeinsam mit der Deutschen Gesellschaft für Hygiene und Mikrobiologie im November 2020 zusammenfassende Handlungsempfehlungen als S1-Leitlinie zum Thema der Infektionsprävention durch das Tragen von Masken im Zusammenhang mit COVID-19 herausgegeben.[340] Viruzides Gurgeln und viruzider NasensprayDie Deutsche Gesellschaft für Krankenhaushygiene empfiehlt als virenabtötende Maßnahmen viruzides Gurgeln und den präventiven Einsatz von viruziden Nasenspray, um die Viruslast bereits an den „Eintrittspforten“ zum Organismus zu reduzieren, da die Wahrscheinlichkeit einer COVID-19-Erkrankung mit dem Ausgesetztsein gegenüber dem Coronavirus SARS-CoV-2 (Exposition gegenüber SARS-CoV-2) zunimmt, wenn sich Menschen innerhalb potentieller Risikogebiete („Corona-Hotspots“) aufhalten, da die anfängliche Viruslast Einfluss auf den Schweregrad der Erkrankung hat. Allerdings lässt sich der Einfluss auf Erkrankungshäufigkeit und Krankheitsverlaufs noch nicht anhand von Studien belegen.[341] Infrastrukturelle Minimierung der Tröpfchen- und Aerosolübertragung („source control“)Besonders in geschlossenen Räumen kann eine Übertragung und Verbreitung virusbehafteter Aerosole durch Aerosol- und Tröpfcheninfektion vermutet werden. Außerdem können durch Klimatisierung bedingte Luftströme zur Verbreitung von Krankheitserregern beitragen.[342] Durch eine raumbezogene Analyse des Tröpfchen- und Aerosoltransports können geeignete infrastrukturelle Maßnahmen geplant und umgesetzt werden, um die Exposition nichtinfizierter Menschen in Innenräumen zu minimieren.[343] AbfallentsorgungWenngleich bisher keine Fälle bekannt sind, bei denen sich Menschen durch die Berührung von kontaminierten Oberflächen mit dem SARS-CoV-2-Virus angesteckt haben, kann dieser Infektionsweg nicht ausgeschlossen werden. Um Hausmeister, Bewohner von Mehrfamilienhäusern und Mitarbeiter der Abfallentsorgung zu schützen, benennt das Bundesumweltministerium deshalb Vorsichtsmaßnahmen: Bei Haushalten mit infizierten Personen oder begründeten Verdachtsfällen entfällt die Pflicht zur Abfalltrennung. Neben Restmüll müssen diese Haushalte auch Verpackungsabfälle, Altpapier und Biomüll über den zur Verbrennung bestimmten Restabfall entsorgen. Die Abfälle dürfen nicht lose in die Tonne eingeworfen werden, sondern sicher verpackt in stabilen, reißfesten Abfallsäcken. Erst nach Genesung und beendeter Quarantäne soll die getrennte Entsorgung von Glasabfällen, Pfandverpackungen, Elektro- und Elektronikabfällen, Batterien und Schadstoffen angegangen werden.[344] Die am 14. April 2020 von der EU-Kommission veröffentlichten Leitlinien zur Abfallentsorgung in der Coronavirus-Krise enthalten weitere Grundsätze im Falle einer Behandlung von Erkrankten in Privathaushalten: Taschentücher und Atemmasken sollten in einem eigenen Abfallbehälter im Zimmer des Patienten gesammelt werden, Handschuhe und Gesichtsmasken von Betreuern in einem zweiten Behälter in Türnähe. Die Abfallsäcke sind zu verschließen, bevor sie aus dem Patientenzimmer transportiert werden, können dann aber gemeinsam gesammelt und in den Restmüll gegeben werden.[345] Prophylaktische Steigerung des Vitamin-D-SpiegelsIn der Literatur wird ein Zusammenhang zwischen einem niedrigen Vitamin-D-Spiegel und der Schwere einer COVID-19-Erkrankung diskutiert.[346][347][348] Nach Einschätzung von Gesundheitsbehörden aus den USA[292], England[291] oder Deutschland[250] bestand Anfang 2021 keine Evidenz für eine Vitamin-D-Gabe zur Vorbeugung von COVID-19. Laut Bundesinstitut für Risikobewertung bestehe auf Basis der gegenwärtigen Studienlage kein Anlass, der gesunden Allgemeinbevölkerung die generelle Einnahme von Nahrungsergänzungsmitteln mit Vitamin D zu empfehlen, für Bewohner von Pflegeheimen allerdings könne eine generelle Vitamin-D-Einnahme von bis zu 20 µg (800 IE) pro Tag erwogen werden.[349] Eine Metastudie von Ende 2021 sieht ebenfalls keinen Effekt unterschiedlich hoher Vitamin-D-Spiegel auf das Ansteckungsrisiko oder den Krankheitsverlauf.[294] Medizinisches PersonalDas Robert Koch-Institut gab am 24. Januar 2020 erste Hinweise, welche Hygienemaßnahmen zur Vermeidung einer Übertragung des Erregers durch Tröpfchen auf medizinisches Personal notwendig sind: Als Empfehlung wurde die konsequente Einhaltung der Basishygiene, besonders der Händehygiene, genannt.[350] Mit Änderung der Falldefinitionen am 14. Februar 2020 wurden die Hygienemaßnahmen präzisiert und in der Folge an neue Erkenntnisse angepasst (Stand 8. April 2020): So wird aus Gründen des Patientenschutzes während der Pandemie für alle Bereiche des Gesundheitswesens „das generelle Tragen von Mund-Nasen-Schutz (MNS) durch sämtliches Personal mit direktem Kontakt“ zu besonders gefährdeten Personengruppen empfohlen. Bei der Behandlung und Pflege von Patienten mit möglicher oder bestätigter SARS-CoV-2-Infektion sollte persönliche Schutzausrüstung (PSA) in Form von Schutzkittel, Schutzhandschuhen, Schutzbrille und mindestens dicht anliegendem MNS oder einer Atemschutzmaske getragen werden. Dabei sollte bevorzugt eine Maske des Standards FFP2 verwendet werden, die Schutz vor Aerosolen und Tröpfchen bietet. Wenn FFP2-Masken nicht zur Verfügung stehen, soll als Schutz gegen Tröpfchen zumindest ein MNS getragen werden. Für alle Tätigkeiten, die mit Aerosolproduktion einhergehen (z. B. Intubation oder Bronchoskopie), werden FFP2-Masken oder darüber hinausgehender Atemschutz empfohlen. Diese Angaben gelten auch bei der stationären Versorgung.[350] Stehen keine CE-gekennzeichneten Masken zur Verfügung, können laut der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA) „bis auf Weiteres“ Masken verwendet werden, die mindestens dem NIOSH-Standard N95 entsprechen (Stand 6. April 2020).[351] Bei Symptomen einer Atemwegserkrankung muss der Patient einen Mund-Nasen-Schutz tragen und wird in der Arztpraxis zur Verdachtsabklärung nach Möglichkeit in einen separaten Raum geführt, wo die weiteren Untersuchungen stattfinden.[205] Zur chemischen Desinfektion der Hände und Flächen sind Desinfektionsmittel geeignet, die die Wirkungsbereiche „begrenzt viruzid“, „begrenzt viruzid PLUS“ oder „viruzid“ abdecken.[350][352] Eine Auswertung von 22 Studien, die sich mit der Persistenz und Inaktivierung von medizinisch relevanten Coronaviren (wie SARS-CoV und MERS-CoV) unter anderem in Gesundheitseinrichtungen beschäftigen, zeigt, dass für die Oberflächendesinfektion Mittel auf der Basis von Ethanol (mindestens 65 %), Wasserstoffperoxid oder Natriumhypochlorit in entsprechender Konzentration wirksam sind.[353] Neben den Hygienemaßnahmen durch das medizinische Personal zählen außerdem die Unterbringung des Patienten in einem Isolierzimmer mit Vorraum oder Schleuse[350] und das Abstellen eventuell vorhandener raumlufttechnischer Anlagen, über die ein Luftaustausch mit anderen Räumen möglich ist, zu den Präventionsmaßnahmen.[350] Zahnärztliche BehandlungBei einer zahnärztlichen Behandlung kommen meist Bohrinstrumente mit Wasserkühlung zum Einsatz. Dabei bildet sich Aerosol. Eine mögliche Übertragung durch diese Form von Aerosol ist noch nicht wissenschaftlich erwiesen, da in Zahnarztpraxen, anders als in Laborversuchen, umfassende Absaugungen zum Einsatz kommen. Bisherige Studien zur Virusmenge im Aerosol verwenden nicht den Speichel eines symptomlos infizierten Menschen als Testsubstrat (Real-Szenario), sondern hoch kontaminierte, künstliche Reagenzien, die einem 1-ml-Rachenabstrich eines Patienten mit schwerem Verlauf ähneln.[354] Informationen aus der Zahnklinik der Universität Wuhan widerlegen ein erhöhtes Übertragungsrisiko für zahnmedizinisches Personal bei Einhaltung der bisherigen Hygiene-Maßnahmen (Mund-Nasen-Schutz, Schutzbrille, Untersuchungs-Handschuhe).[355] Im März 2020 war die notwendige Schutzausrüstung bei der Behandlung von nachgewiesen mit COVID-19 infizierten Patienten (Atemschutzmaske FFP2, Schutzbrille mit Seitenschutz oder Visier, Untersuchungs-Handschuhe, langärmliger Schutzkittel, Kopfhaube) in vielen Zahnarztpraxen – auch wegen Lieferschwierigkeiten – nicht oder nur eingeschränkt vorhanden. Patienten sollten deshalb nur bei Notfällen und dringenden Behandlungen einen Zahnarzt aufsuchen.[356] Im Mai erklärte die Bundeszahnärztekammer, die Situation im Bereich Schutzausrüstung habe sich verbessert und die Hygienestandards seien auf die Pandemie-Situation angepasst worden. Also könnten alle zahnärztlichen Behandlungen wieder durchgeführt werden.[357] Umfangreiche aktuelle Informationen stellt die Bundeszahnärztekammer auf ihrer Webseite zur Verfügung.[358] Abfälle aus der medizinischen BehandlungDie RKI-Empfehlungen zur Abfallentsorgung im Rahmen der Behandlung und Pflege von Patienten mit einer Infektion durch SARS-CoV-2 basieren auf der Mitteilung 18 der Bund/Länder-Arbeitsgemeinschaft Abfall (LAGA). Sie werden regelmäßig an neue Erkenntnisse angepasst. Nach derzeitigem Wissen (Stand 24. April 2020) fallen bei der Behandlung von COVID-19-Patienten in der Regel keine gefährlichen Abfälle an. Wenn die üblichen Maßnahmen des Arbeitsschutzes eingehalten und geeignete persönliche Schutzausrüstungen getragen werden, stellen nicht flüssige Abfälle aus der Behandlung erkrankter Patienten kein besonderes Infektionsrisiko dar.[359] Atemschutzmasken, Verbände oder auch Aufwischtücher können so unter dem Abfallschlüssel 180104 geführt werden. Die Abfälle sind unmittelbar am Entstehungsort in reißfesten, feuchtigkeitsbeständigen und dichten Behältnissen zu sammeln und ohne Umfüllen oder Sortieren in sicher verschlossenen Behältern zu transportieren. Spitze und scharfe Gegenstände sollten in bruch- und durchstichsichere Einwegbehältnisse gegeben werden. Abfälle, die bei der mikrobiologischen und virologischen Diagnostik von COVID-19 entstehen und nicht durch ein anerkanntes Verfahren desinfiziert werden können, zählen hingegen regelhaft zu den infektiösen Abfällen des Abfallschlüssels 180103*. Für deren Sammlung und Entsorgung gelten aus infektionspräventiver Sicht besondere Anforderungen.[360] Gesellschaftliche Vorbeugung Wie alle Maßnahmen der Pandemiebekämpfung hat die gesellschaftliche Vorbeugung folgende Ziele:
Diese übergeordneten Ziele werden je nach epidemiologischer Phase durch unterschiedliche Strategien erreicht. Solange die meisten Fälle isoliert oder in lokalen Clustern austreten, liegt der Schwerpunkt auf Containment. Dazu müssen Erkrankte isoliert und Kontaktpersonen möglichst lückenlos identifiziert und in (häuslicher) Quarantäne untergebracht werden. Damit sollen Infektionsketten so schnell wie möglich unterbrochen werden.[361][363] Bei einer anhaltenden Mensch-zu-Mensch-Übertragung empfiehlt das Europäische Zentrum für die Prävention und die Kontrolle von Krankheiten zur Eindämmung von COVID-19 eine Reihe weiterer nicht-pharmazeutischer Maßnahmen:
Das ECDC schließt nach Auswertung wissenschaftlicher Studien, dass die nicht-pharmazeutischen Maßnahmen nachweislich eine kritische Rolle bei der Eindämmung der COVID-19-Pandemie in Europa gespielt haben. Sie bleiben demnach notwendig, solange kein Impfstoff zur Verfügung steht. Wegen der schweren negativen gesellschaftlichen Folgen der Maßnahmen sollten sie aber nur dort angewandt werden, wo die lokale epidemische Situation das nötig macht.[363] Drei systematische Übersichtsarbeiten im Rahmen der Cochrane Library zu Reisebeschränkungen, Massentestungen und Quarantäne von Kontaktpersonen stellen fest, dass keine dieser Maßnahmen allein einen großen nachweisbaren Effekt auf die Verbreitung von COVID-19 hat. Für die Wirksamkeit von Reisebeschränkungen gibt es immerhin Hinweise, für die Wirksamkeit von Quarantänen erkennbare Belege. Die Autoren schließen, dass die untersuchten Maßnahmen in Kombination mit anderen nicht-pharmazeutischen Maßnahmen eingesetzt werden sollten. Maßnahmen wie Gesichtsmasken und soziale Distanzierung bleiben demnach weiterhin wichtig zur Kontrolle der COVID-19-Pandemie.[364][365][366] Eine im Juni 2021 im Journal of Infection veröffentlichte Metastudie kam auf Basis von 34 Studien zum Gesamtergebnis,[367] vor allem eine frühzeitige Umsetzung von Maßnahmen sei entscheidend, nicht die Strenge. Am wirksamsten seien die Schließung von Schulen, Arbeitsplätzen, Geschäften und Veranstaltungsorten sowie das Verbot öffentlicher Veranstaltungen. Auch das Tragen von Masken und öffentliche Informationskampagnen seien wirksam, zudem haben letztere den Vorteil, weniger Eingriffe in das Leben der Menschen zu erfordern. Es gebe hingegen keine Belege für die Wirksamkeit der Schließung öffentlicher Verkehrsmittel, von Test- und Kontaktverfolgungsstrategien und Quarantäne-Maßnahmen. Zu vermeiden seien längere Versammlungen in Innenräumen bei schlechter Belüftung, dies könne zu Superspreadern führen – ein gemeinsames Merkmal von Coronaviren. Eine Aufhebung von Maßnahmen sollte vorsichtig erfolgen, an das Umfeld angepasst, zudem mit angepassten Eindämmungsmaßnahmen, schrittweiser Öffnung und jeweiliger Überwachung ihrer Auswirkungen auf die Bevölkerung.[367]
Management von Kontaktpersonen durch öffentliche Behörden Die Nachverfolgung von Kontaktpersonen erfolgt im Rahmen des Infektionsschutzes im Einklang mit der Einschätzung der Situation des Geschehens durch das lokal zuständige Gesundheitsamt. Das Robert Koch-Institut unterscheidet zwischen Kontaktpersonen mit höherem Infektionsrisiko (Kategorie I), Kontaktpersonen mit geringerem Infektionsrisiko (Kategorie II) und Kontaktpersonen der Kategorie III, dabei handelt es sich um medizinisches Personal mit einem geringen Expositionsrisiko. Ein höheres Infektionsrisiko gemäß Kategorie I kann durch engen Kontakt, Kontakt mit Sekreten des Infizierten oder einer Kontaktsituation mit hohem Übertragungsrisiko durch Aerosole entstehen.[368] In Deutschland wird Personen der Kategorie I unter Abwägung der Möglichkeiten und nach Risikobewertung des Gesundheitsamtes eine häusliche Absonderung mit regelmäßiger Gesundheitsüberwachung (bis zum 14. Tag nach dem letzten Kontakt mit dem bestätigten Infektionsfall) empfohlen, dabei sollen die Kontaktpersonen ein Tagebuch führen, in dem die Körpertemperatur, Symptome und mögliche weitere Kontaktpersonen notiert werden. Das Gesundheitsamt meldet sich täglich, um sich über den Gesundheitszustand informieren zu lassen. Die Kontaktpersonen werden über das COVID-19-Krankheitsbild informiert und sollen namentlich registriert werden. Falls während der häuslichen Quarantäne Symptome auftreten, die auf eine SARS-CoV-2-Infektion hindeuten, wird die Kontaktperson als Verdachtsfall angesehen und nach Rücksprache mit dem Gesundheitsamt eine diagnostische Abklärung veranlasst.[368] Personen der Kategorie II wird eine häusliche Absonderung auf freiwilliger Basis nahegelegt, eine namentliche Registrierung ist optional. Auch hier gilt, dass bei Eintreten von Symptomen unverzüglich das Gesundheitsamt zu informieren ist. Bei der häuslichen Absonderung ist u. a. die Kontaktperson zeitlich und räumlich von anderen Haushaltsmitgliedern zu trennen und auf die Hygiene (Händewaschen, Hustenetikette) zu achten.[368] Das Management von Personen der Kategorie III dient dazu, nosokomiale Übertragungen des Virus zu vermeiden. Dabei gilt, dass das medizinische Personal durch die Verwendung der persönlichen Schutzausrüstung (PSA) vor Infektionen geschützt ist, aber darüber hinaus durch Schulungen und organisatorische Maßnahmen verhindert werden soll, dass es zu Virusübertragungen im Arbeitsbereich kommt. Nach Möglichkeit soll das medizinische Personal, das COVID-19-Patienten versorgt, nicht mit der Versorgung anderer Patienten beauftragt werden. Das medizinische Personal soll sensibilisiert werden und sich selbst auf Symptome überwachen, die Ergebnisse wie auch die verwendete PSA sollen in einem Tagebuch notiert werden.[369] Bei Kontaktpersonen I wird von einer häuslichen Absonderung abgesehen, wenn diese in den letzten drei Monaten selbst als laborbestätigter Fall die Infektion durchgemacht haben.[368] Schutzimpfungen Die Ständige Impfkommission (STIKO) des Robert Koch-Instituts empfiehlt in ihrem Impfkalender die Impfung gegen COVID-19 für Personen ab 18 Jahren.[372] Die Ziele der Schutzimpfung gegen COVID-19 sind vielfältig: Schutz jeden Individuums vor der Erkrankung, Schutz der besonders Gefährdeten, Stoppen einer pandemischen Welle, Aufrechterhaltung der individuellen Freiheit, Schutz der Wirtschaft, Schutz des wenig Gefährdeten vor Impf-Nebenwirkungen, globale Gerechtigkeit. Diese teils divergenten Ziele implizieren unterschiedliche mögliche Strategien bezüglich Impfstoffverteilung,[373] Impf-Priorisierung,[374] Intervall zwischen Erst- und Zweitimpfung,[375] Anzahl von Booster-Impfungen[376] und Dosiswahl.[377] Impfstoffe und Impfstoffkandidaten Im Artikel COVID-19-Impfstoff sind in tabellarischer Form die bisher → zugelassenen COVID-19-Impfstoffe, die →Impfstoffkandidaten in klinischer Prüfung sowie die →Impfstoffkandidaten in präklinischer Prüfung erfasst. Außerdem können dem Artikel Informationen zur Impfstoffentwicklung, der Arzneimittelsicherheit, der Impfstoffwirksamkeit und zur Arzneimittelzulassung entnommen werden. Weltweit sind laut Weltgesundheitsorganisation (Stand: 1. Juni 2021) 102 Vakzine in der klinischen Prüfung. Weitere 185 sind in der vorklinischen Entwicklung.[378] Die zugelassenen Impfstoffe werden inzwischen weltweit eingesetzt (s. Fortschritt der Impfkampagnen). Die wissenschaftlich veröffentlichte Datenlage zu den Impfstoffen Tozinameran, AZD1222, mRNA-1273 und Ad26.COV2.S belegt, dass unabhängig vom Impfstoff die Zahl der schweren Erkrankungen deutlich reduziert wird.[379] Seit Durchsetzung der Virus-Variante Delta schützen die Impfstoffe hingegen nicht mehr so gut wie bisher vor Virus-Übertragungen. Laut WHO sind geimpfte Personen ähnlich ansteckend wie ungeimpfte.[380] Erste Auffrischungsdosis und zusätzliche Impfstoffdosen für GrundimmunisierteEine weltweite Coronawelle, verursacht durch die hochgradig übertragbare Delta-Variante,[381] führte Mitte September 2021 zu Diskussionen über die Notwendigkeit und den optimalen Zeitpunkt für die Verabreichung einer weiteren Impfstoffdosis eines COVID-19-Impfstoffs an Personen, die bereits vollständig gegen schwere Verläufe einer COVID-19-Erkrankung grundimmunisiert sind. Ein Autorenkollektiv wies Mitte September 2021 im medizinischen Fachjournal The Lancet darauf hin, dass jede diesbezügliche Entscheidung evidenzbasiert sein sollte und die Vorteile und Risiken für den Einzelnen und die Gesellschaft berücksichtigen werden müssen.[382] Es ist zu unterscheiden zwischen einer Dosis zur Auffrischungsimpfung (englisch booster dose)[383] für Personen, die ausreichend auf die Grundimmunisierung gegen COVID-19 angesprochen haben, und einer zusätzlichen Impfstoffdosis (englisch extra dose)[383] eines COVID-19-Impfstoffs für Personen mit geschwächtem Immunsystem, die nach Verabreichung der Grundimmunisierungsserie nicht ausreichend auf diese ansprachen.[384][385][383] Auffrischungsdosis zur Wiederherstellung des ImpfschutzesEine Dosis zur Auffrischungsimpfung sollte vollständig gegen COVID-19 geimpften Personen verabreicht werden, um den Schutz gegen die Erkrankung wiederherzustellen, nachdem der durch Grundimmunisierungsserie erreichte Schutz abgeklungen ist. Die Vorteile und Risiken einer möglichen Auffrischungsdosis müssen zuvor klar umrissen und verglichen werden.[384][385]
Der wissenschaftliche Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) ist zu dem Schluss gekommen, dass der COVID-19-Impfstoff Comirnaty (BioNTech/Pfizer) für Auffrischungsimpfungen an Personen ab 18 Jahren mindestens 6 Monate nach Verabreichung der zweiten Dosis der Grundimmunisierungsserie in Betracht gezogen werden kann. Die Auswertung der bis dato vorliegenden Daten hat bei Personen im Alter von 18 bis 55 Jahren gezeigt, dass ein Anstieg des Antikörperspiegels zu verzeichnen ist, wenn eine Auffrischungsimpfung etwa sechs Monate nach Verabreichung der zweiten Dosis des Impfstoffs erfolgt. Die nationalen Gesundheitsbehörden können nun offizielle Empfehlungen für Auffrischungsimpfungen mit Comirnaty aussprechen. Neue Daten zur Wirksamkeit und zur begrenzten Sicherheit des mRNA-Impfstoffs sind dabei zu berücksichtigen.[383] Die Informationen über die Auffrischungsimpfung mit Comirnaty sind in der aktualisierten Produktinformation (Zusammenfassung der Merkmale des Arzneimittels und Packungsbeilage) enthalten.[386]
Die Europäische Arzneimittel-Agentur (EMA) sprach sich am 25. Oktober 2021 für eine Auffrischungsimpfung bereits Grundimmunisierter mit dem COVID-19-Impfstoff Spikevax (Moderna) aus. Für Personen ab 18 Jahren, die bereits eine zweite Dosis dieses mRNA-Impfstoffes erhalten haben, kann nach Auffassung des Ausschusses für Humanarzneimittel (CHMP) der EMA die Verabreichung einer dritten Impfstoffdosis nun in Betracht gezogen werden. Grundlage für diese Empfehlung bilden Daten, die zeigen, dass eine dritte Dosis Spikevax, die sechs bis acht Monate nach der Grundimmunisierung an Erwachsene verabreicht wird, deren Antikörpertiter deutlich anheben kann. Für eine Auffrischungsimpfung mit Spikevax soll nach Maßgabe der EMA die Hälfte der für die Erstimpfung verwendeten Dosis eingesetzt werden. Die aktuellen Daten deuten darauf hin, dass das Schema der zu erwartenden Nebenwirkungen nach den Auffrischungsimpfungen demjenigen nach der zweiten Dosis ähnelt. Das mögliche Auftreten entzündlicher Herzerkrankungen oder anderer sehr seltener Nebenwirkungen nach Auffrischungsimpfungen wird sorgfältig überwacht. Wie bei allen Arzneimitteln wird die EMA weiterhin alle Daten zur Sicherheit und Wirksamkeit von Spikevax prüfen. Auf nationaler Ebene können die zuständigen Gesundheitsbehörden jetzt offiziell Empfehlungen für Auffrischungsimpfungen mit Spikevax aussprechen. Die lokale epidemiologische Situation sowie neue Daten zur Wirksamkeit des Impfstoffs und die begrenzten sicherheitsrelevanten Daten für die Auffrischungsimpfungen sind dabei zu berücksichtigen.[387][388] Die Informationen zu Auffrischungsimpfungen mit Spikevax sind in der aktualisierten Produktinformation enthalten.[389]
Mit Stand vom 15. Oktober 2021 wurde für den COVID-19-Impfstoff Ad26.COV2.S (Janssen / Johnson & Johnson) noch keine Zulassung für die Verabreichung von Auffrischungsimpfungen gegen COVID-19 beantragt. Unabhängig davon hat in Deutschland die Ständige Impfkommission (STIKO) die Verabreichung einer Auffrischungsdosis an Personen empfohlen, deren Grundimmunisierung mit Ad26.COV2.S (Janssen / Johnson & Johnson) erfolgt ist. Nach Maßgabe der STIKO sollten bereits mit diesem Vektorimpfstoff geimpfte Personen frühestens vier Wochen nach der Grundimmunisierung eine Auffrischungsdosis mit einem mRNA-Impfstoff (Spikevax von Moderna oder Comirnaty von Biontech/Pfizer) zur Aufrechterhaltung ihres Immunschutzes gegen COVID-19 erhalten. Die Empfehlung der STIKO beruht darauf, dass im Verhältnis zur Anzahl der verabreichten Impfstoffdosen in Deutschland die meisten Impfdurchbruchserkrankungen nach COVID-19-Impfungen bei Personen beobachtet wurden, die mit dem Ad26.COV2.S (Janssen / Johnson & Johnson) geimpft worden seien. Zudem sei die Wirksamkeit dieses Vektorimpfstoffs gegen die Delta-Variante geringer als bei den anderen COVID-19-Impfstoffen.[390] Ad26.COV2.S (Janssen / Johnson & Johnson): Der Humanarzneimittelausschuss der EMA (CHMP) ist zu dem Schluss gekommen, dass eine Auffrischungsdosis mit Ad26.COV2.S bei Personen ab 18 Jahren mindestens zwei Monate nach der ersten Dosis in Betracht gezogen werden kann. Die Empfehlung folgt Daten, die zeigen, dass nach Verabreichung einer Auffrischungsdosis des COVID-19-Impfstoffs Ad26.COV2.S, die mindestens zwei Monate nach der ersten Dosis bei Erwachsenen verabreicht wird, zu einem Anstieg der Antikörper gegen SARS-CoV-2 (das Virus, das COVID-19 verursacht) führt. Sehr seltenen Nebenwirkungen nach einer Auffrischimpfung mit Ad26.COV2.S seien nicht bekannt. Mögliche Risiken einer Thrombose in Kombination mit Thrombozytopenie (TTS) oder andere sehr seltenen Nebenwirkungen nach einer Auffrischungsbehandlung wird überwacht (Monitoring). Der CHMP kam außerdem zu dem Schluss, dass eine Auffrischungsdosis mit Ad26.COV2.S nach zwei Dosen eines der in der EU zugelassenen mRNA-Impfstoffe, Comirnaty (BioNTech/Pfizer) oder Spikevax (Moderna), verabreicht werden kann. Alle Daten zur Sicherheit und Wirksamkeit von Ad26.COV2.S werden weiterhin von der EMA geprüft. Die nationalen Gesundheitsbehörden können unter Berücksichtigung der örtlichen epidemischen Lage, der Verfügbarkeit von Impfstoffen, der sich abzeichnenden Impfstoffwirksamkeit und der begrenzten Daten zur Arzneimittelsicherheit für die Auffrischung der Grundimmunisierung gegen COVID-19 offizielle Empfehlungen für die Verwendung von Auffrischungsdosen entweder nach einer Dosis Ad26.COV2.S oder nach zwei Dosen eines mRNA-Impfstoffs aussprechen. Daten, die die Auffrischungsempfehlung für COVID-19-Impfstoff von Janssen unterstützen, werden in der aktualisierten Produktinformation verfügbar sein.[391] Die US-amerikanische Arzneimittelbehörde FDA und die Gesundheitsbehörde der Vereinigten Staaten CDC raten jedoch davon ab Erwachsene mit dem COVID-19-Impfstoff Ad26.COV2.S (Janssen / Johnson & Johnson) zu impfen. Stattdessen sollten die auf mRNA basierenden COVID-19-Impfstoffe Comirnaty (BioNTech/Pfizer) oder Spikevax (Moderna) verabreicht werden. Begründet sind diese Empfehlungen im Auftreten des Thrombose-mit-Thrombozytopenie-Syndrom (TTS) in den USA. Nach Verimpfung von Ad26.COV2.S seien nach Mitteilung der CDC 54 Fällen von TTS aufgetreten. Alle 54 Patienten wurden hospitalisiert, 36 davon wurden auf der Intensivstation behandelt, neun seien gestorben. Unter 54 Patienten waren 37 weiblich, das Durchschnittsalter der von TTS-Betroffenen lag bei 44 Jahren. Die CDC wies jedoch darauf hin, dass eine Impfung mit Ad26.COV2.S besser sei als gar keine Impfung gegen COVID-19, insbesondere treffe dies auf Personen zu, die keine Impfung mit mRNA-Impfstoffen wollen oder haben können. Die Impfung mit Ad26.COV2.S war im Frühjahr 2021 nach dem Auftreten der ersten Fälle von TTS nach Verimpfung dieses Vektorimpfstoffs bereits einmal in den USA ausgesetzt worden.[392]
Für den COVID-19-Impfstoff Vaxzevria (AstraZeneca/Oxford) wurde in Europa mit Stand vom 15. Oktober 2021 noch keine Zulassung für die Verabreichung von Auffrischungsimpfungen gegen COVID-19 beantragt.[390] Impfstoffdosen zur Ergänzung der GrundimmunisierungEine Zusätzliche Impfstoffdosis sollte für Personen mit einem stark geschwächten Immunsystem als Ergänzung der Grundimmunisierungsserie in Betracht gezogen werden, da diese Personen möglicherweise keinen ausreichenden Schutz durch die Grundimmunisierungsserie erreichen.[384][385] Zu den Personen mit einem stark geschwächten Immunsystem gehören Organtransplantationspatienten. Studien haben gezeigt, dass eine zusätzliche Dosis der COVID-19-Impfstoffe Comirnaty (BioNTech/Pfizer) oder Spikevax (Moderna) bei diesen Patienten die Fähigkeit zur Bildung von Antikörpern gegen das Coronavirus SARS-CoV-2 erhöht. Obwohl noch nicht erwiesen ist, dass die Fähigkeit zur Bildung von Antikörpern diese Patienten vor der COVID-19-Erkrankung schützt, ist zu erwarten, dass eine zusätzliche Impfstoffdosis den Schutz zumindest bei einigen erhöht. Alle Daten, die sich zur Impfstoffwirksamkeit ergeben, werden von der EMA weiter beobachtet und die Produktinformation (d. h. Zusammenfassung der Merkmale des Arzneimittels und Packungsbeilage) für beide Impfstoffe entsprechend der Empfehlung vom 4. Oktober 2021 aktualisiert.[393] Comirnaty (BioNTech/Pfizer): Personen, an die eine Impfstoffdosis ‚Comirnaty‘ verimpft wurde, sollten ‚Comirnaty‘ auch als zweite Dosis der primären Impfserie erhalten. Die Verabreichung eine dritten Dosis ‚Comirnaty‘ an Personen mit starker Immunsupprimierung kann mindestens 28 Tage nach der zweiten Dosis des Impfstoffs in Betracht gezogen werden. Die Austauschbarkeit von ‚Comirnaty‘ mit anderen COVID-19-Impfstoffen zur Vervollständigung der primären Impfserie (dritte Dosis) ist nicht erwiesen.[394] Die Empfehlung der EMA bei stark immunsupprimierten Personen eine dritte Dosis des mRNA-Impfstoffes Comirnaty in Betracht zu ziehen, basiert auf begrenzten serologischen Nachweisen aus einer Fallserie in der Literatur zur klinischen Behandlung von Patienten mit iatrogener Immunsuppression nach Transplantation solider Organe, wie z. B. Nieren, Herz, Lunge oder Leber. Die Wirksamkeit und Sicherheit des Impfstoffs wurde bei immunsupprimierten Personen, einschließlich Personen die Immunsuppressiva erhielten, nicht bewertet.[395] Spikevax (Moderna): Bei schwerwiegend immungeschwächten Personen (ab 12 Jahren) kann im Rahmen der Grundimmunisierung eine dritte Dosis ‚Spikevax‘ (0,5 ml) frühestens 28 Tage nach der zweiten Dosis in Betracht gezogen werden.[396] Die Wirksamkeit und Sicherheit des Impfstoffs wurden bei immungeschwächten Personen, einschließlich Personen unter einer Therapie mit Immunsuppressiva, nicht untersucht. Die Empfehlung der EMA, bei stark immungeschwächten Personen eine dritte Dosis in Betracht zu ziehen, basiert auf begrenzten serologischen Nachweisen von Patienten, die nach einer Transplantation eines einzelnen Organs immungeschwächt sind.[397] Auffrischungsimpfung für Grundimmunisierte mit bivalenten COVID-19-ImpfstoffenUm die Menschen zu schützen und eine Überlastung Gesundheitssysteme zu verhindern sind rechtzeitige Auffrischungsimpfungen vor einem möglichen Anstieg von COVID-19-Fällen im Herbst/Winter 2022 unerlässlich. Die Europäische Kommission hat deshalb kürzlich das Repertoire der in der EU zugelassenen COVID-19-Impfstoffen um zwei angepasste, bivalente COVID-19-Impfstoffe erweitert; es handelt sich um die mRNA-Impfstoffe Comirnaty Original/Omicron BA.1 (Biontech/Pfizer) und Spikevax bivalent Original/Omicron BA.1 (Moderna). Da sich das Coronavirus SARS-CoV-2 weiterentwickelt hat, wurden zur Gewährleistung eines optimalen Schutzes der EU-Bürger vor schweren COVID-19-Erkrankungen, die bereits von der Europäischen Arzneimittel-Agentur (EMA) zugelassenen Impfstoffe Comirnaty (Biontech/Pfizer) und Spikevax (Moderna) an den Wildtyp von SARS-CoV-2 und dessen Omikron-Subvariante BA.1 angepasst. Diese ersten beiden angepassten COVID-19-Impfstoffe sind zur Anwendung für Auffrischungsimpfungen („Booster-Impfungen“) bei Personen ab 12 Jahren zugelassen, die mindestens eine Grundimmunisierung gegen COVID-19 erhalten haben. Laut Europäische Zentrum für die Prävention und die Kontrolle von Krankheiten (ECDC) soll das Immunsystem des Menschen durch „Booster-Impfungen“ mit den neuen, angepassten COVID-19-Impfstoffen geschult werden, gegen neu auftretende besorgniserregende Virusvarianten (VoC) eine breitere Immunantwort aufzubauen.[398] Das ECDC und die EMA empfehlen diese Auffrischungsimpfungen vorrangig Personen, die einem höheren Risiko zu einer schweren Erkrankung aufgrund bestimmter Risikofaktoren ausgesetzt sind als andere. Dazu gehören Personen ab 60 Jahren, immungeschwächte Personen und andere gefährdete Personen (ab 12 Jahren) mit Grunderkrankungen, die sie einem höheren Risiko für schweres COVID-19 aussetzen, sowie schwangere Frauen. Bewohner und Personal in Pflegeheimen soll bei den Auffrischungsimpfungen priorisiert werden. Beschäftigte im Gesundheitswesen können aufgrund ihrer erhöhten Exposition im Falle zukünftiger neuer Infektionswellen von SARS-CoV-2 und ihrer Schlüsselrolle für gut funktionierende Gesundheitssysteme ebenfalls für Auffrischungsimpfungen in Betracht gezogen werden. Mit den anderen, bereits vormals in der EU zugelassenen COVID-19-Impfstoffen sollten auch weiterhin die Grundimmunisierung gegen COVID-19 erfolgen, da sie nach wie vor gegen schwere COVID-19-Erkrankungen und den daraus resultierenden Folgen schützen. Für Auffrischungsimpfungen sollte diese Impfstoffe nur dann in Betracht gezogen werden, wenn die angepassten, bivalenten Impfstoffe noch nicht zur Verfügung stehen.[398] Um bestehende und zukünftig zirkulierende Varianten zu berücksichtigen, ist die weitere Anpassung von COVID-19-Impfstoffen unvermeidlich. Vorläufige Daten zeigen, dass die durch die zugelassenen, an die Omikron-Subvariante BA.1 angepassten Impfstoffe eine Immunantwort ausgelöst wird, die über die Anpassung an die ausgewählten Virusstämme von SARS-CoV-2 hinausgeht und auch andere Omicron-Subvarianten wie BA.2, BA.2.75 und BA.5 abdeckt.[398] Zusätzlich zu den beiden angepassten, bivalenten COVID-19-Impfstoffen evaluiert die EMA einen angepassten Impfstoff, der auf die Omikron-Subvariante BA.1, den Wildtyp von SARS-CoV-2 und die Omicron Subvarianten BA.4 und BA.5 abgestimmt ist. Zurzeit laufen auch Überprüfungen von COVID-19-Impfstoffen, deren Impfstoffdesign auch den Beta-Stamms von SARS-CoV-2 einschließt.[398] Siehe auch:
Allgemeine ImpfprophylaxeDie Berliner Senatsgesundheitsverwaltung empfahl Ende Februar 2020 allen Menschen über 60 Jahre und chronisch Kranken, ihren Impfstatus zu überprüfen und gegebenenfalls die Impfung gegen Pneumokokken und Keuchhusten (Pertussis) durchführen oder auffrischen zu lassen. Da Menschen über 60 Jahre und chronisch Kranke durch Mehrfachinfektionen besonders gefährdet sind, seien sie vorsorglich zu schützen.[399][400] Durch die Schutzmaßnahmen gegen eine SARS-CoV-2-Infektion ist die Grippewelle 2020/21 weltweit ausgefallen; auch die Verbreitung von Influenzaviren wurde dadurch im Nebeneffekt erfolgreich eingedämmt. Unser Immunsystem könnte im kommenden Winter 2021/22 jedoch weniger gut auf die dann zirkulierenden Influenzaviren vorbereitet sein. Menschen mit erhöhtem Gesundheitsrisiko, darunter Menschen ab 60 Jahren, Schwangere und chronisch Kranke aller Altersgruppen aber auch medizinisches und pflegerisches Personal, das ein berufliches Ansteckungsrisiko hat, sollten sich daher im Oktober, November oder in der ersten Dezemberhälfte vorbeugend gegen Grippe impfen lassen.[401] Die Wirksamkeit einer Grippeschutzimpfung kann bei älteren Menschen geringer ausfallen. Um diese Personengruppe besser vor einer Grippe und damit verbundene Komplikationen zu schützen, empfiehlt die Ständige Impfkommission (STIKO) beim RKI für Menschen ab 60 Jahren einen speziell für diese Altersgruppe entwickelten Hochdosis-Grippeimpfstoff.[401] Influenza-Hochdosis-Impfstoffe haben im Vergleich zu inaktivierten, quadrivalenten[402] Influenza-Standard-Impfstoffen eine leicht aber signifikant bessere Wirksamkeit bei Senioren.[403] Zudem ist eine zeitgleiche Impfung gegen Grippe und zum Schutz vor COVID-19 möglich.[401] Maßnahmen bei TodesfällenLaut den Empfehlungen des RKI ist beim Umgang mit an COVID-19 Verstorbenen jeglicher Körperkontakt oder die Abgabe von Flüssigkeiten und Aerosolen zu vermeiden. Eine notwendige Leichenschau ist unter Regelungen der Schutzstufe 3 durchzuführen. Auf dem Totenschein ist COVID-19 namentlich anzugeben und Särge sind zu markieren.[404] Meldepflicht, ICD-10-Einordnung, BerufskrankheitIn Deutschland sind Verdacht einer Erkrankung, die Erkrankung sowie der Tod in Bezug auf die Coronavirus-Krankheit-2019 seit 23. Mai 2020 gemäß § 6 Abs. 1 Nr. 1 lit. t des Infektionsschutzgesetzes (IfSG) meldepflichtig. Die Meldepflicht wurde bereits zum 1. Februar 2020 durch Verordnung eingeführt. Seit der gesetzlichen Regelung durch das „Zweite Gesetz zum Schutz der Bevölkerung bei einer epidemischen Lage von nationaler Tragweite“ sind auch der Behandlungszustand zur Krankheit (einschließlich der Genesung[405][406]) und der Serostatus durch Ärzte und Gesundheitsämter anzugeben (§ 9 Abs. 1 Nr. 1 lit. n, § 11 Abs. 1 Nr. 1 lit. d und j IfSG). Die klinisch-epidemiologischen Kriterien für den Verdacht[407] werden wie nach der vorherigen Verordnung durch das Robert Koch-Institut festgelegt und veröffentlicht (als Falldefinitionen nach § 11 Absatz 2 IfSG).[406] Zudem besteht in Deutschland für Labore eine Meldepflicht hinsichtlich des Virus SARS-CoV-2 in Bezug auf Menschen. Seit dem 2. Juli 2020 besteht eine Meldepflicht, wenn Haustiere positiv getestet wurden.[408] In Österreich bestand ebenfalls Anzeigepflicht nach dem Epidemiegesetz von 1950[409] zusammen mit einer Verordnung[410]. Die Pflicht zur Anzeige bestand für Verdachts-, Erkrankungs- und Todesfälle aufgrund dieses Virus. Die Meldepflicht wurde am 1. Juli 2023 aufgehoben.[411] Auch in der Schweiz existiert eine Meldepflicht für den Erreger Sars-CoV-2. Diese folgt aus dem Epidemiengesetz[412] der Schweiz in Verbindung mit der Epidemienverordnung[413] und der Verordnung des Eidgenössischen Departements des Innern (EDI) über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen[414]. Nach Anhang 3 der Verordnung des EDI müssen Labore einen positiven und negativen Befund (also Nachweis) von Sars-CoV-2 melden. Nicht zu melden ist der Nachweis durch einen Antigen-Schnelltest.
Am 17. Februar 2020 wurde die Krankheit durch die Weltgesundheitsorganisation (WHO) in die Internationale Klassifikation der Krankheiten (ICD) in der aktuellen, international gültigen Ausgabe ICD-10-WHO (Version 2019) unter Schlüsselnummer »U07.1« aufgenommen. Für die in Deutschland geltende ICD-10-GM (German Modification) wurde als sekundärer Kode die Ausrufezeichenschlüsselnummer »U07.1!« vergeben und die Krankheit als COVID-19 (Coronavirus-Krankheit-2019) bezeichnet.[415] Weiterhin erfolgte eine entsprechende Ergänzung für die Todesursachenkodierung in der ICD-10-GM.[95] Am 23. März 2020 wurde von der WHO eine Anpassung vorgenommen, die darauf abzielt, auch Verdachtsfälle kodieren zu können. Entsprechend werden mit der Schlüsselnummer »U07.1« per Labordiagnostik bestätigte COVID-19-Erkrankungen kodiert, während die »Schlüsselnummer U07.2« für Fälle vorgesehen ist, die zwar klinisch-epidemiologisch, aber nicht per Labordiagnostik bestätigt wurden. Für die ICD-10-GM erfolgt die Kodierung analog in Form der beiden sekundären Kodes »U07.1!« mit der Bezeichnung: COVID-19, Virus nachgewiesen und »U07.2!« mit der Bezeichnung: COVID-19, Virus nicht nachgewiesen.[2] Zweites gilt aber nur, soweit vorher ein Verdacht auf COVID-19 bestand.[416] Sofern kein Verdacht auf eine Erkrankung bestand, ein Test auf SARS-CoV-2 durchgeführt wurde und dieser Test negativ ausfällt, so ist mit »U99.0!« für Spezielle Verfahren zur Untersuchung auf SARS-CoV-2 zu kodieren zusammen mit »Z11« für Spezielle Verfahren zur Untersuchung auf infektiöse und parasitäre Krankheiten.[417]
Im November 2020 veröffentlicht das BfArM (früher DIMDI) in seinem Newsletter neue Codes, welche von der WHO am 11. November 2020 in die ICD-10 aufgenommen worden waren.[418] Diese Codes sind ab 2021 auch in der Schweiz zu verwenden.[419] Im März 2021 werden vom BfArM neue Codes veröffentlicht, welche im Kontext zur Covid-19-Impfung stehen. In Deutschland sind diese Codes ab 10. März 2021 zu verwenden.[420] Nach deutschem Recht kann COVID-19 als Berufskrankheit anerkannt werden, wenn der Erkrankte im Gesundheitsdienst, in der Wohlfahrtspflege oder in einem Laboratorium tätig oder durch eine andere Tätigkeit der Infektionsgefahr in ähnlichem Maße besonders ausgesetzt war.[421] COVID-19, Tiere und HaustiereWährend innerhalb der Coronavirusfamilie Coronaviridae einzelne Viren, wie das CCoV und das FCoV, auch bei Haustieren Erkrankungen auslösen, wurde in den ersten Monaten der Coronapandemie zunächst kein Fall bekannt, in dem ein Haustier an SARS-CoV-2 erkrankte.[422][423][424][425] Obwohl das Virus bei Hunden in Abstrichen aus Nase und Schnauze nachgewiesen werden konnte, löste es keine Erkrankungen aus.[426][425] Nachdem zunächst nur ein Einzelfall einer Katze mit Krankheitssymptomen in Belgien bekannt geworden war, zeigte eine umfangreichere serologische Studie, dass bei knapp 15 % der untersuchten Tiere Antikörper und somit eine vorherige Infektion nachweisbar war.[427][428] Es gibt laut WHO noch keine Hinweise, dass Haustiere das Virus als Träger weiterverbreiten.[423][425] Versuche mit Frettchen in Südkorea ergaben indes, dass nicht-infizierte Tiere durch anhaltenden direkten Kontakt mit infizierten Tieren (Haltung im selben Käfig) angesteckt werden können. Erkrankte Frettchen entwickeln mehrtägige Verläufe mit Symptomen wie leichtes Fieber, Husten und reduzierte körperliche Aktivität.[429] Anfang April wies eine weitere Studie diese Anfälligkeit auch bei Katzen nach. Den Autoren zufolge kommt dabei eine Aerosolübertragung in Betracht. In beiden Tierarten war die Viruslast im Nasen-Rachenraum am höchsten. Die Lungen von Frettchen sowie weitere Organe waren nicht befallen, bei Katzen dagegen schon. Hunde zeigten ein geringes Infektionsrisiko; bei Schweinen, Hühnern und Enten war sowohl der PCR-Abstrich als auch der ELISA-Antikörpertest nach 14 Tagen negativ.[430] Im Januar 2021 wurden im Zoo von San Diego Gorillas positiv auf SARS-CoV-2 getestet; die ersten Menschenaffen, bei denen COVID-19 nachgewiesen wurde.[431] Im US-Bundesstaat Utah starben einige Tausend Amerikanische Nerze, die sich wahrscheinlich bei Tierpflegern angesteckt hatten.[432] In den Niederlanden gibt es zahlreiche Nerzfarmen. Niederländische Behörden meldeten Ende Mai 2020, „mit hoher Wahrscheinlichkeit“ seien zwei Arbeiter durch Kontakt mit Nerzen COVID-19-infiziert worden. Die WHO teilte mit, es könne sich um die „ersten bekannten Fälle“ einer Übertragung des Virus vom Tier auf den Menschen handeln (Näheres und Beleg → COVID-19-Pandemie im Königreich der Niederlande#Wirtschaft und Unternehmen). In Dänemark untersucht(e) das Fødevarestyrelsen (Nahrungsmittelbehörde)[433] 120 Nerzfarmen. In der Gemeinde Hjørring fand sie unabhängig davon drei Farmen mit SARS-CoV-2-infizierten Nerzen; alle Nerze in diesen Farmen wurden getötet.[434] Im Juni wurde bei Nerzen, Nerzzüchtern, dem Hund eines Nerzzüchters und 41 Bewohnern eines Pflegeheimes die gleiche Mutation eines SARS-CoV-2-Virus festgestellt. Von den Bewohnern starben drei. Auch bei Schülern an drei verschiedenen Schulen wurden SARS-CoV-2 gefunden.[435] Im November entschied die dänische Regierung vorsorglich eine Keulung des gesamten nationalen Nerzbestands.[436] Am 5. November 2020 verhängte die dänische Regierung aufgrund zunehmender Verbreitung in Nerzen mutierter SARS-CoV-2-Viren (insbesondere der antikörperresistenteren „Cluster 5“-Variante) in der allgemeinen Öffentlichkeit einen „harten regionalen Lockdown“ über Teile Norddänemarks.[437][438] Ein experimentelles Vakzin gegen COVID-19 wird an den in ihrem Bestand stark gefährdeten (Endangered, IUCN 3.1) Schwarzfußiltissen erprobt.[439] Finnland entwickelt einen Impfstoff für Marderhunde und Amerikanische Nerze (Minks), um in den Pelztierfarmen keine Massenkeulungen vornehmen zu müssen.[440] Auch Russland entwickelt einen Impfstoff für Nerze, Katzen und Nagetiere. Dieser soll nach Planung Ende Januar 2021 verfügbar sein.[441] Siehe auchLiteraturDeutschsprachig
Englischsprachig
Dokumentationen
WeblinksCommons: COVID-19 – Sammlung von Bildern, Videos und Audiodateien
Wiktionary: Verzeichnis von Wörtern im Zusammenhang mit COVID-19/Corona – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Steckbrief, FAQs, Aktuelles
Auswirkungen auf den menschlichen Körper
COVID-19-Therapie
Einzelnachweise
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||









