|
G-білки G-білки (англ. Guanine nucleotide-binding proteins, білки, що зв'язують гуанілові нуклеотиди) — це родина білків, що беруть участь у клітинному сигналюванні еукаріот. G-білки відіграють роль своєрідних перемикачів: вони можуть переходити з неактивного стану в активний і навпаки, відповідно вмикаючи або вимикаючи передачу певного сигналу всередині клітини. Свою назву ці білки отримали за здатність зв'язувати гуанілові нуклеотиди (англ. Guanine nucleotide): у комплексі із гуанозиндифосфатом (ГДФ) вони є неактивними, а у комплексі із гуанозинтрифосфатом (ГТФ) — активні. Термін «G-білки» найчастіше вживається для позначення гетеротримерних (великих) ГТФ-зв'язуючих білків, що складаються із трьох субодиниць α, β та γ; існує ще один клас ГТФ-зв'язуючих білків — мономерні, котрі інколи називають малими G-білками (суперродина Ras малих ГТФаз), вони гомологічні до α-субодиниці великих[1]. Гетеротримерні G-білки беруть участь у передачі сигналів від рецепторів, спряжених з G-білками (англ. G-protein coupled receptors, GPCR) — найбільшого класу клітинних рецепторів (наприклад, у Caenorhabditis elegans їх гени займають 5 % всього геному). У хребетних тварин вони відповідають за сприйняття клітиною ряду гормонів та інших сигнальних молекул, а також за хімічне чуття (нюх і смак) і фоторецепцію (зір). Показовим є те, що приблизно половина відомих фармацевтичних препаратів діють через рецептори, спряжені із G-білками[2]: серед таких є і відомі медикаменти, наприклад антигістамін Кларитин (Лоратадин) та антидепресант Прозак (Флуоксетин), а також психотропні речовини, зокрема героїн, кокаїн та тетрагідроканабінол (діюча речовина марихуани)[3]. Гетеротримерні G-білки були вікриті Альфредом Гілманом та Мартіном Родбеллом, за що у 1994 році вони отримали Нобелівську премію з фізіології та медицини[4]. Структура гетеротримерних G-білків Гетротримерні G-білки складаються із трьох субодиниць: α, β і γ. α-субодиниця містить домен зв'язування та гідролізу ГТФ, що є ідентичним для всієї суперродини ГТФаз. До складу β-субодиниці входить 7 β-структур, організованих як лопасті пропеллера. Із β-субодиницею тісно взаємодіє γ-субодиниця, разом вони утворюють єдину функціональну структуру, яка може дисоціювати тільки у випадку гідролізу білка[5]. Весь G-білок заякорений у мембрані за допомогою двох ліпідів, один із яких ковалентно приєднаний до N-кінця α-субодиниці, інший до C-кінця γ-субодиниці[1]. Рецептори, спряжені із G-білками
 Рецептори, спряжені із G-білками (англ. G-protein coupled reseptors, GPCR) — найбільша родина клітинних рецепторів еукаріот, що забезпечують сприйняття гормонів, нейромедіаторів, локальних регуляторів, а також забезпечують зір, нюх та відчуття смаку хребетних тварин. У геномі людини знайдено близько 700 генів GPCR, а в миші за один тільки нюх відповідає понад 1000 цих рецепторів. Сигнальні молекули, що виступають лігандами для рецепторів, спряжених із G-білками, можуть бути дуже різними за хімічною природою: білками, невеликими пептидами, ліпідами, похідними амінокислот тощо. Окрім цього деякі представники цього класу рецепторів, зокрема родопсин, можуть сприймати фотони світла. Інколи для однієї сигнальної молекули існує кілька різних GPCR, що експресуються у різних типах клітин і запускають різні сигнальні шляхи. Наприклад в організмі людини існує як мінімум 9 різних рецепторів до адреналіну та принаймні 14 — до нейромедіатора серотоніну.[2] Всі рецептори, спряжені із G-білками, мають схожу структуру: вони складаються з одного поліпептидного ланцюга, що 7 разів перетинає ліпідний бішар. Кожен трансмембранний домен представлений α-спіраллю, до складу якої входить 20-30 неполярних амінокислот. Ці домени з'єднані між собою петлями різної величини, розташованими по дві сторони плазматичної мембрани. GPCR переважно є глікопротеїнами, вуглеводні залишки яких розташовані на зовнішньоклітинній стороні. Внутрішньоклітинні домени цих рецепторів містять сайти взаємодії із G-білками.[6] Функціональний цикл G-білків G-білки виконують роль спряження клітинних рецепторів із певними ефекторними молекулами, такими як ферменти або іонні канали, при цьому вони виступають як молекулярні перемикачі. В неактивному стані G-білки містять ГДФ, зв'язаний із α-субодиницею. Передача сигналу починається тоді, коли на клітинний рецептор діє відповідний ліганд, внаслідок чого рецептор активується і змінює конформацію. Активований рецептор впливає на G-білок (який або перебуває з ним у постійному комплексі, або асоціює після активації), через що структура α-субодиниці змінюється таким чином, що вона вивільняє зв'язану молекулу ГДФ. Місце цієї молекули швидко займає ГТФ, це призводить до активації G-білка та змін у його структурі: α-субодиниця втрачає спорідненість до βγ-комплексу, і він дисоціює. У такому активованому стані як ГТФ-зв'язана α-субодиниця, так і βγ-комплекс, можуть здійснювати передачу сигналу: активувати певні ферменти або впливати на стан іонних каналів. α-субодиниця є ГТФазою, і як тільки вона гідролізує приєднаний ГТФ до ГДФ, відразу ж інактивується, і тримерна структура G-білка відновлюється. Таким чином відбувається вимкнення сигналу. Інактивований G-білок може взаємодіяти із наступною молекулою рецептора і знову активуватись[2]. Регуляція активності G-білківЕфективність передачі певного сигналу через G-білок залежить від співвідношення між концентрацією активної, ГТФ-зв'язаної, та неактивної, ГДФ-зв'язаної форм. А це співвідношення у свою чергу залежить від двох констант: константи дисоціації ГДФ, та константи швидкості гідролізу ГТФ:
Таке співвідношення справджується за умови надлишку ГТФ у середовищі, а також його швидкого, фактично моментального, зв'язування із «порожньою» молекулою G-білка (тобто не зв'язаною із жодним гуаніловим нуклеотидом). У такому випадку ефективність передачі сигналу може регулюватись одним із наступних шляхів:
Сигнальні шляхи, що активуються G-білкамиG-білки отримують вхідний сигнал від асоційованих з ними рецепторів, після чого вони активують один із сигнальних шляхів клітини. Вплив на синтез циклічного АМФ
 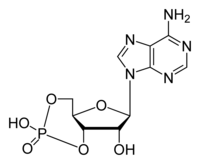 Циклічний АМФ (цАМФ) — це розповсюджений вторинний посередник, що контролює багато процесів в еукаріотичних клітинах. цАМФ синтезується із АТФ великим трансмембранним ферментом аденілатциклазою, а розкладається цАМФ-фосфодіестеразою. Багато сигнальних молекул впливають на клітину шляхом збільшення або зменшення концентрації цАМФ, через активацію або пригнічення аденілатциклази. цАМФ здійснює свою функцію вторинного посередника активуючи цАМФ-залежну протеїнкіназу (протеїнкіназу А, ПКА), яка у свою чергу фосфорилює по залишках серину та треоніну багато білків у клітині, активуючи або деактивуючи їх[2]. Існує два типи G-білків, що впливають на активність аденілатциклази: Gs (англ. stimulatory) — стимулюючий, що активує її і збільшує концентрацію цАМФ та Gi (англ. inhibitory) — інгібуючий, що пригнічує аденілатциклазу, але також діє і шляхом прямого впливу на іонні канали. Прикладами реакцій, що запускаються шляхом Gs-залежного збільшення концентрації цАМФ, є:
Бактерійні токсини, що впливають на активність білків Gs та GiG-білки, що впливають на цАМФ-залежне клітинне сигналювання, є мішенями дії бактерійних токсинів:
Ці два токсини використовуються у біологічних дослідженнях, щоб визначити чи певна клітинна відповідь опосередковується Gs- чи Gi-білком.[2] Активація фосфоліпази С-β Багато рецепторів, спряжених із G-білками діють шляхом активації фосфоліпізи С-β (ФЛС-β). Цей фермент діє на інозитоловий фосфоліпід: фосфатидилінозитол-4,5-біфосфат (ФІ(4,5)Ф2 або ФІФ2), що присутній у невеликій кількості у внутрішньому листку ліпідного бішару плазматичної мембрани. Рецептори, що активують цей сигнальний шлях, зазвичай спряжені із Gq-білком, що активує фосфоліпазу С аналогічно як Gs-білок — аденілатциклазу. Активована фосфоліпаза розщеплює фосфатидилінозитол-4,5-біфосфат до інозитол-1,4,5-трифосфату (ІФ3) та диацигліцеролу (ДАГ). На цьому етапі сигнальний шлях розгалужується:
Прикладами клітинних реакцій G-білок-залежної активації фосфоліпази C-β є:
Регуляція іонних каналів G-білками Багато G-білків діють шляхом відкриття або закриття іонних каналів, таким чином змінюючи електричні властивості плазматичної мембрани. Наприклад зниження частоти і сили серцевих скорочень під впливом ацетилхоліну відбувається завдяки тому, що мускариновий ацетилхоліновий рецептор після активації взаємодіє із Gi-білком, α-субодиниця якого пригнічує діяльність аденілатциклази, в той час як βγ-комплекс відкриває калієві канали у плазматичній мембрані клітин серцевого м'яза, через що їхня збудливість зменшується. Інші G-білки регулюють активність іонних каналів опосередковано: наприклад рецептори зору та нюху діють через G-білки, які впливають на синтез циклічних нуклеотидів, що у свою чергу закривають або відкривають іонні канали (іонні канали керовані циклічними нуклеотидами). Наприклад, всі нюхові рецептори спряжені із Golf-білком, який активує аденілатциклазу; цАМФ, що синтезується, відкриває натрієві канали, що призводить до деполяризації мембрани і генерування нервового імпульсу (рецепторного потенціалу), який передається нейронам. У паличках сітківки ока людини світлочутливою молекулою є родопсин. Плазматична мембрана цих клітин містить велику кількість цГМФ-керованих катіонних каналів. За відсутності стимуляції світлом цитоплазма паличок містить високу кількість цГМФ, що утримує катіонні канали у відкритому стані. Внаслідок цього мембрана періодично деполяризується і відбувається синаптична передача імпульсів нейронам. Після активації світлом родопсин змінює конформацію і взаємодіє з G-білком трансдуцином (Gt). Після цього його α-субодиниця активує цГМФ-фосфодіестеразу, яка розщеплює цГМФ, внаслідок чого закриваються катіонні канали і синаптична передача припиняється. Саме зменшення частоти імпульсів, що надходять від світлочутливих клітин, сприймається мозком як відчуття світла.[2] Родини G-білківВсі гетеротримерні G-білки поділяють на чотири основні родини за амінокислотною послідовністю α-субодиниці:
Джерела
Посилання
|
|||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia
