|
РНК-содержащие вирусыРНК-содержащие вирусы — вирусы, геном которых представлен рибонуклеиновой кислотой[1]. Обычно она одноцепочечная (оцРНК), но может быть и двуцепочечной (дцРНК)[2]. Наиболее серьёзными заболеваниями человека, вызываемыми РНК-вирусами, являются геморрагическая лихорадка Эбола, ТОРС, COVID-19, бешенство, простуда, грипп, гепатит C, гепатит E, лихорадка Западного Нила, полиомиелит и корь. Международный комитет по таксономии вирусов (ICTV) относит РНК-вирусы к группам III, IV или V по системе классификации вирусов по Балтимору и не считает РНК-вирусы вирусами, имеющие промежуточную стадию жизненного цикла в виде ДНК[3]. Такие вирусы, с РНК в качестве генетического материала и имеющие промежуточную стадию жизненного цикла в виде ДНК в цикле репликации, названы ретровирусами, и выделены в группу VI классификация вирусов по Балтимору. Важные ретровирусы человека включают ВИЧ-1 и ВИЧ-2, вызывающих ВИЧ-инфекцию. Другим термином, явно исключающий группу ретровирусов из РНК-вирусов, является термин рибовирусы[4]. ХарактеристикиОдноцепочечные РНК-вирусы и смысловая РНКРНК-вирусы могут быть дополнительно классифицированы в соответствии с полярностью их РНК на одноцепочечные РНК-вирусы с отрицательной цепью[англ.] и одноцепочечные РНК-вирусы с положительной цепью[англ.], или РНК обеих типов[англ.] двухцепочечные РНК-вирусы[англ.]. Одноцепочечная (+)РНК, подобная мРНК и способная непосредственно транслироваться зараженной клеткой, называется смысловой. Антисмысловая (-)РНК вируса комплементарна мРНК и таким образом может быть превращена в (+)РНК действием РНК-зависимой РНК-полимеразой перед трансляцией. Очищенная РНК (+)РНК-содержащих вирусов сама по себе может напрямую вызывать инфекцию, хотя её инфекционность ниже, чем у полноценных вирусных частиц. Очищенная РНК (-)РНК-содержащих вирусов неинфекционна сама по себе, так как она должна транскрибироваться в (+)РНК; каждый вирион после транскрипции может быть источником нескольких смысловых цепей (+)РНК. Двухцепочечные (±)РНК вирусы напоминают (-)РНК-содержащие вирусы тем, что они также транслируют гены с отрицательной (некодирующей) цепи РНК[5]. Двуцепочечные РНК-вирусы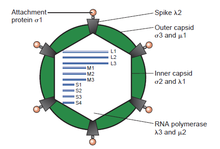 Двуцепочечные РНК-вирусы — разнообразная группа вирусов, отличающихся хозяевами (люди, животные, растения, грибы или бактерии), числом фрагментов генома (от 1 до 12 сегментов), и организацией вириона (формой капсида, количеством слоев капсида, выросты, шипы, и т. п.). Члены этой группы включают ротавирусы, всемирно известные как наиболее распространённая причина детских гастроэнтеритов, и пикорнавирусы, известный во всём мире как наиболее часто встречающийся вирус в фекалиях людей и животных с признаками диареи или без них. Вирус болезни синего языка[англ.] является экономически важным возбудителем болезни коз и овец. В прошлые годы, достигнут большой прогресс в определении атомной и субнанометровой структуры ряда ключевых вирусных белков и капсидов вирионов нескольких дцРНК-вирусов, подчёркивая существенные параллели в структуре и механизмах процессов репликации многих из этих вирусов[2]. Частота мутацийРНК-вирусы имеют очень высокую частоту мутаций по-сравнению с ДНК-вирусами[6], потому что вирусная РНК-зависимая РНК-полимераза не имеет способности (3'-5'-экзонуклеазной гидролитической активности) к коррекции ошибок, как ДНК-полимеразы[7]. Это одна из причин того, почему так трудно сделать эффективную вакцину для предотвращения болезней, вызываемых РНК-вирусами.[8] Ретровирусы также имеют высокую частоту мутаций, даже несмотря на то, что их промежуточная форма генома в виде ДНК интегрируется в геном хозяина (и, следовательно, после интеграции в геном, во время репликации, подвергается корректирующей проверке ДНК-полимеразой хозяина). Высокая частота мутаций обусловлена высокой частотой ошибок во время обратной транскрипции, до стадии интеграции в геном хозяина. Ошибки при этом встраиваются в обе цепи ДНК.[9] Некоторые гены РНК-вирусов важны для их репликации и мутации в них не допустимы. Например, участок генома вируса гепатита C, кодирующий коровый белок, высоко консервативен,[10] потому что он содержит структурную РНК, вовлеченную в образование участка внутренней посадки рибосомы.[11] РепликацияРНК-вирусы животных классифицированы по ICTV. Выделяют три различные группы РНК-вирусов в зависимости от структуры их генома и метода репликации:
Ретровирусы (группа VI) имеют одноцепочечный РНК-геном но, в общем, не относятся к РНК-вирусам потому что они используют промежуточную стадию в виде ДНК для репликации. Обратная транскриптаза, вирусный белок, поставляемый самим вирусом, после распаковки вирусной частицы конвертирует вирусную РНК в комплементарную цепь ДНК, которая после синтеза второй цепи ДНК превращается в двуцепочечную молекулу вирусной ДНК. После этого ДНК интегрируется в геном хозяина используя вирусный белок интегразу, экспрессия закодированных генов может приводить к формированию новых вирионов. КлассификацияОтчасти это связано с высокой частотой мутаций, которым подвергаются эти геномы. Классификация основана главным образом на типе генома (двухцепочечный, отрицательный или положительный одноцепочечный), а также количестве и организации генов. В настоящее время известно 5 порядков и 47 семейств РНК-вирусов. Есть также много неклассифицированных видов и родов. РНК-вирусам родственны вироиды и РНК-вирусы-сателлиты. Они не относятся к РНК-вирусам и описаны отдельно. Изучение нескольких тысяч РНК-вирусов показало существование по крайней мере пяти главных таксонов: Levivirus и родственные группы; супергруппа Picornavirus; супергруппа Alphavirus вместе с супергруппой Flavivirus; дцРНК-вирусы; и оц(-)РНК-вирусы[12]. Группа лентивирусов является предковой для всех оставшихся групп РНК-вирусов. Следующий большой водораздел пролегает между группой пикорнавирусов и остальными вирусами. Вирусы с дцРНК-геномом похоже эволюционировали от оц(+)РНК-вирусного предка, а оц(-)РНК-вирусы возникли внутри дцРНК-вирусов. Наиболее близкородственны (-)РНК-вирусам реовирусы. Одноцепочечные РНК-вирусы с положительной цепьюЭто самая большая группа РНК-вирусов[13] с 30 семействами. Предпринималась попытка сгруппировать их в более крупные порядки на основе анализа их РНК-зависимой РНК-полимеразы. На сегодняшний момент это предложение не получило широкого распространения из-за сомнений в пригодности использования одного гена для классификации клады. В предложенной классификации выделены три группы[14]:
Было предложено разделение альфа-подобной (Sindbis-подобной) супергруппы на основе нового домена, расположенного вблизи N-концов белков, участвующих в репликации вируса[15]. Предлагаемые две группы:
В будущем альфа-подобную (Sindbis-подобную) супергруппу можно будет разделить на три группы: Rubi-подобные, Tobamo-подобные, и Tymo-подобные вирусы[16]. Дополнительная работа позволила выявить пять групп РНК-вирусов с положительной цепью, содержащих 14 порядков с 31 семейством и 48 родов (из них 17 семейств с 30 родами относятся к вирусам растений)[17]. Этот анализ предполагает, что альфавирусы и флавивирусы могут быть разделены на два семейства — Togaviridae и Flaviridae, соответственно, — но выделение других таксономических единиц, таких как Pestiviruses, вирус гепатита C, Rubiviruses, вирус гепатита E и Arteriviruses, могут быть неверным. Коронавирусы и торовирусы, по-видимому, представляют собой отдельные семейства в разных порядках, а не отдельные роды того же семейства, как они классифицированы в настоящее время. Лютеовирусы, по-видимому, представляют собой два семейства, а не одно, а apple chlorotic leaf spot virus, по-видимому, является не Closterovirus, а новым родом Potexviridae.
Эволюция пикорнавирусов, основанная на анализе их РНК-полимераз и геликаз, по-видимому, на сегодняшний день ведет свое происхождение от супергруппы эукариот.[18]. Их предполагаемые предки включают бактериальные ретроэлементы группы II, семейство протеаз HtrA и ДНК-бактериофаги. Partitiviruses связаны и, возможно, произошли от предка тотивируса.[19] Гиповирусы и барнавирусы, по-видимому, имеют общую родословную с линиями потивирусов и собемовирусов соответственно.[19] Двуцепочечные РНК-вирусыАнализ также предполагает, что дцРНК-вирусы не связаны друг с другом, а вместо этого принадлежат к четырём дополнительным классам — Birnaviridae, Cystoviridae, Partitiviridae и Reoviridae — и одному дополнительному отряду (Totiviridae), одного из классов оц(+)РНК-вирусов и относятся к той же группе, что и РНК-вирусы с положительной цепью. Одно исследование показало, что существует две большие клады: одна включает семейства Caliciviridae, Flaviviridae и Picornaviridae, а вторая — семейства Alphatetraviridae, Birnaviridae и Cystoviridae, Nodaviridae и Permutotretraviridae.[20] Одноцепочечные РНК-вирусы с негативной цепьюЭти вирусы имеют сегментированный геном, начиная от одного до восьми сегментов РНК. Несмотря на их разнообразие, они, возможно, возникли у предка членистоногих и дивергировали вместе с ним.[21] Вирусы-сателлитыТакже известен ряд вирусов-сателлитов — вирусов, для завершения жизненного цикла которых требуется помощь другого вируса. Их таксономия ещё не согласована. Следующие четыре рода были предложены для сателлитных одноцепочечных РНК-вирусов со смысловой цепью, которые заражают растения: Albetovirus, Aumaivirus, Papanivirus и Virtovirus[22]. Семейство Sarthroviridae, включающее род Macronovirus — были предложены для сателлитных одноцепочечных РНК-вирусов со смысловой цепью, которые заражают членистоногих. Группа III — дцРНК-вирусыВ этой группе насчитывается двенадцать семейств, а также ряд неклассифицированных родов и видов[7].
Группа IV — оц(+)РНК-вирусыВ этой группе есть три порядка и 34 семейства. Кроме того, существует ряд неклассифицированных и родов.
Вирусы-сателлиты
Также был описан неклассифицированный астровирусный / гепевирусоподобный вирус.[24] Группа V— оц(-)РНК-вирусыЗа исключением гепатита D, эта группа вирусов была помещена в один тип — Negarnaviricota. Этот тип был разделен на два подтипа — Haploviricotina и Polyploviricotina. Внутри подтипа Haploviricotina в настоящее время признаются четыре класса: Chunqiuviricetes, Milneviricetes, Monjiviricetes и Yunchangviricetes. В подтипе Polyploviricotina выделяются два класса: Ellioviricetes и Insthoviricetes. В настоящее время в этой группе признано 6 классов, 7 порядков и 24 семейства. Чаксть вилов и родов еще не классифицированы.[7]
См. такжеПримечанияБольшинство вирусов, поражающих грибы, представляют собой двухцепочечные РНК-вирусы. Описано небольшое количество одноцепочечных РНК-вирусов с положительной цепью. В одном сообщении высказывается предположение о возможности заражения одноцепочечным вирусом с негативной цепью.[27]
Ссылки |
Portal di Ensiklopedia Dunia