|
Síndrome hepatorrenal
A síndrome hepatorrenal (SHR) é uma condição clínica grave, que consiste em uma rápida deterioração da função renal em pessoas com cirrose ou insuficiência hepática fulminante. A síndrome é geralmente fatal e o tratamento definitivo é feito com um transplante de fígado, ainda que vários métodos terapêuticos, como a diálise, possam impedir o avanço da doença. A SHR pode afetar indivíduos com cirrose (independentemente da causa) hepatite alcoólica grave, ou insuficiência hepática fulminante, e geralmente ocorre quando a função do fígado deteriora-se rapidamente por causa de uma lesão aguda, como uma infecção, hemorragia no tracto gastrointestinal, ou o uso excessivo de medicamentos diuréticos. A síndrome hepatorrenal é uma complicação relativamente comum da cirrose, ocorrendo em 18% dos cirróticos no prazo de um ano de seu diagnóstico, e em 39% dos cirróticos nos primeiros cinco anos.
Classificação A síndrome hepatorrenal é uma causa de insuficiência renal que acomete indivíduos com cirrose ou, mais raramente, com insuficiência hepática fulminante.[1] A síndrome envolve a constrição dos vasos sanguíneos dos rins e a dilatação dos vasos da circulação esplâncnica, que irriga os intestinos.[2] A classificação da síndrome hepatorrenal estabelece duas categorias de insuficiência renal, denominadas síndrome hepatorrenal dos tipos 1 e 2, ambas ocorrem em indivíduos com cirrose ou falência hepática fulminante. Nas duas categorias, a deterioração da função renal é quantificada por uma elevação do nível de creatinina no sangue ou pela diminuição de sua depuração na urina.[3] Síndrome hepatorrenal tipo 1A SHR tipo 1 é caracterizada por insuficiência renal rapidamente progressiva, com a duplicação da creatinina sérica para um nível superior a 221 mmol/L (2,5 mg/dL), ou uma redução de metade do clearance de creatinina, para um valor menor que 20 mL/min durante um período de menos de duas semanas. O prognóstico dos indivíduos com o tipo 1 da SHR é particularmente ruim, com uma taxa de mortalidade superior a 50% após um mês.[4] Os pacientes com este tipo de síndrome estão geralmente em mau estado geral, com pressão arterial baixa e podem necessitar de terapia com drogas para melhorar a força de contração do músculo cardíaco (inotrópicos) ou outros medicamentos para manter a pressão arterial em níveis adequados, chamados genericamente de vasopressores.[5] Síndrome hepatorrenal tipo 2Diferente da síndrome hepatorrenal do tipo 1, que tem uma evolução rápida, a do tipo 2 tem início e progressão bem mais lentos. Ela é definida por um aumento no nível de creatinina sérica em mais de 133 mmol/L (1,5 mg/dL) ou por uma depuração de creatinina inferior a 40 mL/min, e um sódio urinário menor que 10 mmol/L.[6] Ela também possui um prognóstico pobre, com uma sobrevida média de cerca de seis meses, a menos que seja feito um transplante de fígado no indivíduo afetado. A SHR do tipo 2 parece fazer parte de um espectro de doenças associadas com o aumento da pressão na circulação da veia porta, que se manifesta clinicamente com o acúmulo de líquido no abdome, a ascite. O espectro continua com uma ascite refratária a diuréticos, quando os rins não mais conseguem excretar sódio suficiente para eliminar líquido mesmo com o uso de medicamentos diuréticos. Muitos pacientes com a SHR do tipo 2 tem uma ascite com essas características antes de desenvolverem a deterioração da função renal.[7] Sinais e sintomasOs dois tipos da síndrome hepatorrenal partilham três fenômenos principais: função do fígado alterada, anormalidades na circulação e insuficiência renal. Já que esses fenômenos não produzem de fato sintomas até o fim do curso da doença, os indivíduos que sofrem com esta síndrome geralmente são diagnosticados com base em exames laboratoriais alterados. A maioria das pessoas que desenvolvem SHR têm cirrose e por isso podem ter os mesmos sinais e sintomas desta doença, como icterícia, alteração do estado mental, nutrição prejudicada e a presença de ascite.[2] Especificamente, o surgimento de ascite, que é resistente ao uso de medicamentos diuréticos, é característica do tipo 2 de SHR. A oligúria, que significa uma diminuição no volume de urina, pode ocorrer como consequência da insuficiência renal. Todavia, alguns indivíduos com SHR continuam a produzir urina normalmente.[3] Como estes sintomas podem não aparecer, não são incluídos como critérios maiores ou menores para o diagnóstico desta condição. Invés disso, a doença é diagnosticada no indivíduo a partir de resultados de testes laboratoriais para a exclusão de outras causas.[3] Causas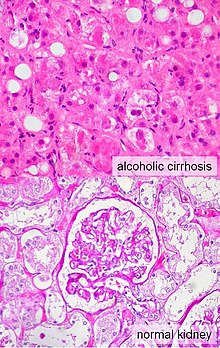 A síndrome hepatorrenal geralmente afeta indivíduos com cirrose e hipertensão na veia porta e suas tributárias (hipertensão portal). Embora a SHR possa ser uma complicação de qualquer tipo de cirrose, ela é mais comum em indivíduos com cirrose alcoólica, principalmente se houver hepatite alcoólica concomitante identificável em biópsia.[8] Pode também ocorrer em indivíduos sem cirrose, mas com insuficiência hepática de início agudo, a chamada insuficiência hepática fulminante.[3][8] Certos fatores precipitantes da SHR foram identificados em pessoas vulneráveis com cirrose ou insuficiência hepática fulminante. Estes incluem infecção bacteriana, hepatite alcoólica aguda e sangramento no trato gastrointestinal superior, sendo a peritonite bacteriana espontânea o fator mais comum em pacientes com cirrose. A SHR pode também ser desencadeada por tratamentos de complicações de doenças hepáticas: os fatores iatrogênicos da síndrome incluem o uso agressivo de diuréticos e a remoção de grandes volumes de fluido ascítico por paracentese da cavidade abdominal sem compensar a perda de fluido por reposição intravenosa.[8] Ao contrário da crença popular é a maioria das pessoas com cirrose não são os alcoólatras, e sim os portadores de hepatite C. Outras causas comuns são a hepatite B, medicações tóxicas ao fígado, hepatite autoimune, esteato-hepatite não alcoólica, cirrose biliar, colangite esclerosante, hemocromatose e doença de Wilson. Há outras causas mais raras, mas cerca de 30% dos cirróticos são por causas desconhecidas (idiopáticas).[9] DiagnósticoPode haver muitas causas de insuficiência renal em indivíduos com cirrose ou insuficiência hepática fulminante. Por conta disso, é um desafio para os médicos distinguirem a síndrome hepatorrenal de outras entidades que causam insuficiência renal no contexto de doença hepática avançada. Como resultado, critérios maiores e menores foram desenvolvidos para auxiliar no diagnóstico da síndrome hepatorrenal.[3] Os critérios maiores incluem a doença de fígado aguda ou crônica, com hipertensão portal; insuficiência renal; ausência de choque, infecção, tratamento recente com medicamentos que afetam a função renal (nefrotoxinas) e perdas de fluido; ausência de melhora sustentada da função renal apesar do tratamento com 1,5 litros de solução intravenosa salina; ausência de proteinúria (proteína na urina); e, ausência de doença renal ou obstrução ao fluxo renal visto numa ultrassonografia.[3] Os critérios menores são os seguintes: volume urinário baixo (inferior a 500 mL por dia), baixa concentração de sódio na urina (<10 mEq/L), osmolaridade urinária maior que a do sangue, ausência de hemácias na urina e uma concentração de sódio sérico inferior a 130 mmol/L.[3] Muitas outras doenças do rim são associadas com doença hepática e devem ser excluídas antes de se fechar um diagnóstico de síndrome hepatorrenal. Indivíduos com insuficiência renal do tipo pré-renal não têm danos aos rins, mas assim como em indivíduos com SHR, há uma disfunção renal devido à diminuição do fluxo sanguíneo para o órgão. Além disso, à semelhança da SHR, a insuficiência renal pré-renal provoca a formação de uma urina com uma concentração de sódio muito baixa. Em contraste com a SHR, no entanto, este tipo de insuficiência geralmente responde ao tratamento com fluidos intravenosos, resultando em uma redução da creatinina sérica e aumento da excreção de sódio.[3] A necrose tubular aguda (NTA) envolve danos aos túbulos renais, e pode ser uma complicação em indivíduos com cirrose, por causa da exposição à medicação tóxica ou o desenvolvimento de diminuição da pressão arterial. Por causa dos danos aos túbulos, os rins afetados pela NTA geralmente são incapazes de reabsorver o máximo de sódio na urina. Como resultado, a NTA pode ser distinguida da SHR, com base em exames laboratoriais, os indivíduos com NTA terão medidas de sódio na urina que muito mais elevadas do que os com SHR, no entanto, isso pode não ser sempre o caso em pacientes cirróticos.[5] Os indivíduos com NTA também podem apresentar cilindros hialinos ou pardos vistos na microscopia da urina, enquanto que a urina de indivíduos com SHR é normalmente desprovida desse tipo de material, já que os rins não foram diretamente lesados.[3] Algumas infecções virais que acometem o fígado, incluindo a hepatite B e a hepatite C também pode levar à inflamação do glomérulo do rim.[10][11] Outras causas de insuficiência renal em indivíduos com doença hepática incluem a toxicidade a drogas (principalmente ao antibiótico gentamicina) e a nefropatia por contraste, causada pela administração intravenosa de contraste usados em exames de imagens.[3] FisiopatologiaA insuficiência renal na síndrome hepatorrenal é causada pela perda do tônus adequado nos vasos sanguíneos dos rins.[2] A teoria mais aceita (denominada teoria underfill) estabelece que os vasos sanguíneos da circulação renal sofrem constricção devido à dilatação dos vasos sanguíneos da circulação esplâncnica (que irriga os intestinos), que, por sua vez, é mediada por fatores liberados pela doença hepática.[4][12] O óxido nítrico, prostaglandinas e outras substâncias vasoativas tem sido apontados como poderosos mediadores de vasodilatação esplâncnica na cirrose.[2][13][14] A consequência direta desse fenômeno é a diminuição no volume efetivo de sangue detectado pelo aparelho justaglomerular do rim, levando à secreção de renina e ativação do sistema renina-angiotensina, o que resulta em vasoconstrição dos vasos sistêmicos e, especificamente, dos vasos renais.[2] No entanto, este efeito é insuficiente para neutralizar a ação dos mediadores de vasodilatação da circulação esplâncnica, levando a um persistente "underfilling" da circulação renal e piora da vasoconstrição nesse órgão, levando à insuficiência renal.[12] Estudos para quantificar essa teoria tem demonstrado que há uma diminuição geral da resistência vascular sistêmica na síndrome hepatorrenal, mas as medidas das frações femoral e renal do débito cardíaco estão, respectivamente, aumentadas e reduzidas, sugerindo que a vasodilatação esplâncnica está implicada na insuficiência renal.[15] Muitas substâncias vasoativas têm sido propostas como estando envolvidas na mediação das alterações sistêmicas hemodinâmicas, incluindo o peptídeo natriurético atrial, a prostaciclina, o tromboxano A2 e as endotoxinas.[16][17][4] Além disso, foi observado que a administração de medicamentos para combater a vasodilatação esplâncnica (como ornipressina, terlipressina e octreotida) conduz a uma melhoria na taxa de filtração glomerular (que é uma medida quantitativa da função renal) em pacientes com síndrome hepatorrenal, fornecendo novas evidências de que a vasodilatação esplâncnica é uma etapa fundamental da sua patogênese.[16][18][19] A teoria underfill envolve a ativação do sistema renina-angiotensina-aldosterona, que leva a um aumento na absorção de sódio no túbulo renal (denominada avidez renal de sódio), mediada pela aldosterona, que atua em receptores de mineralocorticóides no túbulo contorcido distal.[7][12] Acredita-se que este seja um passo fundamental na patogênese da ascite em pacientes cirróticos. Há a hipótese de que a progressão da ascite a síndrome hepatorrenal é um espectro, onde a vasodilatação esplâncnica define tanto a resistência da ascite a diuréticos (que é comumente visto na SHR tipo 2) e o início da vasoconstrição renal (como descrito acima), levando à síndrome hepatorrenal.[7] PrevençãoO risco de morte na síndrome hepatorrenal é bastante elevado e, devido a isto, há uma ênfase significativa na identificação de pacientes que estão suscetíveis, além da prevenção de fatores que contribuem para o surgimento da síndrome. Como a infecção (peritonite bacteriana espontânea, especificamente) e a hemorragia gastrointestinal são complicações para indivíduos com cirrose, sendo causas comuns para a síndrome, cuidados específicos são aplicados na identificação e também no tratamento precoce de pacientes cirróticos com essas complicações para evitar a síndrome.[5] Alguns dos fatores de risco para a SHR são induzidos pelo tratamento da ascite e podem ser prevenidos. O uso indiscriminado de diuréticos deve ser evitado. Além disso, muitos medicamentos que são usados para tratar as complicações da cirrose (como alguns antibióticos), além de outras condições, podem causar uma diminuição significativa da função renal no paciente cirrótico e levar à síndrome hepatorrenal.[4][5] Paracenteses de volumes significativos - procedimento para a drenagem do líquido de ascite do abdômen com uma agulha ou cateter com a finalidade de aliviar o desconforto - pode causar alteração na hemodinâmica de maneira significativa a ponto de desencadear a síndrome hepatorrenal, devendo ser evitada em indivíduos em risco. A infusão concomitante de albumina pode prevenir a disfunção circulatória que ocorre após a paracentese de grande volume, diminuindo assim o risco de desencadear a síndrome.[20] Porém, em indivíduos com ascite tensa (ou refratária), foi levantada a hipótese que a remoção do líquido ascítico pode melhorar a função renal reduzindo o aporte sobre as veias renais.[21] Os indivíduos com ascite que já foram espontaneamente infectados (peritonite bacteriana espontânea) têm um risco particularmente elevado para o desenvolvimento da síndrome.[2] Um ensaio clínico randomizado em indivíduos com peritonite bacteriana espontânea constatou que a administração intravenosa de albumina na data da admissão e no terceiro dia de internação hospitalar reduziu a taxa de insuficiência renal e a taxa de mortalidade.[22] TratamentoTransplante de fígado O tratamento definitivo para a síndrome hepatorrenal é o transplante hepático, e todas as outras terapias podem ser melhor descritas como uma ponte para o transplante.[1][24] Embora o transplante de fígado é de longe a melhor opção de tratamento disponível para o HRS, a mortalidade foi identificada como preocupantes 25% no primeiro mês após o transplante.[25] Maior disfunção hepática (escores acima de 36 em um teste sobre doenças hepáticas terminais conhecido como escala MELD) revelaram ter o maior risco de mortalidade precoce após transplante de fígado.[25] Em vários estudos a deterioração da função renal continuou mesmo após o transplante hepático, porém, ela foi transitória e provavelmente foi devido ao uso de medicamentos com toxicidade para os rins e, especificamente, a introdução de imunossupressores como tacrolimus e ciclosporina que tem como efeito colateral a deterioração da função renal.[2] A longo prazo, no entanto, quase todos os indivíduos com HRS que fazem o transplante de fígado recuperam a função renal e estudos mostram que as taxas de sobrevivência de três anos são semelhantes aos dos que receberam transplantes de fígado por outros motivos.[1][2] Durante a espera pelo transplante hepático (que geralmente demora muito tempo), várias outras estratégias têm se revelado benéficas na preservação da função renal. Essas estratégias incluem o uso de infusão intravenosa de albumina, medicamentos com efeitos análogos de vasopressina (que provocam vasoconstrição esplâncnica), 'Shunts' radiológicos para diminuir a pressão na veia porta hepática, diálise, e um sistema de diálise especializada nas membranas receptoras de albumina denominada sistema de recirculação molecular adsorvente (Molecular Adsorbents Recirculating System ou MARS) ou diálise de fígado.[2] Tratamento medicamentosoMuitos estudos mostraram uma melhora na função renal em pacientes com síndrome hepatorrenal envolvidos na expansão do volume do plasma com uso de albumina administrada por via intravenosa. A quantidade de albumina administrada por via intravenosa, varia: um esquema já é de 1 g de albumina por kg de peso corporal por via intravenosa no primeiro dia, seguido por 20 a 40 g por dia. Notavelmente, os estudos mostraram que o tratamento com albumina por si só é inferior ao tratamento com outros medicamentos em conjunto com albumina; a maioria dos estudos avaliando terapias pré-transplante para SHR envolvem o uso de albumina em conjunto com tratamentos médicos ou outros procedimentos. Midodrina é um alfa-agonista e a octreotida é um análogo da somatostatina, um hormônio envolvido na regulação do tônus dos vasos sanguíneos do trato gastrointestinal. Os medicamentos são, respectivamente, vasoconstritores sistêmicos e inibidores da vasodilatação esplâncnica, e não foram encontrados para ser útil quando utilizado individualmente no tratamento da síndrome hepatorrenal. Entretanto, um estudo envolvendo 13 pacientes com síndrome hepatorrenal obteve como resultado a melhora significativa da função renal, quando os dois foram usados em conjunto (com midodrina administrado por via oral, a octreotida administrada por via subcutânea e ambos dosados de acordo com a pressão arterial), com os três sobreviventes. Outro estudo, observacional, não randomizado, de indivíduos com SHR tratados com octreotida subcutânea e midodrina oral mostrou que houve aumento da sobrevida em 30 dias. A ornipressina análoga da vasopressina foi encontrado em uma série de estudos para ser útil na melhora da função renal em pacientes com síndrome hepatorrenal, mas seu uso tem sido limitado, pois pode causar isquemia severa para os principais órgãos. Terlipressina é um análogo da vasopressina que foi testado em um grande estudo para ser útil para melhorar a função renal em pacientes com síndrome hepatorrenal com uma menor incidência de isquemia. Outros fármacos que foram investigados para o uso no tratamento da síndrome hepatorrenal incluem a pentoxifilina, a acetilcisteína e o misoprostol.[1][26][27][28] O nível de evidência de todas estas terapias é baseado em série de casos, exceto no caso da pentoxifilina, extrapolado para um subgrupo de pacientes tratados para hepatite alcoólica.[1] Procedimentos terapêuticosUma derivação portossistêmica intra hepática transjugular (TIPS) envolve a descompressão das altas pressões na circulação portal pela colocação de um pequeno stent entre a veia porta e uma veia hepática. Isto é feito através de exame radiológico guiado por cateter que são passados para a veia hepática através da veia jugular interna ou a veia femoral. Teoricamente, acredita-se que uma diminuição na pressão portal ajude a reverter os fenômenos hemodinâmicos que conduzem ao desenvolvimento da síndrome hepatorrenal. O uso do TIPS vem sendo advogado para melhorar a função renal em pacientes com síndrome hepatorrenal.[7][29][30] As complicações do TIPS no tratamento da HRS incluem o agravamento da encefalopatia hepática (como o procedimento envolve a criação forçada de um shunt porto-sistêmico, efetivamente ignorando a capacidade do fígado de depurar toxinas), incapacidade de alcançar uma redução adequada da pressão portal, e sangramento.[7][29] A diálise do fígado envolve a diálise extracorpórea para remover as toxinas da circulação, normalmente por meio da adição de um segundo circuito de diálise que contém uma membrana ligada à albumina. O sistema de recirculação de adsorventes moleculares (MARS), mostrou alguma utilidade como uma ponte para o transplante em pacientes com síndrome hepatorrenal, mas a técnica é ainda incipiente.[7][31] A terapia de substituição renal pode ser necessária para otimizar os indivíduos com síndrome hepatorrenal para um transplante de fígado, embora a condição do paciente pode ditar qual a modalidade a ser utilizada.[32] O uso de diálise, no entanto, não leva à recuperação ou preservação da função renal em pacientes com SHR, e é utiliza-la somente para evitar as complicações da insuficiência renal até que o transplante possa ocorrer. Em pessoas que se submetem à hemodiálise, pode até haver um aumento na mortalidade devido à hipotensão arterial em pacientes com SHR, embora novos estudos ainda precisem ser realizados. Como resultado, o papel da terapia de substituição renal em pacientes com SHR permanece obscuro.[2] EpidemiologiaComo a maioria dos indivíduos com síndrome hepatorrenal tem cirrose, muitos dos dados sobre a SHR vêm da população cirrótica. A condição é bem comum: aproximadamente 10% dos indivíduos que deram entrada em um hospital com ascite tinham SHR.[8] Uma série de casos retrospectiva de pacientes com cirrose tratados com terlipressina sugeriu que 20% das insuficiências renais agudas em cirróticos foram causadas pela SHR tipo 1, e 6,6% pela SHR tipo 2.[18] Estima-se que 18% dos indivíduos com cirrose e ascite irão desenvolver a SHR dentro de um ano de seu diagnóstico no caso da cirrose e 39% destes indivíduos irão desenvolvê-la no intervalo de cinco anos a partir do diagnóstico.[8] Três fatores de risco independentes para o desenvolvimento da SHR em cirróticos já foram identificados: tamanho do fígado, atividade de renina plasmática e a concentração sérica de sódio.[8] O prognóstico para estes pacientes é sombrio, e os que não recebem nenhum tratamento tem uma sobrevida extremamente curta.[4][8][24] A gravidade da doença hepática (como a evidenciada pela pontuação na escala MELD) já se mostrou ser um determinante do resultado final.[25][33] Alguns pacientes sem cirrose desenvolvem SHR, com uma incidência de cerca de 20% aferida em um estudo com pacientes afligidos por hepatite alcoólica.[26] HistóriaAs primeiras observações sobre falência renal, ocorridas em indivíduos com doenças hepáticas crônicas, datam do fim do século XIX e foram feitas por Frerichs e Flint.[8] Entretanto, a síndrome hepatorrenal foi primeiro definida como sendo uma insuficiência renal aguda, ocorrida no âmbito da cirurgia biliar.[1][34] A síndrome foi logo reassociada com doença hepática avançada e,[24] em 1950, foi clinicamente definida por Sherlock, Hecker, Papper e Vessin como ligada à alterações hemodinâmicas sistêmicas e alta mortalidade.[8][35] Hecker e Sherlock, especificamente, identificaram que indivíduos com HRS tinham débito urinário baixo, teor de sódio muito baixo na urina e nenhuma proteína nela.[1] Murray Epstein foi o primeiro a caracterizar vasodilatação esplâncnica e vasoconstrição renal como as principais alterações nahemodinâmica de pacientes com a síndrome.[36] A natureza funcional da insuficiência renal no HRS foi cristalizada por estudos demonstrando que rins transplantados de pacientes com síndrome hepatorrenal voltavam a funcionar no novo hospedeiro, levando à hipótese de que a síndrome hepatorrenal é uma condição sistêmica e não uma doença renal.[37] A primeira tentativa sistemática de definir a síndrome hepatorrenal foi feita em 1994, pelo International Ascites Club, um grupo de especialista em fígado. A história mais recente da HRS inclui a descoberta de vários mediadores vasoativos que causam as alterações no fluxo de sangue esplâncnico e renal, típicos da doença.[8] Referências
Bibliografia
|
||||||||||||||||||||||||
