|
Esquistossomose
A esquistossomose, também conhecida como barriga d'água, xistose,[2] febre do caramujo ou bilharzíaze,[3][4] é uma doença causada pelos platelmintos do gênero Schistosoma. O trato urinário e/ou intestinos podem ser infectados. A doença é transmitida por contato com água doce contaminada com parasitas, que são liberados a partir de caracóis infectados de água doce. A doença é especialmente comum entre as crianças em países em desenvolvimento como elas são mais propensas a brincar na água contaminada. Outros grupos de alto risco incluem: agricultores, pescadores ou pessoas que utilizam a água suja para uso diário.[1] Ela pertence ao grupo de infecções helmínticas[5] e o diagnóstico é através da identificação de ovos do parasita, na urina ou fezes da pessoa. Também pode ser confirmada pela identificação de anticorpos contra a doença no sangue.[1] Métodos de prevenção da doença incluem a melhoria do acesso a água potável e a redução do número de caracóis. Em áreas onde a doença é comum, o medicamento praziquantel pode ser dado uma vez por ano, para todo o grupo. Isto é feito para diminuir o número de pessoas infectadas e, consequentemente, a propagação da doença. O praziquantel também é o tratamento recomendado pela Organização Mundial de Saúde (OMS) para aqueles que estão infectados.[1] A esquistossomose afetou cerca de 252 milhões de pessoas em todo o mundo em 2015. Estima-se que 4.400 a 200.000 pessoas morrem a cada ano.[6] A doença é mais comum na África, bem como a Ásia e a América do Sul.[1] Em torno de 700 milhões de pessoas, em mais de 70 países, vivem em áreas onde a doença é comum.[7] Em países tropicais, a esquistossomose é segunda apenas para a malária entre doenças parasitárias com o maior impacto económico.[8] Está listada como uma doença tropical negligenciada.[9] Sinais e sintomas  Muitos indivíduos não apresentam sintomas. Se os sintomas aparecerem, eles geralmente levam de 4 a 6 semanas a partir do momento da infecção. O primeiro sintoma da doença pode ser uma sensação de mal-estar geral]. Dentro de 12 horas após a infecção, a pessoa pode reclamar de uma sensação de formigamento ou leve erupção cutânea, comumente referido como "coceira do nadador", devido à irritação no ponto de entrada. A erupção que pode se desenvolver pode simular sarna e outros tipos de erupções cutâneas. Outros sintomas podem ocorrer 2 a 10 semanas depois e podem incluir febre, dor, tosse, diarreia, calafrios ou aumento da glândula. Esses sintomas também podem estar relacionados à esquistossomose aviária, que não causa mais sintomas em humanos.[10] As manifestações da infecção esquistossomótica variam ao longo do tempo à medida que as cercárias e, posteriormente, os vermes adultos e seus ovos migram pelo corpo.[11] Se os ovos migrarem para o cérebro ou medula espinhal, podem ocorrer convulsões, paralisia ou inflamação da medula espinhal.[12] Aqueles que foram infectados por um longo tempo podem apresentar dano hepático, insuficiência renal, infertilidade ou câncer de bexiga.[1] Em crianças, pode causar baixo crescimento e dificuldade de aprendizagem.[1] Esquistossomose agudaDermatite cercáriaA primeira reação potencial é uma erupção pruriginosa, maculopapular que resulta da penetração de cercárias na pele nas primeiras 12 horas a dias após a penetração da cercária na pele.[13][14] A primeira vez que uma pessoa não sensibilizada é exposta, as erupções são geralmente leves com uma sensação de formigamento associada que desaparece rapidamente por conta própria, pois esse é um tipo de reação de hipersensibilidade. Em pessoas sensibilizadas que foram previamente infectadas, a erupção cutânea pode se desenvolver em lesões elevadas, pruriginosas e vermelhas (pápula), algumas se transformando em lesões cheias de líquido (vesículas).[14] Infecções prévias com cercárias causam um desenvolvimento mais rápido e pior apresentação da dermatite devido à resposta imune mais forte.[15] The round bumps are usually one to three centimeters across.[16] Como as pessoas que vivem nas áreas afetadas foram frequentemente expostas repetidamente, as reações agudas são mais comuns em turistas e migrantes.[17] A erupção pode ocorrer entre as primeiras horas e uma semana após a exposição, e normalmente desaparece por conta própria em cerca de 7 a 10 dias.[14][16] Para a esquistossomose humana, um tipo semelhante de dermatite chamado "coceira do nadador" também pode ser causado por cercárias de animais trematódeos que freqüentemente infectam pássaros.[11][14][18] A dermatite cercariana não é contagiosa e não pode ser transmitida de pessoa para pessoa.[19] Os sintomas podem incluir:[14][19]
Coçar a erupção cutânea pode levar a uma infecção bacteriana secundária da pele, por isso é importante evitar coçar. Alguns tratamentos comuns para a coceira incluem creme corticosteroide, loção anti-coceira e aplicação de compressas frias a erupções cutâneas, tomar banho com sais de Epsom ou bicarbonato de sódio e, em casos de coceira intensa, cremes e loções fortes prescritos, anti-histamínicos orais também podem ajudar a aliviar a coceira.[14][19] Esquistossomose aguda (febre de Katayama)A esquistossomose aguda (febre de Katayama) pode ocorrer semanas ou meses (cerca de 2 a 8 semanas)[20] após a infecção inicial como uma reação sistêmica contra a migração dos esquistossômulos conforme eles passam pela corrente sanguínea através dos pulmões para o fígado e também contra os antígenos dos ovos.[11] Da mesma forma que a coceira do nadador, a febre de Katayama é mais comumente visto em pessoas com sua primeira infecção, como migrantes e turistas, e está associado a infecções pesadas.[21] É visto, no entanto, em residentes nativos da China infectados com S. japonicum.[22] S. japonicum pode causar esquistossomose aguda em população cronicamente infectada e pode levar a uma forma mais grave de esquistossomose aguda.[14] Os sintomas podem incluir:[20][21]
A esquistossomose aguda geralmente se resolve em 2 a 8 semanas na maioria dos casos,[20] mas uma pequena proporção de pessoas apresenta perda de peso persistente, diarreia, dor abdominal difusa e erupção cutânea.[11] As complicações podem incluir:
Infecção crônicaNa doença de longa data, os vermes adultos põem ovos que podem causar reações inflamatória. Os ovos secretam proteolítico e enzimas que os ajudam a migrar para a bexiga e os intestinos para serem eliminados. As enzimas também causam uma reação inflamatória eosinofílica quando os ovos ficam presos nos tecidos ou embolizam para o fígado, baço, pulmões ou cérebro.[11] As manifestações de longo prazo são dependentes da espécie de esquistossomo, pois os vermes adultos de diferentes espécies migram para diferentes áreas.[23] Muitas infecções são levemente sintomáticas, sendo anemia e desnutrição comuns em áreas endêmicas.[24] Esquistossomose intestinalOs vermes de S. mansoni e S. japonicum migram para as veias do trato gastrointestinal e fígado.[18] Ovos na parede do intestino podem causar dor, sangue nas fezes e diarréia (especialmente em crianças).[18] A doença grave pode levar ao estreitamento do cólon ou reto.[16] Na esquistossomose intestinal, os ovos ficam alojados na parede intestinal durante sua migração das vênulas mesentéricas para o lúmen intestinal, e os ovos aprisionados causam uma reação do sistema imunológico chamada reação granulomatosa.[25] Eles afetam principalmente o intestino grosso e o reto, e o envolvimento do intestino delgado é mais raro.[14] Essa resposta imune pode levar à obstrução do cólon e à perda de sangue. O indivíduo infectado pode ter o que parece ser uma barriga. Existe uma forte correlação entre a morbidade da esquistossomose intestinal e a intensidade da infecção.[14] Em casos de infecções leves, os sintomas podem ser leves e passar despercebidos.[21] As espécies mais comuns de causar esquistossomose intestinal são S. mansoni e S. japonicum, porém, S. mekongi e S. intercalatum também pode causar esta doença.[21] Os sintomas podem incluir:[14]
As complicações podem incluir:
Aproximadamente 10-50% das pessoas que vivem em regiões endêmicas de S. mansoni e S. japonicum desenvolve esquistossomose intestinal.[14] S. mansoni sobrepõe-se epidemiologicamente com alta prevalência de HIV na África Subsaariana, onde a esquistossomose gastrointestinal tem sido associada ao aumento da transmissão do HIV.[27] Esquistossomose hepatoesplênica Os ovos também migram para o fígado, causando fibrose em 4 a 8% das pessoas com infecção crônica, principalmente aquelas com infecção grave de longa duração.[18] Os ovos podem ficar alojados no fígado,[25] levando a hipertensão portal, esplenomegalia, acúmulo de líquido no abdômen e risco de vida potencial dilatações ou áreas inchadas no esôfago ou trato gastrointestinal que podem rasgar e sangrar profusamente (varizes esofágicas). Esta condição pode ser dividida em duas fases distintas: esquistossomose hepática inflamatória (reação inflamatória precoce) e esquistossomose hepática crônica. As espécies mais comuns que causam esta condição são S. mansoni, S. japonicum, e S. mekongi.
Esquistossomose pulmonarA hipertensão portal secundária à esquistossomose hepatoesplênica pode causar conexões de vasos entre a circulação portal (fígado e intestino) e a circulação sistêmica, o que cria um caminho para os ovos e vermes viajarem para os pulmões.[14] Os ovos podem se depositar ao redor dos leitos capilares alveolares e causar inflamação granulomatosa das arteríolas pulmonares, seguida de fibrose.[14] Isso leva à hipertensão arterial no sistema circulatório pulmonar (hipertensão pulmonar ), aumento da pressão no coração direito, dilatação da artéria pulmonar e do átrio direito e espessamento da parede ventricular direita.[14] Os sintomas de hipertensão pulmonar podem incluir:
Esquistossomose urogenital Os vermes de S. haematobium migram para as veias ao redor da bexiga e ureter onde se reproduzem.[23][29] O S. haematobium pode produzir até 3.000 ovos por dia, esses ovos migram das veias para a bexiga e os lúmens do ureter, mas até 50% deles podem ficar presos nos tecidos circundantes, causando inflamação granulomatosa, formação de pólipos e ulceração da bexiga, do ureter e tecidos do trato genital.[14][29] Isso pode levar a sangue na urina 10 a 12 semanas após a infecção.[11][16] Com o tempo, fibrose pode levar à obstrução do trato urinário, hidronefrose e insuficiência renal.[11][16] Câncer de bexiga o diagnóstico e a mortalidade geralmente são elevados nas áreas afetadas; os esforços para controlar a esquistossomose no Egito levaram a uma diminuição na taxa de câncer de bexiga.[16][30] O risco de câncer de bexiga parece ser especialmente alto em fumantes do sexo masculino, talvez devido à irritação crônica do revestimento da bexiga, permitindo que ela seja exposta a cancerígenos do fumo.[18][23] Nas mulheres, a doença geniturinária também pode incluir lesões genitais que podem levar ao aumento das taxas de transmissão do HIV.[16][27][31] Se as lesões envolverem as trompas de falópio ou os ovários, podem levar à infertilidade, se os órgãos reprodutivos masculinos forem afetados, pode haver sangue no esperma.[14] Os sintomas urinários podem incluir:[14]
Os sintomas genitais podem incluir:
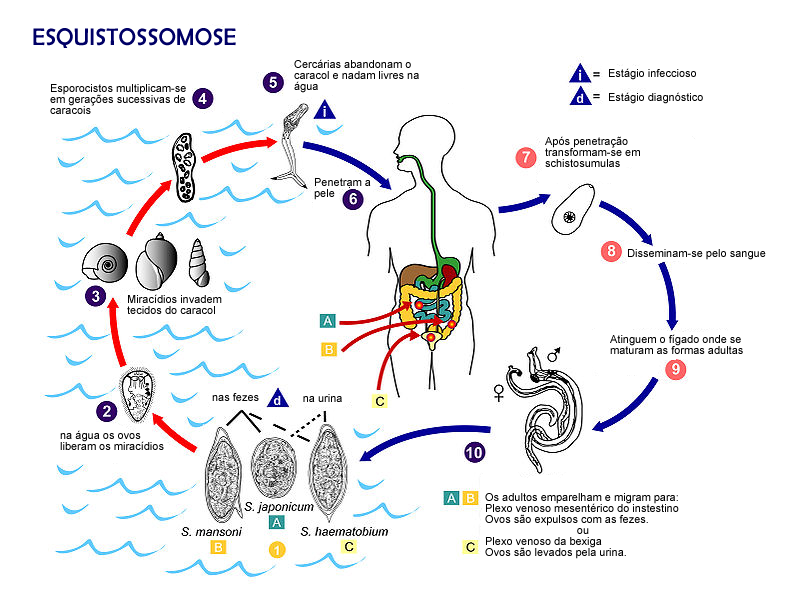
A função renal não é afetada em muitos casos, e as lesões são reversíveis com o tratamento adequado para eliminar os vermes.[14] NeuroesquistossomoseA complicação ectópica da esquistossomose, conhecida como neuroesquistossomose, tem sido cada vez mais relatada na literatura médica devido à sua incidência que varia de 0,4% a 3% entre pacientes com esquistossomose. No Brasil, onde há cerca de 16 milhões de esquistossomóticos, a ocorrência desse distúrbio neurológico é particularmente relevante. A apresentação clínica da neuroesquistossomose mansônica é variável e depende do estágio de evolução da esquistossomose.[32] O ciclo da esquistossomose
DiagnósticoNas análises sanguíneas há eosinofilia (aumento dos eosinófilos, células do sistema imunitário antiparasitas). Estes quadros só ocorrem secundariamente à hipersensibilidade ao parasita, sendo uma doença mais comum em pacientes moradores de áreas não endêmicas que se expõem a coleções hídricas contaminadas. Estes quadros duram em geral alguns dias, mas podem durar até meses e em casos raros podem ser fatais. Estes pacientes apresentam grandes granulomas periovulares necrótico-exsudativos dispersos pelos intestinos, fígado e outros órgãos. Estes sintomas podem ceder espontaneamente ou podem nem sequer surgir, mas a doença crônica silenciosa. Os ovos podem ser encontrados no exame parasitológico de fezes, mas nas infecções recentes o exame apresenta baixa sensibilidade. Para aumentar a sensibilidade podem ser usados de coproscopia qualitativa, como Hoffman ou quantitativo, como Kato-Katz. A eficácia com três amostras chega apenas a 75%. O hemograma demonstra leucopenia, anemia e plaquetopenia. Ocorrem alterações das provas de função hepática, com aumento de TGO, TGP e fosfatase alcalina. Embora crie a hipertensão portal, classicamente a esquistossomose preserva a função hepática. Assim, os critérios de Child-Pught, úteis no cirrótico, nem sempre funcionam no esquistossomótico que não tem associado hepatite viral ou alcoólica. A ultrassonografia em mãos experientes pode fazer o diagnóstico, sendo patognomônico a fibrose e espessamento periportal, hipertrofia do lobo hepático esquerdo e aumento do calibre da mesentérica superior.[33] A biopsia retal é uma técnica também utilizável, tendo uma sensibilidade de 80%. PrevençãoSaneamento básico com esgotos e água tratada. Controle dos caramujos que são hospedeiros intermediários da doença. Proteção dos pés e pernas com botas de borracha com solado antiderrapante. Informar a população das medidas profiláticas da doença. Evitar entrar em contato com água que contenha cercárias. A Educação em saúde é fundamental para o controle da doença. No entanto deve ser pensada em conjunto com a população local para que tenha um impacto sustentável ao longo do tempo. Em junho de 2012, a Fundação Oswaldo Cruz anunciou a criação de uma vacina contra a esquistossomose,[34] utilizando a proteína SM14, que se encontra em fase final de testes.[35] TratamentoExistem duas drogas: praziquantel e oxamniquina[36], para o tratamento da esquistossomose.[37] Eles são considerados equivalentes em relação à eficácia e segurança contra a S. mansoni.[38] Devido ao menor custo por tratamento do praziquantel e à falta de eficácia da oxaminiquina contra a forma urogenital da doença causada por S. haematobium, em geral o praziquantel é considerado a primeira opção de tratamento.[39] Praziquantel pode ser usado com segurança em crianças e mulheres grávidas.[21] O objetivo do tratamento é curar a doença e prevenir a evolução da forma aguda para a crônica da doença. Todos os casos de suspeita de esquistossomose devem ser tratados independentemente da apresentação, pois o parasita adulto pode viver no hospedeiro por anos.[40] A esquistossomose é tratável tomando por via oral, uma única dose do praziquantel, anualmente.[41] O praziquantel elimina apenas os esquistossomas adultos, não é eficaz em matar os ovos e os vermes imaturos, os ovos vivos podem ser excretados pela pessoa infectada semanas após o tratamento com praziquantel, os vermes imaturos podem sobreviver e crescer até se tornarem esquistossomas adultos após a terapia com praziquantel, sendo assim, é importante repetir o teste de esquistossomose nas fezes e/ou urina cerca de 4 a 6 semanas após a terapia com praziquantel, o tratamento com praziquantel pode ser repetido para garantir a eliminação completa do parasita.[14] A OMS desenvolveu diretrizes para o tratamento comunitário com base no impacto que a doença tem nas crianças das aldeias nas quais é comum:[41]
Outros tratamentos possíveis incluem uma combinação de praziquantel com metrifonato, artesunato ou mefloquina.[42] Uma revisão Cochrane encontrou evidências preliminares de que, quando usado sozinho, o metrifonato era tão eficaz quanto o praziquantel.[42] A mefloquina, que já foi usada para tratar e prevenir a malária, foi reconhecida em 2008-2009 como eficaz contra esquistossomos.[43] Historicamente, o Antimonium tartaricum permaneceu como o tratamento de escolha para a esquistossomose até o desenvolvimento do praziquantel na década de 1980.[44] Monitoramento pós-tratamentoA Osteopontina (OPN) é uma ferramenta promissora para monitorar a eficácia do praziquantel e a regressão da fibrose pós-tratamento à medida que a expressão (OPN) é modulada por S. mansoni e seus níveis se correlacionam com a gravidade da fibrose da esquistossomose e hipertensão portal em camundongos e humanos. A farmacoterapia com praziquantel reduz os níveis sistêmicos de OPN e o conteúdo de colágeno hepático em camundongos.[45] BrasilNo Brasil o composto do praziquantel é importando da China e produzido exclusivamente pelo Farmanguinhos, laboratório da Fundação Oswaldo Cruz (Fiocruz), e vende somente só para o Ministério da Saúde, que o distribui para postos de saúde pelo país, o medicamento não é encontrado em farmácias.[46] A Merck, empresa detentora dos direitos patenteados dos medicamentos praziquantel Cisticid®, disponível em comprimidos de 500 mg, e Cestox®, em comprimidos de 150 mg - informou que solicitou à Anvisa a suspensão da produção do Cestox em abril de 2012. A suspensão ocorreu 180 dias depois, embora a razão não tenha sido divulgada pela empresa. Enquanto isso, o Cisticid é vendido por uma distribuidora de São Paulo e destinado ao uso hospitalar. O SUS fornece o praziquantel produzido pela Fundação Oswaldo Cruz (Fiocruz) no Rio de Janeiro, em cápsulas de 600 mg e 150 mg, e garante que não há falta do medicamento na rede pública.[47] HistóriaCom o desenvolvimento da agricultura, a esquistossomose passou de doença rara a problema sério. Muitas múmias egípcias apresentam as lesões inconfundíveis da esquistossomose por S. haematobium. A infecção pelos parasitas dava-se nos trabalhos de irrigação da agricultura. As cheias do Nilo sempre foram a fonte da prosperidade do Egito, mas também traziam os caracóis portadores dos schistosomas. O hábito dos agricultores de fazer as plantações e trabalhos de irrigação com os pés descalços metidos na água parada, favorecia a disseminação da doença crônica causada por estes parasitas. A doença foi descrita cientificamente pela primeira vez em 1851 pelo médico alemão Theodor Maximilian Bilharz, que lhe dá o nome alternativo de bilharzíase. Referências
Ligações externas
|
||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia