|
六フッ化硫黄
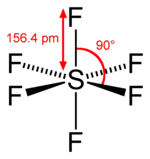
六フッ化硫黄(ろくフッかいおう、sulfur hexafluoride)は、化学式 SF6 で表される硫黄の六フッ化物である。硫黄原子を中心にフッ素原子が正八面体構造をとる。 常温常圧下で化学的に安定な無毒、無臭、無色、不燃の気体で、大気中での寿命は3,200年である。1960年代から電気・電子分野で絶縁材などとして広く使用され、人工の温室効果ガスとされる。使用量はさほど多くないが、近年では新用途開発の進展に伴って需要が増加している。100年間の地球温暖化係数は二酸化炭素の22,800倍と大きく、かつ大気中の寿命が長いため、HFCs、PFCsと共に京都議定書で地球温暖化防止排出抑制対象ガスの1つに指定された。大気への放出はほぼ全て人為と考えられている。  特徴融点は − 50.8 ± 0.2 °C、昇華点は − 63.8 °C である。分子は、1個の硫黄原子(S)と6個のフッ素原子(F)で構成される。無色無臭の気体。空気を1としたときの比重は 5.106[1]。熱的、化学的に安定で、耐熱性、不燃性、非腐食性に優れ、また高い絶縁性能[3]を有している。 用途工業用高い絶縁性能を有しているため、ガス変圧器、ガス遮断器、ガス絶縁開閉装置などの電力機器において絶縁体や消弧媒体として利用されている。他にはマグネシウム合金溶解炉の酸化防止用途や、半導体製品や液晶パネルのドライエッチング工程でも用いられている。特殊な例としてリチウムと組み合わせて魚雷用エンジンの燃料にも用いられている。 医療用眼科領域の手術の際に用いられる。SF6 を眼内に注入すると空気よりも長期間とどまる性質があるため、網膜剥離などの網膜硝子体疾患の手術(硝子体手術)の際にガスの浮力を利用して網膜を一定期間押し付ける目的で使用されることがある。 合成法と化学分子を構成する元素の単体、すなわち S8 と F2 から合成することができる。他のフッ化硫黄類も副生するが、S2F10 は加熱による不均化、SF4 は水酸化ナトリウム水溶液での洗浄による分解でそれぞれ除去される。 またSF4 を原料として SF5Cl を合成することができる。構造は SF6と類似するが、強い酸化剤であり、加水分解されて硫酸となる。 SF6 の反応はあまり知られていない。溶融した金属ナトリウムとも反応しない。これは、硫黄中心が正八面型に配置するフッ素で覆われていることと、分子全体の極性がほとんど無いことに由来する。 特筆するものとしては、魚雷の推進機関において利用される金属リチウムとの反応がある[4]。 反応によって生じた熱エネルギーと海水から水蒸気を生成させ、これを推進力としている。また反応生成物の体積は元の六フッ化硫黄とリチウムよりも小さくなることから、従来の魚雷のように生成物を機外に排出する必要が無く、魚雷の性能向上に寄与している[5]。 その他SF6 を吸い込み声を出すと音域が低くなる。重い気体中では音速が下がるため、呼吸器における共鳴周波数が下がる。ただし、SF6 自体は無毒でも、O2を含まない気体の吸入(正確には、肺内のO2分圧が下がりすぎること)は、酸素欠乏による窒息死を招く。特に重い気体は肺底に留まりやすく、空気との比重差による排出が難しいため、より危険である。 2007年に気象庁気象研究所が海水中の六フッ化硫黄濃度を高精度かつ低検出限界で測定できる手法を開発した[6]。 ジシランと激しく反応し、爆発する。 注釈・出典
関連項目外部リンク
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia