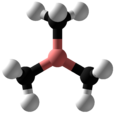
トリメチルボラン
別称
Trimethylborine
識別情報
CAS登録番号 593-90-8 [ 2]
PubChem
68979
ChemSpider
62201
EC番号
209-816-3
InChI=1S/C3H9B/c1-4(2)3/h1-3H3
Key: WXRGABKACDFXMG-UHFFFAOYSA-N
特性
化学式
C3 H9 B
モル質量
55.92 g/mol
外観
液体、気体は共に無色
密度
0.625 g/cm3 at −100 °C[ 3]
融点
−161.5 °C , 112 K, -259 °F
沸点
−20.2 °C , 253 K, -4 °F
水 への溶解度
やや高い
構造
分子の形
Δ
危険性
GHSピクトグラム
GHSシグナルワード
危険(DANGER)
Hフレーズ
H220 , H250 , H280 , H314
Pフレーズ
P210 , P222 , P260 , P264 , P280 , P301+330+331 , P302+334 , P303+361+353 , P304+340 , P305+351+338 , P310 , P321 , P363 , P370+378
主な危険性
空気中で自然発火
引火点
自然発火性をもつ気体
発火点
−40 °C (−40 °F; 233 K) [ 4]
関連する物質
関連物質
特記なき場合、データは常温 (25 °C )・常圧 (100 kPa) におけるものである。
トリメチルボラン (英語 : Trimethylborane 、化学式:B(CH3 )3 またはMe3 B)は毒性と自然発火性 のある常温下で気体の物質である。
融点は−161.5 °Cで沸点は−20.2 °Cであり、液体でも気体でも無色である。赤外吸収スペクトル のピークが最高値をとる波長は1330 cm−1 であり、3010 cm−1 と1185 cm−1 でもピークが現れる。
高濃度のトリメチルボランは空気中で自然発火し、緑色の炎を発しながらすすを出して燃焼する[ 5] log P = 6.1385 + 1.75 log T − 1393.3/T − 0.007735 T (T はケルビン温度 )で与えられる[ 6] [ 4]
トリメチルボランが初めて合成された際に用いられた反応は気体状態の三塩化ホウ素 にジメチル亜鉛 を作用させるというものであった[ 6] グリニャール試薬 を用いて合成されるが、溶媒からの不純物によって汚染される。トリメチルボランはジブチルエーテル 溶媒中の三臭化ホウ素 とヘキサン 溶媒中のトリメチルアルミニウム の合成反応によって約98%の収率で合成される[ 6] トリブチルボラン とトリメチルアルミニウムクロリド との反応やテトラフルオロホウ酸カリウム とトリメチルアンモニウムとの反応によっても得られる[ 7] ヨウ化メチルマグネシウム とエーテル溶媒中の三フッ化ホウ素 との反応でも得られる[ 8]
溶媒中または気体中に酸素が存在するとゆっくりと酸化してジメチルトリオキサジボランが生成される。ただし、この反応の主生成物はジメチルボリルメチルペルオキシドであり、急速に分解してジメトキシメチルボランになる[ 9] ルイス酸 である。室温で水や塩素と反応する。グリース とは反応するが、テフロン やガラスとは反応しない[ 6] アンモニア とは付加体を作ることがある[ 10] ジボラン と不均化反応して、モノメチルジボラン とジメチルジボラン を生成する。
気体の状態では、トリメチルホスフィン と反応してルイス塩を作る。この反応熱は−41 kcal/molであり、この時の昇華熱は−24.6 kcal/molである。
メチルリチウムはトリメチルボランとの反応により、テトラメチルボラン塩を作る[ 11] ネオペンタン やテトラメチルシラン 、テトラメチルアンモニウム のカチオンと等電子的である。
高純度のトリメチルボランは中性子カウンター として用いられる[ 10] 化学蒸着 にも用いられる。
^ “CHAPTER P-6. Applications to Specific Classes of Compounds”. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book) . Cambridge: The Royal Society of Chemistry . (2014). p. 974. doi :10.1039/9781849733069-00648 . ISBN 978-0-85404-182-4 ^ Graner, G.; Hirota, E.; Iijima, T.; Kuchitsu, K.; Ramsay, D. A.; Vogt, J.; Vogt, N. (2001). “C3H9B Trimethylborane”. Molecules containing Three or Four Carbon Atoms . Landolt-Börnstein - Group II Molecules and Radicals. 25C . pp. 1. doi :10.1007/10688787_381 . ISBN 978-3-540-66774-2 ^ http://www.voltaix.com/images/doc/Msb000_TMB.pdf MSDS from Voltaix ^ a b Trimethylborane
^ Herbert Ellern (1968). Military and Civilian Pyrotechnics . Chemical Publishing Company. p. 24 ^ a b c d William S. Rees, Jr. and al (1990). Alvin P. Ginsberg. ed. Trimethylborane . 27 . p. 339
^ Roland Koumlstera, Paul Bingera Wilhelm, V. Dahlhof; Binger; Dahlhoff (1973). “A Convenient Preparation of Trimethylborane and Triethylborane” . Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry 3 (4): 359–367. doi :10.1080/00945717308057281 . http://www.informaworld.com/smpp/content~db=all~content=a762676557 . ^ Donald Charles Mente (May 1975). “The Reactions of Trimethyl group Va Lewis Bases with simple Boron Lewis Acids ”. 23 September 2010 閲覧。 ^ Barton, Lawrence; Crump, John M.; Wheatley, Jeffrey B. (June 1974). “Trioxadiborolanes from the oxidation of methyldiborane”. Journal of Organometallic Chemistry 72 (1): C1–C3. doi :10.1016/s0022-328x(00)82027-6 . ^ a b Gaylon S. Ross (2 October 1961). “Preparation of High Purity Trimethylborane” . Journal of Research of the National Bureau of Standards Section A 66 (1). http://nvl.nist.gov/pub/nistpubs/jres/066/1/V66.N01.A06.pdf .
^ Georg Wittig in 1958