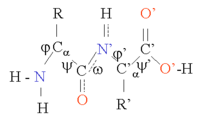構成アミノ酸を分析して、タンパク質の二次、三次、四次構造を予測することができる。 タンパク質構造予測 (たんぱくしつこうぞうよそく、英 : protein structure prediction ) は、タンパク質 についてそのアミノ酸 配列をもとに3次元構造(立体配座 )を推定することであり、バイオインフォマティクス および計算化学 における研究分野の一つである。専門的な言葉では「タンパク質の一次構造 をもとに二次構造 や三次構造 を予測すること」と表現できる。構造予測は、逆問題であるタンパク質設計 とは異なる。タンパク質のアミノ酸配列は一次構造と呼ばれる。タンパク質のアミノ酸配列は、その遺伝子 が記録されたDNA の塩基配列から、遺伝コード(コドン )の対応表に基づいて、導出することができる。生体内において、ほとんどのタンパク質の一次構造は一意的に3次元構造(三次構造、コンフォメーション)を形成する。これをタンパク質が折りたたまれる (フォールディング)という。タンパク質の3次元構造を知ることは、そのタンパク質の機能を理解する上で有力な手がかりとなる。医学 (例:医薬品設計 )や、バイオテクノロジー (例:新しい酵素 の設計)において重要な役割を果たしている。
タンパク質構造予測においては多くの手法が考案されている。それぞれの手法の性能は、2年ごとにCASP 実験が行われ、評価されている。タンパク質構造予測ウェブサーバの継続的な評価は、コミュニティプロジェクトCAMEO3D (英語版 )
現在ではタンパク質構造予測が果たす役割は、これまで以上に重要になっている。近年、ヒトゲノム計画 などDNA の塩基配列 を解読する大規模なプロジェクトが盛んに行われるようになってきている。 こうしたプロジェクトの成果であるDNA塩基配列のデータから、遺伝コードの対応表に基づいて、非常に多くのタンパク質 のアミノ酸 配列のデータを導出することができる。公共の配列データベース (GenBank やSwiss-Prot など)に蓄積されるアミノ酸配列のデータは急速に増大しているが、現在のところ、実験による方法で決定されたタンパク質構造データの増加ペースはあまり高くない。実験による方法でタンパク質構造を決定する作業では、X線回折 や核磁気共鳴 (NMR)のような時間がかかり費用を要する手法を使うことが多い。そのため、この項目で説明する予測による方法でタンパク質構造を解明することが多く行われている。
しかしタンパク質構造の予測は非常に難しい。その背景には、次に述べるような多くの要因がある。
タンパク質がとる可能性がある構造の数は、膨大である(レヴィンタールのパラドックス )。
タンパク質構造の安定性に関する物理学的な基盤が、あまり理解されていない。
一部のタンパク質では、その一次構造 のみで三次構造 を決定できないことがある。例えば、シャペロン という名前で知られる一群のタンパク質は、別のタンパク質が正しく折りたたむ(三次構造をとる)のを助ける。
分子動力学法 (MD法)のような手法でタンパク質の折りたたみ を直接シミュレートすることは、実際的な理由および理論的な理由から、一般的には扱いにくい。このような困難はあるが、タンパク質構造予測に関心を持つ多くの研究グループにより、数多くの進歩がなされてきている。 小さなタンパク質の構造予測については、現在では手法が確立している。さまざまな手法でタンパク質の構造予測が日常的に行われるようになっている。タンパク質構造予測の手法は、de novo モデリングと比較モデリングの2つに大きく分類することができる。
タンパク質は、アミノ酸 がペプチド結合 でつながった鎖である。この鎖は、各α炭素 原子(Cα原子)を中心に回転するため、多くのコンフォメーション (立体構造)が可能である。タンパク質の三次元構造の違いは、このようなコンフォメーション変化によるものである。鎖内の各アミノ酸は極性を持っている。つまり、正と負の電荷を持つ領域が分かれており、水素結合 のアクセプターとなる遊離カルボニル基 と、水素結合のドナーとなるNH基を持っている。そのため、これらの基はタンパク質の構造の中で相互作用することができる。20種類のアミノ酸は[どれ? 、構造的にも重要な役割を果たす側鎖の化学的性質によって分類できる。グリシン は、最も小さい側鎖を持ち、水素原子が1つしかないため、タンパク質構造の局所的な柔軟性を高めることができるという特別な立場にある。一方、システイン は別のシステイン残基と反応して構造全体を安定化させる架橋を形成することができる[要出典 。
タンパク質の構造は、αヘリックスやβシートなどの二次構造的要素の並びと考えることができ、これらの要素が組み合わさってタンパク質鎖の全体的な立体構造を構成している。このような二次構造では、隣接するアミノ酸間で水素結合の規則的パターンが形成され、アミノ酸のΦ角とΨ角[要説明 は類似している[要出典 。
結合のΦ角とψ角 これらの構造の形成は、各アミノ酸の極性基を中和する。二次構造は、疎水性環境のタンパク質コアにしっかりと詰め込まれている。各アミノ酸側鎖が占有する体積は限られており、近くにある他の側鎖との相互作用の数も限られているため、分子モデリングやアライメントの際にはこの状況を考慮する必要がある[ 1]
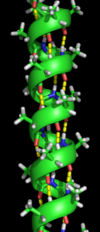
αヘリックスは、タンパク質の二次構造の中で最も多く存在するタイプである。αヘリックスは、1ターンあたり3.6個のアミノ酸を持ち、4番目の残基ごとに水素結合が形成されている。平均的な長さは10アミノ酸(3ターン)または10Åだが、5~40(1.5~11ターン)とばらつきがある。水素結合が整列することで、ヘリックスに双極子モーメントが生じ、その結果、ヘリックスのアミノ末端に部分的な正電荷が生じる。この領域には遊離NH2 基があるため、リン酸塩などの負の電荷を持つ基と相互作用する。αヘリックスは、タンパク質コアの表面に最も多く存在し、そこは水性環境との界面となっている。らせんの内側に面する側は疎水性アミノ酸が、外側に面する側は親水性アミノ酸が存在する傾向がある。このように、4つのアミノ酸のうち3分の1ずつが疎水性になる傾向があり、このパターンは容易に見つけることができる。ロイシンジッパー モチーフでは、隣接する2つのヘリックスの向かい合う面にあるロイシンの繰り返しパターンがモチーフの予測に大きく影響している。ヘリカルホイール (英語版 ) アラニン (A)、グルタミン酸 (E)、ロイシン (L)、メチオニン (M)に富み、プロリン (P)、グリシン (G)、チロシン (Y)、セリン (S)に乏しい領域は、αヘリックスを形成させる傾向がある。プロリンは、αヘリックスを不安定にしたり破壊したりするが、より長いヘリックスに存在し、屈曲部を形成することもある。
水素結合(黄色の点線)を持つαヘリックス(黄緑色のらせん構造)。
βシートは、鎖の一部分にある平均5~10個の連続したアミノ酸と、その先にある別の5~10個のアミノ酸との間の水素結合によって形成される。相互作用する領域は、隣接していて間に短いループがある場合もあれば、離れていてその間に他の構造が存在する場合もある。すべての鎖が同じ方向に走って平行シートを形成したり、他のすべての鎖が化学的に逆方向に走って反平行シートを形成したり、または鎖が平行および反平行に走って混合シートを形成してもよい。平行型と反平行型では、水素結合のパターンは異なっている。シートの内部ストランドの各アミノ酸は隣接するアミノ酸と2つの水素結合を形成するのに対し、外部ストランドの各アミノ酸は内部ストランドと1つの結合しか形成しない。ストランドに対して直角にシートを横切って見たとき、より離れたストランドがわずかに反時計回りに回転して、左巻きのねじれを形成している。Cα原子はプリーツ構造のシートの上下に交互に配置され、アミノ酸のR側基はプリーツの上下に交互に配置される。シート中のアミノ酸のΦ角とΨ角は、ラマチャンドランプロット の1つの領域で大きく変化する。βシートの位置を予測することは、αへリックスよりも困難である。多重整列 におけるアミノ酸のバリエーションを考慮すると、状況は多少改善される。
タンパク質の一部は固定した立体構造を持っているが、規則的な構造は形成していない。これらを、タンパク質の無秩序な部分や折りたたまれていない部分 、あるいはランダムコイル (固定された三次元構造を持たない折りたたまれていないポリペプチド鎖)と混同してはならない。これらの部分は、βシートとαへリックスをつなぐことから、しばしば「ループ 」と呼ばれている。ループは通常、タンパク質の表面に位置しているため、その残基は容易に突然変異が許される。配列アライメント の特定の領域で、置換、挿入、削除の数が多いことは、ループの兆候である可能性がある。ゲノムDNA上のイントロン の位置は、コード化されたタンパク質のループの位置と相関している可能性がある[要出典 。ループはまた、荷電アミノ酸と極性アミノ酸を持つ傾向があり、しばしば活性部位の構成要素となる。
タンパク質は、構造的類似性と配列類似性の両方に従って分類できる。構造分類では、上述の二次構造の大きさや空間的配置を、既知の三次元構造の中で比較する。歴史的には、配列の類似性に基づく分類が最初に使用された。最初に、全配列のアライメントに基づく類似性による分類が実施された。その後、保存アミノ酸パターン の出現に基づいてタンパク質が分類された。これらの方式でタンパク質を分類したデータベース が利用できる。タンパク質の分類方法を検討する際には、いくつかの点に留意する必要がある。第一に、異なる進化の起源からの全く異なるタンパク質配列は、同じような構造に折りたたまれる可能性がある。逆に、特定の構造を持つ古代遺伝子の配列は、同じ基本的な構造的特徴を維持しながらも、異なる種で大きく分岐している可能性がある。このような場合、残っている配列の類似性を認識することは、非常に困難な作業となる可能性がある。第二に、互いにあるいは第3の配列とかなりの程度で配列類似性を共有する2つのタンパク質も、進化的起源を共有し、いくつかの構造的特徴も共有していると考えられている。しかし、進化の過程で遺伝子重複や遺伝子再編成が起こると、新しい遺伝子のコピーが生まれ、それが新しい機能や構造を持つタンパク質に進化することがある[ 1]
タンパク質間の進化と構造の関係についてより一般的に使用される用語を以下に示す。この他にも、タンパク質のさまざまな種類の構造上の特徴を表す、多くの追加用語が使いられる。このような用語の説明は、CATH Webサイト、タンパク質立体構造分類データベース (SCOP)Webサイト、スイスのバイオインフォマティクスExpasy Webサイトに掲載されているグラクソ・ウエルカム チュートリアルなどに掲載されている。
活性部位 化学的に特異的な基質と相互作用することができ、タンパク質に生物学的活性を与える、三次構造(三次元)または四次構造(タンパク質サブユニット)内のアミノ酸側鎖の局所的な組み合わせのこと。全く異なるアミノ酸配列のタンパク質は、同じ活性部位を持つ構造に折りたたまれることがある。
アーキテクチャ
三次元構造における二次構造の相対的な向きであり、類似のループ構造を共有しているかどうかに関わらず表したもの。
折りたたみ(トポロジー)
保存ループ構造を持つアーキテクチャの一種。
ブロック
タンパク質ファミリーの保存アミノ酸配列パターン。そのパターンには、表現された配列上の各位置にマッチする可能性のある一連のものが含まれているが、パターンにも配列にも挿入や削除の位置はない。対照的に、配列プロファイルは、挿入や削除を含む類似のパターンの集まりを表すスコアリングマトリックスの一種である。
クラス (英語版 ) タンパク質ドメインを、二次構造の内容や構成に応じて分類するための用語。LevittとChothia (1976)によって4つのクラス (英語版 )
コア
折りたたまれたタンパク質分子のうち、αヘリックスとβシートの疎水性内部を構成する部分。コンパクトな構造により、アミノ酸の側鎖が十分に接近しているため、相互作用することができる。SCOPデータベースのようにタンパク質構造を比較する場合、コアとは、共通のフォールドを持つ、または同じスーパーファミリーにあるほとんどの構造に共通する領域である。構造予測では、進化の過程で保存される可能性の高い二次構造の配列をコアと定義することがある。
ドメイン (配列の文脈)ポリペプチド鎖上の他のセグメントの存在にかかわらず、三次元構造に折りたたむことができるポリペプチド鎖のセグメント。あるタンパク質の別個のドメインは、広範囲に渡って相互作用することもあれば、ポリペプチド鎖の長さのみで結合することもある。複数のドメインを持つタンパク質は、異なる分子との機能的な相互作用のために、これらのドメインを使用する場合がある。
ファミリー (配列の文脈)整列させたときに50%以上の同一性がある生化学的機能が類似したタンパク質のグループ。この判断基準は、現在もタンパク質情報資源 (英語版 ) 多重整列 の結果、タンパク質の長さ全体で共通レベルの類似性が見られる場合、PIRはそのファミリーを相同ファミリーと呼んでいる。整列した領域は相同ドメインと呼ばれ、この領域は他のファミリーと共有されるいくつかの小さな相同ドメインから構成されている場合がある。ファミリーは、配列類似性の高レベルまたは低レベルに基づいて、さらにサブファミリーに細分化されたり、スーパーファミリーにグループ化される。SCOPデータベースでは1296ファミリーが、CATHデータベース(バージョン1.7ベータ版)では1846ファミリーが報告されている。:同じ機能を持つタンパク質の配列を詳しく調べると、類似性が高い配列を共有しているものがある。上記の基準では、これらは明らかに同じファミリーの一員である。しかし、他のファミリーメンバーとの配列の類似性がほとんどないか、あるいはわずかであるものも見られる。このような場合、2つの遠縁のファミリーメンバーAとCの間のファミリー関係は、AとCの両方に有意な類似性を共有する追加のファミリーメンバーBを見つけることによって説明されることがよくある。このように、BはAとCの間をつなぐ役割を果たす。もう一つの方法は、遠くのアライメントを調べて、保存度が高い一致を探すことである。
同一性レベルが50%の場合、タンパク質は同じ三次元構造を持つ可能性が高く、配列アライメントの同一の原子は構造モデルにおいても約1Åの範囲で重なり合う。このように、あるファミリーで1つ目のメンバーの構造がわかっていれば、そのファミリーの別のメンバーについても信頼性の高い立体構造を予測できる可能性があり、同一性レベルが高いほど、その予測の信頼性は高くなる。タンパク質の構造モデリングは、アミノ酸の置換が三次元構造のコアにどれだけ適合するかを調べることで行うことができる。
ファミリー(構造の文脈)
FSSPデータベース (構造類似タンパク質ファミリーのデータベース)やDALI/FSSP Webサイトで使用されているように、構造的に有意なレベルで類似しているが、必ずしも有意な配列の類似性を持たない2つの構造。折りたたみ(フォールディング )
構造モチーフと同様で、同じ構成の二次構造単位のより大きな組み合わせを含む。このように、同じ折りたたみを持つタンパク質は、二次構造の組み合わせが同じで、同じようなループで結ばれている。例えば、いくつかの交互αヘリックスと平行β-ストランドからなるロスマンフォール ドがあげられる。SCOP、CATH、FSSPのデータベースでは、既知のタンパク質構造が、構造の複雑さに応じて階層的に分類されていて、その基本レベルは「フォールド(折りたたみ)」が用いられている。
相同ドメイン(配列の文脈)
一般的に配列アラインメント法によって見出される拡張配列パターン。これは、整列された配列間における共通の進化的起源を示す。相同ドメインは一般的にモチーフよりも長い。ドメインは、与えられたタンパク質配列のすべてを含むこともあれば、配列の一部のみを含む場合もある。ドメインの中には複雑なものもあり、進化の過程でいくつかの小さな相同ドメインが結合して大きなドメインになったものもある。配列全体をカバーするドメインは、PIR(タンパク質情報資源 (英語版 )
モジュール
1つまたは複数のモチーフからなる保存アミノ酸パターンの領域で、構造または機能の基本単位と考えられているもの。モジュールの存在は、タンパク質をファミリーに分類するのにも使用されている。
モチーフ (配列の文脈)2つ以上のタンパク質に見られる、保存アミノ酸パターン。Prositeカタログ (英語版 ) [ 2]
モチーフ(構造の文脈)
ポリペプチド鎖の隣接する部分が特定の三次元構造に折りたたまれることによって生じる、いくつかの二次構造要素の組み合わせである。たとえば、ヘリックス-ループ-ヘリックスのモチーフがある。構造モチーフは、超二次構造や超二次フォールドとも呼ばれる。
位置特異的スコアリングマトリックス (英語版 ) ギャップのない多重整列における保存領域を表す。マトリックスの各列は、多重整列の1列に見られるバリエーションを表す。ウェイトマトリックスまたはスコアリングマトリックスとも呼ばれる。
位置特異的スコアリングマトリックス-3D (構造の文脈)
同じ構造クラスに分類されるタンパク質のアライメントに見られるアミノ酸のバリエーションを表す。マトリックスの列は、整列した構造体の1つのアミノ酸位置で見つかったアミノ酸のバリエーションを表している。
プロファイル (英語版 ) タンパク質ファミリーの多重整列 を表すスコアリングマトリックス。プロファイルは、通常、多重整列の中で「よく保存された領域」から取得される。プロファイルはマトリックスの形式で、各列はアライメント内の位置を表し、各行はアミノ酸の1つを表す。マトリックスの値は、各アミノ酸がアライメントの対応する位置にある可能性を示す。プロファイルはターゲット配列に沿って移動され、動的計画法アルゴリズムによって最良のスコアリング領域を見つだす。マッチング時のギャップは許容されており、このケースにはアミノ酸がマッチしなかった場合の負のスコアであるギャップペナルティが含まれる。配列プロファイルは、隠れマルコフモデル で表すこともでき、プロファイルHMMと呼ばれる。
プロファイル(構造の文脈)
既知のタンパク質構造の連続した位置に、どのアミノ酸がうまく適合し、どのアミノ酸がうまく適合しないのかを表すスコアリングマトリックス。プロファイルの列は構造内の連続した位置を表し、プロファイルの行は20個のアミノ酸を表している。配列プロファイルと同様に、構造プロファイルもターゲット配列に沿って移動され、動的計画法アルゴリズムにより、可能な限り高いアライメントスコアを見つだす。ギャップが含まれ、ペナルティを受ける場合がある。得られたスコアは、対象となるタンパク質がそのような構造をとる可能性を示すものである。
一次構造 タンパク質の直鎖状のアミノ酸配列のこと。化学的には、アミノ酸がペプチド結合で結合したポリペプチド鎖である。
二次構造 ポリペプチド鎖を構成するアミノ酸のC、O、NH基間の相互作用により、αヘリックス、βシート、ターン、ループ、およびその他の形態が形成され、三次元構造への折りたたみが促進されること。
三次構造 三次構造とは、ポリペプチド鎖の二次構造が折り重なってできた立体的な構造または球状の構造のこと[ 1]
四次構造 複数の独立したポリペプチド鎖からなるタンパク質分子の三次元構造。
スーパーファミリー 遠く離れていても検出可能な配列類似性によって関連している、同じまたは異なる長さのタンパク質ファミリーのグループ。このように、あるスーパーファミリー のメンバーは、共通の進化的起源を持っている。もともとはDayhoffが、スーパーファミリーであることの判断基準を、アライメントスコアに基づいて、配列が関連していない可能性が10 6であると定義した(Dayhoff et al. 1978)。配列アライメントの同一性が低いタンパク質でも、納得のゆく共通の数の構造的および機能的な特徴を持っていれば、同じスーパーファミリーに分類される。スーパーファミリータンパク質は、三次元構造のレベルでは共通の折りたたみなどの構造的特徴を共有するが、二次構造の数や配置が異なる場合もある。 PIRリソースでは、同相スーパーファミリー(homeomorphic superfamily )という言葉を使用して、配列の端から端までを揃えることができ、単一の配列相同性ドメイン(配列全体に広がる類似性のある領域)を共有しているスーパーファミリーのことを指す。このドメインは、他のタンパク質ファミリーやスーパーファミリーと共有される、より小さな相同性ドメインから構成されている可能性もある。あるタンパク質の配列には、複数のスーパーファミリーに属するドメインが含まれている可能性があり、複雑な進化の歴史を示しているが、多重整列 全体の類似性が認められれば、配列は1つの同相スーパーファミリーにのみ割り当てられる。また、スーパーファミリーのアライメントには、アライメント内またはアライメントの両端で整列しない領域が含まれる場合がある。対照的に、同じファミリーの配列は、アラインメント全体を等してうまく整列する。
二次構造予測 とは、タンパク質のアミノ酸 配列の知識のみに基づいて、タンパク質 の局所的な二次構造 を予測することを目的としたバイオインフォマティクス の一連の技術である。タンパク質の場合、予測は、アミノ酸配列の領域を、適当なαヘリックス 、βストランド (しばしば「拡張」コンフォメーションと呼ばれる)、ターン のいずれかに割り当てることで構成される。予測の成功は、タンパク質の結晶構造 に適用されたDSSP アルゴリズム(または同様。例:STRIDE )の結果と比較して判断される。タンパク質の膜貫通ヘリックス (英語版 ) コイルドコイル など、明確に定義された特定のパターンを検出するために、特殊なアルゴリズムが開発されている[ 1]
タンパク質の二次構造を予測する現代の最良の方法では、機械学習と配列アライメント を使用した後、80%の精度に達すると主張されている[ 3] 折りたたみ認識法 やde novo ab initio )構造モチーフ の分類、および配列アライメントの精密化のための改善機能として使用することができる。現在のタンパク質二次構造予測手法の精度は、LiveBench (英語版 ) EVA (英語版 ) ベンチマーク で毎週評価されている。
1960年代から1970年代初頭に導入された初期の二次構造予測法は[ 4] [ 5] [ 6] [ 7] [ 8] らせん-コイル遷移モデル (英語版 ) [ 9] [ 1] 進化的 保存 は、多重整列 で多数の相同配列 (英語版 ) ニューラルネット やサポートベクターマシン などの最新の機械学習 手法を併用することで、これらの手法は球状タンパク質 において総合的に80%の精度を達成できる[ 10] [ 10] 三次構造 の影響を考慮していない。たとえば、ヘリックスと予測された配列であっても、タンパク質のβシート領域内に位置し、その側鎖が隣接するものとうまく結合していれば、βストランド構造をとることができる可能性がある。また、タンパク質の機能や環境に起因する劇的な構造変化によっても、局所的な二次構造が変化することがある。
現在までに20種類以上の二次構造予測法が開発されている。最初のアルゴリズム の1つはChou-Fasman法 (英語版 ) [ 11] [ 1]
次に注目すべきは、情報理論 に基づいたGOR法 (英語版 ) ベイズ推定 を使用する[ 12] 条件付き確率 も考慮する(隣接するアミノ酸が同じ構造を持つことは想定されていない)。アミノ酸の構造的傾向は、プロリン やグリシン などの少数のアミノ酸に対してのみ強く現れるため、このアプローチはChou-Fasmanのアプローチよりも感度が高く、精度も高い。多くの隣接アミノ酸のそれぞれからの弱い寄与が、全体として強い効果をもたらす可能性がある。オリジナルのGOR法の精度は約65%で、βシートよりもαヘリックスの予測で劇的な成功をおさめたが、βシートはループや無秩序な領域としばしば誤認された[ 1]
もう一つの大きな進歩は、機械学習 の手法を用いたことである。最初に人工ニューラルネットワーク の手法が使われた。トレーニングセットとして解明された構造を使用し、二次構造の特定の配置に関連する共通の配列モチーフを識別する。これらの手法は70%以上の精度で予測することができるが、完全なβシートの配置に必要な拡張コンフォメーション形成を助ける水素結合 パターンを評価するための三次元構造情報がないため、βストランドの予測が不十分になることが多い。ニューラルネットワークを用いたタンパク質の二次構造予測プログラムとしては、PSIPRED (英語版 ) JPRED (英語版 ) [ 1] サポートベクターマシン (SVM)は、統計的手法では特定が困難なターンの位置を予測するのに特に有効であることがわかっている[ 13] [ 14]
機械学習技術を拡張して、未割り当て領域の主鎖 の二面角 など、タンパク質のよりきめ細かい局所的特性の予測が試みられている。この問題には、SVM[ 15] [ 16] [ 13] ab initio 構造予測に用いることに成功している[ 17]
二次構造の形成は、タンパク質の配列に加えて、他の要因にも左右されることが報告されている。たとえば、二次構造の傾向は、局所的な環境[ 18] [ 19] [ 20] [ 21] [ 22] [ 23] [ 24] 接触数 (英語版 ) [ 25]
タンパク質構造予測の実用的な役割は、これまで以上に重要になっている[ 26] ヒトゲノム計画 などの大規模なDNA 塩基配列解析により、膨大な量のタンパク質配列データが作成されている。構造ゲノミクス におけるコミュニティ全体の取り組みにもかかわらず、実験的に決定されたタンパク質の構造は、通常、時間と費用のかかるX線結晶構造解析 やNMR分光法 によって得られるものであり、タンパク質の塩基配列から得られるものに比べてはるかに遅れているのが現状である。
タンパク質構造予測は非常に難しく、未解決の課題である。主な問題は、タンパク質の自由エネルギー の計算と、このエネルギーの全体的な最小値を見つける (英語版 ) 天文学的に巨大 なタンパク質構造の可能性のある空間を探索する必要がある。このような問題は、比較モデリングまたはホモロジーモデリング (英語版 ) 折りたたみ認識法 では、部分的に回避することができる。この方法では、問題のタンパク質が、別の相同タンパク質の実験的に決定された構造に近い構造を採用しているという仮定で、探索空間が刈り取られる。一方、de novoタンパク質構造予測 手法では、これらの問題を明示的に解決する必要がある。タンパク質構造予測の進歩と課題については、Zhangによってレビューされている[ 27]
Rosettaをはじめとするほとんどの三次構造モデリング手法は、単一のタンパク質ドメインの三次構造をモデリングするために最適化されている。タンパク質を潜在的な構造ドメインに分割するために、通常、ドメイン解析またはドメイン境界予測と呼ばれるステップが最初に行われる。三次構造予測の他の部分と同様に、これは既知の構造から比較して行うことも[ 28] ab initio 的に行うこともできる(通常は共分散を利用した機械学習 によって行う)[ 29] [ 30] [ 31]
de novo モデリング
de novo またはab initio のタンパク質フォールディング を模倣する方法や、確率的 (英語版 ) 大域的最適化 (英語版 ) IBM Blue Gene 、NEC SX 、MDGRAPE-3 など)や分散型コンピューティング (Folding@home 、Rosetta@Home 、ヒトプロテオーム・フォールディング・プロジェクト (英語版 ) de novo(ab initio) 構造予測は活発な研究分野となっている[ 27]
2009年の時点で、50残基のタンパク質をスーパーコンピュータ上で1ミリ秒の間、原子ごとにシミュレートすることができる[ 32] [ 33] 粗視化モデリング (英語版 ) [ 34] [ 35]
1990年代にシークエンシング が一般的になると、いくつかのグループがタンパク質の配列アライメントを利用して相関突然変異 を予測し、これらの共進化残基を利用して三次構造を予測できるのではないかと期待された(NMR などの実験的手法による距離制約との類似性を利用)。この仮定は、単一残基の突然変異がわずかに有害である場合、残基-残基間の相互作用を回復させるために代償性突然変異が起こる可能性があるとするものである。この初期の研究では、タンパク質の配列から相関突然変異を計算するために、いわゆる個別メソッドを用いていたが、各残基のペアを他のすべてのペアから独立したものとして扱うことから生じる間接的な偽相関に悩まされていた[ 36] [ 37] [ 38]
2011年には、これまでとは異なるグローバルな統計的アプローチにより、十分な配列があれば(1,000以上の相同配列が必要)、共進化残基を予測するだけでタンパク質の3Dフォールドを予測できることが実証された[ 39] EVfold 法は、相同性モデリング、スレッディング、3D構造フラグメントを使用せず、数百残基のタンパク質に対しても標準的なパーソナルコンピュータで実行することができる。この手法や関連するアプローチを用いて予測された接触の精度は、実験的に未解明の膜貫通タンパク質の予測を含め、多くの既知の構造やコンタクトマップ (英語版 ) [ 40] [ 41] [ 42] [ 43]
タンパク質 の比較モデリングでは、最初に構造モデリングの出発点として、既に解明されているタンパク質構造もしくはテンプレート(鋳型)を使う。この方法が有効である理由は、タンパク質の種類は膨大であるが、タンパク質の多くがもつ三次構造 の構造モチーフ の種類は少ないとみられているからである。現在、実際に存在するタンパク質フォールディング のパターンは2000種類程度と考えられている[要出典 。タンパク質の比較モデリングは、構造予測における進化的共分散と組み合わせることができる[ 44]
比較モデリングの手法は次の2種類に分類することができる。[ 27]
相同性モデリング (英語版 ) 相同性 の高い2つのタンパク質は非常に似通った構造をもっているという合理的な前提に基づいている。タンパク質のフォールディングはアミノ酸配列よりも進化的 に保存されているため、配列アライメント によってターゲット(構造が未知のタンパク質)とテンプレートの関係が識別できる場合には、非常に遠い関係にあるテンプレート上でターゲット配列を合理的な精度でモデル化することができる。比較モデリングの主なボトルネックは、既知の良好なアライメントによる構造予測のエラーではなく、アライメントの難しさから生じると考えられている[ 45] タンパク質スレッディング [ 46] スコアリング関数 を用いて、配列と構造の適合性を評価し、可能性が高い三次元モデルを作成する。この種の手法は、三次元構造と直線的なタンパク質配列の間の適合性解析であることから、「3D-1Dフォールド認識法」とも呼ばれている。さらにまた、与えられた構造と大規模な配列のデータベースとの適合性を評価することで、どの配列が与えられたフォールディングを生み出す可能性があるかを予測し、「逆フォールディング検索」を行う方法も生み出した。
アミノ酸の側鎖 を正確にパッキングすることは、タンパク質構造予測における別の問題である。側鎖の形状を予測する問題に特化した手法としては、デッドエンド除去法 (英語版 ) 自己無撞着型平均場法 (英語版 ) 回転異性体 (ロータマー)」と呼ばれる個別の側鎖コンフォメーションの集まりを用いて決定される。この手法では、モデルの全体的なエネルギーを最小化する一連のロータマーを特定しようとする。
これらの方法では、タンパク質の各残基タイプに適したコンフォメーションのコレクションである回転異性体ライブラリを使用する。回転異性体ライブラリには、コンフォメーション、その頻度、平均二面角に関する標準偏差などの情報が含まれていることがあり、サンプリングに利用できる[ 47] 構造バイオインフォマティクス や、タンパク質の既知の実験的構造における側鎖コンフォメーションを統計的に分析して導き出したものである。例えば、四面体炭素の観測されたコンフォメーションをスタガー値(60°, 180°, -60°のように位相をずらした値)の近辺にクラスタリングすることで得られる。
回転異性体ライブラリには、主鎖に依存しないもの、二次構造に依存するもの、主鎖に依存するものがある。主鎖に依存しない回転異性体ライブラリは、主鎖のコンフォメーションを考慮せず、特定のタイプの利用可能なすべての側鎖から計算される(例えば、1987年にイェール大学のPonderとRichardsが行った回転異性体ライブラリの最初の例がある)[ 48] [ 49] [ 50]
ほとんどのソフトウェアで使用されているこれらのライブラリの最新バージョンは、確率または頻度の多次元分布として表示され、ピークはリスト内の個々の回転異性体として見なされる二面角のコンフォメーションに対応する。一部のバージョンは非常に注意深く精査されたデータに基づいており、主に構造検証に使用されるが[ 51] [ 52]
側鎖充填法は、側鎖がより密に充填されているタンパク質の疎水性 コアを分析するのに最も有効である。一方、1つの回転異性体コンフォメーションではなく、複数の回転異性コンフォメーションをとることが多い表面残基のより緩い制約と高い柔軟性を扱うのは難しい[ 53] [ 54]
複数のタンパク質 が結合したタンパク質複合体 (四次構造 、多量体)の構造予測においては、複合体を構成する各タンパク質の構造がわかっているか高い精度で予測できる場合は、タンパク質-タンパク質ドッキング法 (英語版 )
タンパク質構造予測のためのソフトウェアツールは数多く存在する。アプローチとしては、ホモロジーモデリング (英語版 ) タンパク質スレッディング 、ab initio 法、二次構造予測、膜貫通ヘリックスおよびシグナルペプチド予測などがある。CASP 実験に基づいて最近の成功した手法には、I-TASSER (英語版 ) HHpred (英語版 ) AlphaFold などがある。完全なリストはメイン記事 (英語版 )
CASP は、1994年から2年ごとに行われているタンパク質構造予測のためのコミュニティ全体での実験である。CASPは、利用可能な人間の非自動化手法(人間カテゴリー)、およびタンパク質構造予測のための自動化サーバー(サーバーカテゴリー、CASP7で導入)の品質を評価する機会を提供している[ 55]
CAMEO3D (英語版 )
^ a b c d e f g h Mount DM (2004). Bioinformatics: Sequence and Genome Analysis . 2 . Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-712-9
^ Huang JY, Brutlag DL (January 2001). “The EMOTIF database” . Nucleic Acids Research 29 (1): 202–4. doi :10.1093/nar/29.1.202 . PMC 29837 . PMID 11125091 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC29837/ . ^ Pirovano W, Heringa J (2010). “Protein secondary structure prediction”. Data Mining Techniques for the Life Sciences . Methods in Molecular Biology. 609 . pp. 327–48. doi :10.1007/978-1-60327-241-4_19 . ISBN 978-1-60327-240-7 . PMID 20221928 ^ Guzzo AV (November 1965). “The influence of amino-acid sequence on protein structure” . Biophysical Journal 5 (6): 809–22. Bibcode : 1965BpJ.....5..809G . doi :10.1016/S0006-3495(65)86753-4 . PMC 1367904 . PMID 5884309 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1367904/ . ^
Prothero JW (May 1966). “Correlation between the distribution of amino acids and alpha helices” . Biophysical Journal 6 (3): 367–70. Bibcode : 1966BpJ.....6..367P . doi :10.1016/S0006-3495(66)86662-6 . PMC 1367951 . PMID 5962284 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1367951/ .
^
Schiffer M, Edmundson AB (March 1967). “Use of helical wheels to represent the structures of proteins and to identify segments with helical potential” . Biophysical Journal 7 (2): 121–35. Bibcode : 1967BpJ.....7..121S . doi :10.1016/S0006-3495(67)86579-2 . PMC 1368002 . PMID 6048867 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1368002/ .
^
Kotelchuck D, Scheraga HA (January 1969). “The influence of short-range interactions on protein onformation. II. A model for predicting the alpha-helical regions of proteins” . Proceedings of the National Academy of Sciences of the United States of America 62 (1): 14–21. Bibcode : 1969PNAS...62...14K . doi :10.1073/pnas.62.1.14 . PMC 285948 . PMID 5253650 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC285948/ .
^
Lewis PN, Go N, Go M, Kotelchuck D, Scheraga HA (April 1970). “Helix probability profiles of denatured proteins and their correlation with native structures” . Proceedings of the National Academy of Sciences of the United States of America 65 (4): 810–5. Bibcode : 1970PNAS...65..810L . doi :10.1073/pnas.65.4.810 . PMC 282987 . PMID 5266152 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC282987/ .
^ Froimowitz M, Fasman GD (1974). “Prediction of the secondary structure of proteins using the helix-coil transition theory”. Macromolecules 7 (5): 583–9. Bibcode : 1974MaMol...7..583F . doi :10.1021/ma60041a009 . PMID 4371089 . ^ a b Dor O, Zhou Y (March 2007). “Achieving 80% ten-fold cross-validated accuracy for secondary structure prediction by large-scale training”. Proteins 66 (4): 838–45. doi :10.1002/prot.21298 . PMID 17177203 .
^ Chou PY, Fasman GD (January 1974). “Prediction of protein conformation”. Biochemistry 13 (2): 222–45. doi :10.1021/bi00699a002 . PMID 4358940 . ^ Garnier J, Osguthorpe DJ, Robson B (March 1978). “Analysis of the accuracy and implications of simple methods for predicting the secondary structure of globular proteins”. Journal of Molecular Biology 120 (1): 97–120. doi :10.1016/0022-2836(78)90297-8 . PMID 642007 . ^ a b Pham TH, Satou K, Ho TB (April 2005). “Support vector machines for prediction and analysis of beta and gamma-turns in proteins”. Journal of Bioinformatics and Computational Biology 3 (2): 343–58. doi :10.1142/S0219720005001089 . PMID 15852509 .
^ Zhang Q, Yoon S, Welsh WJ (May 2005). “Improved method for predicting beta-turn using support vector machine”. Bioinformatics 21 (10): 2370–4. doi :10.1093/bioinformatics/bti358 . PMID 15797917 . ^ Zimmermann O, Hansmann UH (December 2006). “Support vector machines for prediction of dihedral angle regions”. Bioinformatics 22 (24): 3009–15. doi :10.1093/bioinformatics/btl489 . PMID 17005536 . ^ Kuang R, Leslie CS, Yang AS (July 2004). “Protein backbone angle prediction with machine learning approaches”. Bioinformatics 20 (10): 1612–21. doi :10.1093/bioinformatics/bth136 . PMID 14988121 . ^ Faraggi E, Yang Y, Zhang S, Zhou Y (November 2009). “Predicting continuous local structure and the effect of its substitution for secondary structure in fragment-free protein structure prediction” . Structure 17 (11): 1515–27. doi :10.1016/j.str.2009.09.006 . PMC 2778607 . PMID 19913486 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2778607/ . ^ Zhong L, Johnson WC (May 1992). “Environment affects amino acid preference for secondary structure” . Proceedings of the National Academy of Sciences of the United States of America 89 (10): 4462–5. Bibcode : 1992PNAS...89.4462Z . doi :10.1073/pnas.89.10.4462 . PMC 49102 . PMID 1584778 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC49102/ . ^ Macdonald JR, Johnson WC (June 2001). “Environmental features are important in determining protein secondary structure” . Protein Science 10 (6): 1172–7. doi :10.1110/ps.420101 . PMC 2374018 . PMID 11369855 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2374018/ . ^ Costantini S, Colonna G, Facchiano AM (April 2006). “Amino acid propensities for secondary structures are influenced by the protein structural class”. Biochemical and Biophysical Research Communications 342 (2): 441–51. doi :10.1016/j.bbrc.2006.01.159 . PMID 16487481 . ^ Marashi SA, Behrouzi R, Pezeshk H (January 2007). “Adaptation of proteins to different environments: a comparison of proteome structural properties in Bacillus subtilis and Escherichia coli”. Journal of Theoretical Biology 244 (1): 127–32. doi :10.1016/j.jtbi.2006.07.021 . PMID 16945389 . ^ Costantini S, Colonna G, Facchiano AM (October 2007). “PreSSAPro: a software for the prediction of secondary structure by amino acid properties”. Computational Biology and Chemistry 31 (5–6): 389–92. doi :10.1016/j.compbiolchem.2007.08.010 . PMID 17888742 . ^ Adamczak R, Porollo A, Meller J (May 2005). “Combining prediction of secondary structure and solvent accessibility in proteins”. Proteins 59 (3): 467–75. doi :10.1002/prot.20441 . PMID 15768403 . ^ Momen-Roknabadi A, Sadeghi M, Pezeshk H, Marashi SA (August 2008). “Impact of residue accessible surface area on the prediction of protein secondary structures” . BMC Bioinformatics 9 : 357. doi :10.1186/1471-2105-9-357 . PMC 2553345 . PMID 18759992 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2553345/ . ^ Lakizadeh A, Marashi SA (2009). “Addition of contact number information can improve protein secondary structure prediction by neural networks” . Excli J. 8 : 66–73. http://www.excli.de/vol8/lakizadeh_03_2009/lakizadeh_250309a_proof.pdf . ^ Dorn, Márcio; e Silva, Mariel Barbachan; Buriol, Luciana S.; Lamb, Luis C. (2014-12-01). “Three-dimensional protein structure prediction: Methods and computational strategies” (英語). Computational Biology and Chemistry 53 : 251–276. doi :10.1016/j.compbiolchem.2014.10.001 . ISSN 1476-9271 . PMID 25462334 . http://www.sciencedirect.com/science/article/pii/S1476927114001248 . ^ a b c Zhang Y (June 2008). “Progress and challenges in protein structure prediction” . Current Opinion in Structural Biology 18 (3): 342–8. doi :10.1016/j.sbi.2008.02.004 . PMC 2680823 . PMID 18436442 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2680823/ .
^ Ovchinnikov S, Kim DE, Wang RY, Liu Y, DiMaio F, Baker D (September 2016). “Improved de novo structure prediction in CASP11 by incorporating coevolution information into Rosetta” . Proteins 84 Suppl 1 : 67–75. doi :10.1002/prot.24974 . PMC 5490371 . PMID 26677056 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5490371/ . ^ Hong SH, Joo K, Lee J (November 2018). “ConDo: Protein domain boundary prediction using coevolutionary information”. Bioinformatics 35 (14): 2411–2417. doi :10.1093/bioinformatics/bty973 . PMID 30500873 . ^ Wollacott AM, Zanghellini A, Murphy P, Baker D (February 2007). “Prediction of structures of multidomain proteins from structures of the individual domains” . Protein Science 16 (2): 165–75. doi :10.1110/ps.062270707 . PMC 2203296 . PMID 17189483 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2203296/ . ^ Xu D, Jaroszewski L, Li Z, Godzik A (July 2015). “AIDA: ab initio domain assembly for automated multi-domain protein structure prediction and domain-domain interaction prediction” . Bioinformatics 31 (13): 2098–105. doi :10.1093/bioinformatics/btv092 . PMC 4481839 . PMID 25701568 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4481839/ . ^ Shaw DE, Dror RO, Salmon JK, Grossman JP, Mackenzie KM, Bank JA, Young C, Deneroff MM, Batson B, Bowers KJ, Chow E (2009). Millisecond-scale molecular dynamics simulations on Anton . Proceedings of the Conference on High Performance Computing Networking, Storage and Analysis - SC '09. p. 1. doi :10.1145/1654059.1654126 ISBN 9781605587448 ^ Pierce LC, Salomon-Ferrer R, de Oliveira CA, McCammon JA, Walker RC (September 2012). “Routine Access to Millisecond Time Scale Events with Accelerated Molecular Dynamics” . Journal of Chemical Theory and Computation 8 (9): 2997–3002. doi :10.1021/ct300284c . PMC 3438784 . PMID 22984356 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3438784/ . ^ Kmiecik S, Gront D, Kolinski M, Wieteska L, Dawid AE, Kolinski A (July 2016). “Coarse-Grained Protein Models and Their Applications”. Chemical Reviews 116 (14): 7898–936. doi :10.1021/acs.chemrev.6b00163 . PMID 27333362 . ^ Cheung NJ, Yu W (November 2018). “De novo protein structure prediction using ultra-fast molecular dynamics simulation” . PLOS ONE 13 (11): e0205819. Bibcode : 2018PLoSO..1305819C . doi :10.1371/journal.pone.0205819 . PMC 6245515 . PMID 30458007 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6245515/ . ^ Göbel U, Sander C, Schneider R, Valencia A (April 1994). “Correlated mutations and residue contacts in proteins”. Proteins 18 (4): 309–17. doi :10.1002/prot.340180402 . PMID 8208723 . ^ Taylor WR, Hatrick K (March 1994). “Compensating changes in protein multiple sequence alignments”. Protein Engineering 7 (3): 341–8. doi :10.1093/protein/7.3.341 . PMID 8177883 . ^ Neher E (January 1994). “How frequent are correlated changes in families of protein sequences?” . Proceedings of the National Academy of Sciences of the United States of America 91 (1): 98–102. Bibcode : 1994PNAS...91...98N . doi :10.1073/pnas.91.1.98 . PMC 42893 . PMID 8278414 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC42893/ . ^ Marks DS, Colwell LJ, Sheridan R, Hopf TA, Pagnani A, Zecchina R, Sander C (2011). “Protein 3D structure computed from evolutionary sequence variation” . PLOS ONE 6 (12): e28766. Bibcode : 2011PLoSO...628766M . doi :10.1371/journal.pone.0028766 . PMC 3233603 . PMID 22163331 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3233603/ . ^ Burger L, van Nimwegen E (January 2010). “Disentangling direct from indirect co-evolution of residues in protein alignments” . PLOS Computational Biology 6 (1): e1000633. Bibcode : 2010PLSCB...6E0633B . doi :10.1371/journal.pcbi.1000633 . PMC 2793430 . PMID 20052271 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2793430/ . ^ Morcos F, Pagnani A, Lunt B, Bertolino A, Marks DS, Sander C, Zecchina R, Onuchic JN, Hwa T, Weigt M (December 2011). “Direct-coupling analysis of residue coevolution captures native contacts across many protein families” . Proceedings of the National Academy of Sciences of the United States of America 108 (49): E1293-301. arXiv :1110.5223 . Bibcode : 2011PNAS..108E1293M . doi :10.1073/pnas.1111471108 . PMC 3241805 . PMID 22106262 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3241805/ . ^ Nugent T, Jones DT (June 2012). “Accurate de novo structure prediction of large transmembrane protein domains using fragment-assembly and correlated mutation analysis” . Proceedings of the National Academy of Sciences of the United States of America 109 (24): E1540-7. Bibcode : 2012PNAS..109E1540N . doi :10.1073/pnas.1120036109 . PMC 3386101 . PMID 22645369 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3386101/ . ^ Hopf TA, Colwell LJ, Sheridan R, Rost B, Sander C, Marks DS (June 2012). “Three-dimensional structures of membrane proteins from genomic sequencing” . Cell 149 (7): 1607–21. doi :10.1016/j.cell.2012.04.012 . PMC 3641781 . PMID 22579045 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3641781/ . ^ Jin, Shikai; Chen, Mingchen; Chen, Xun; Bueno, Carlos; Lu, Wei; Schafer, Nicholas P.; Lin, Xingcheng; Onuchic, José N. et al. (9 June 2020). “Protein Structure Prediction in CASP13 Using AWSEM-Suite”. Journal of Chemical Theory and Computation 16 (6): 3977–3988. doi :10.1021/acs.jctc.0c00188 . PMID 32396727 . ^ Zhang Y, Skolnick J (January 2005). “The protein structure prediction problem could be solved using the current PDB library” . Proceedings of the National Academy of Sciences of the United States of America 102 (4): 1029–34. Bibcode : 2005PNAS..102.1029Z . doi :10.1073/pnas.0407152101 . PMC 545829 . PMID 15653774 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC545829/ . ^ Bowie JU, Lüthy R, Eisenberg D (July 1991). “A method to identify protein sequences that fold into a known three-dimensional structure”. Science 253 (5016): 164–70. Bibcode : 1991Sci...253..164B . doi :10.1126/science.1853201 . PMID 1853201 . ^ Dunbrack RL (August 2002). “Rotamer libraries in the 21st century”. Current Opinion in Structural Biology 12 (4): 431–40. doi :10.1016/S0959-440X(02)00344-5 . PMID 12163064 . ^ Ponder JW, Richards FM (February 1987). “Tertiary templates for proteins. Use of packing criteria in the enumeration of allowed sequences for different structural classes”. Journal of Molecular Biology 193 (4): 775–91. doi :10.1016/0022-2836(87)90358-5 . PMID 2441069 . ^ Lovell SC, Word JM, Richardson JS, Richardson DC (August 2000). “The penultimate rotamer library”. Proteins 40 (3): 389–408. doi :10.1002/1097-0134(20000815)40:3<389::AID-PROT50>3.0.CO;2-2 . PMID 10861930 . ^ Shapovalov MV, Dunbrack RL (June 2011). “A smoothed backbone-dependent rotamer library for proteins derived from adaptive kernel density estimates and regressions” . Structure 19 (6): 844–58. doi :10.1016/j.str.2011.03.019 . PMC 3118414 . PMID 21645855 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3118414/ . ^ Chen VB, Arendall WB, Headd JJ, Keedy DA, Immormino RM, Kapral GJ, Murray LW, Richardson JS, Richardson DC (January 2010). “MolProbity: all-atom structure validation for macromolecular crystallography” . Acta Crystallographica. Section D, Biological Crystallography 66 (Pt 1): 12–21. doi :10.1107/S0907444909042073 . PMC 2803126 . PMID 20057044 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2803126/ . ^ Bower MJ, Cohen FE, Dunbrack RL (April 1997). “Prediction of protein side-chain rotamers from a backbone-dependent rotamer library: a new homology modeling tool”. Journal of Molecular Biology 267 (5): 1268–82. doi :10.1006/jmbi.1997.0926 . PMID 9150411 . ^ Voigt CA, Gordon DB, Mayo SL (June 2000). “Trading accuracy for speed: A quantitative comparison of search algorithms in protein sequence design”. Journal of Molecular Biology 299 (3): 789–803. doi :10.1006/jmbi.2000.3758 . PMID 10835284 . ^ Krivov GG, Shapovalov MV, Dunbrack RL (December 2009). “Improved prediction of protein side-chain conformations with SCWRL4” . Proteins 77 (4): 778–95. doi :10.1002/prot.22488 . PMC 2885146 . PMID 19603484 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2885146/ . ^ Battey JN, Kopp J, Bordoli L, Read RJ, Clarke ND, Schwede T (2007). “Automated server predictions in CASP7”. Proteins 69 Suppl 8 (Suppl 8): 68–82. doi :10.1002/prot.21761 . PMID 17894354 .
Majorek K, Kozlowski L, Jakalski M, Bujnicki JM (December 18, 2008). “Chapter 2: First Steps of Protein Structure Prediction” . In Bujnicki, J. Prediction of Protein Structures, Functions, and Interactions . John Wiley & Sons, Ltd.. pp. 39–62. doi :10.1002/9780470741894.ch2 . ISBN 9780470517673 . ftp://genesilico.pl/lukaskoz/pdfs/Majorek.pdf Baker D, Sali A (October 2001). “Protein structure prediction and structural genomics”. Science 294 (5540): 93–6. Bibcode : 2001Sci...294...93B . doi :10.1126/science.1065659 . PMID 11588250 . Kelley LA, Sternberg MJ (2009). “Protein structure prediction on the Web: a case study using the Phyre server” . Nature Protocols 4 (3): 363-371. doi :10.1038/nprot.2009.2 . hdl :10044/1/18157 PMID 19247286 . https://doi.org/10.1038/nprot.2009.2 . Kryshtafovych A, Fidelis K (April 2009). “Protein structure prediction and model quality assessment” . Drug Discovery Today 14 (7–8): 386-393. doi :10.1016/j.drudis.2008.11.010 . PMC 2808711 . PMID 19100336 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2808711/ . Qu X, Swanson R, Day R, Tsai J (June 2009). “A guide to template based structure prediction”. Current Protein & Peptide Science 10 (3): 270-285. doi :10.2174/138920309788452182 . PMID 19519455 . Daga PR, Patel RY, Doerksen RJ (2010). “Template-based protein modeling: recent methodological advances” . Current Topics in Medicinal Chemistry 10 (1): 84–94. doi :10.2174/156802610790232314 . PMC 5943704 . PMID 19929829 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5943704/ . Fiser, A. (2010). “Template-based protein structure modeling”. Computational Biology . Methods in Molecular Biology. 673 . pp. 73–94. doi :10.1007/978-1-60761-842-3_6 . ISBN 978-1-60761-841-6 . PMC 4108304 . PMID 20835794 Cozzetto D, Tramontano A (December 2008). “Advances and pitfalls in protein structure prediction”. Current Protein & Peptide Science 9 (6): 567–77. doi :10.2174/138920308786733958 . PMID 19075747 . Nayeem A, Sitkoff D, Krystek S (April 2006). “A comparative study of available software for high-accuracy homology modeling: from sequence alignments to structural models” . Protein Science 15 (4): 808–24. doi :10.1110/ps.051892906 . PMC 2242473 . PMID 16600967 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2242473/ .