α2 -マクログロブリン (英 : alpha-2-Macroglobulin 、略称: α2M)は、血液 中に存在する巨大(720 kDa )な血漿タンパク質 である。主に肝臓 で産生されるが、マクロファージ 、線維芽細胞 、副腎皮質 細胞でも局所的な合成が行われる。ヒトではA2M 遺伝子 にコードされる。
α2 -マクログロブリンは抗プロテアーゼ機能を持ち、きわめて多様なプロテアーゼ を不活性化することができる。プラスミン やカリクレイン を阻害し、線維素溶解 (英語版 ) トロンビン を阻害し、血液凝固 の阻害因子としても機能する[ 5] 2 -マクログロブリンは、血小板由来成長因子 (PDGF)や塩基性線維芽細胞増殖因子 (bFGF)、TGF-β 、インスリン 、IL-1β など、多数の成長因子 やサイトカイン と結合し、これらの生物学的活性に影響を与えている可能性がある[ 6]
疾患と関係した特異的な欠乏症や、α2 -マクログロブリンが低濃度となることが原因となる疾患も知られていない。ネフローゼ症候群 において、他の低分子量タンパク質が尿 中へ失われた際、α2 -マクログロブリンの濃度は増加する。α2 -マクログロブリンはサイズが大きいため尿中への喪失を免れ、膠質浸透圧 の維持に寄与している[ 7]
ヒトのα2 -マクログロブリンはジスルフィド結合 で連結された4つの同一サブユニットから構成される[ 8] [ 9] 2 -マクログロブリンに加えて、二量体型、さらに近年では単量体型のものも同定されている[ 10] [ 11]
ヒトのα2 -マクログロブリンの各単量体は、マクログロブリンドメイン(macroglobulin domain)、チオエステル 含有ドメイン(thiol ester-containing domain)、受容体結合ドメイン(receptor-binding domain)など、いくつかの機能的ドメインから構成される[ 12] 2 -マクログロブリンはヒトの血漿中に存在する主要な非イムノグロブリン タンパク質の中で最大である。
α2 -マクログロブリンのアミノ酸配列は、PZP (pregnancy zone protein)と71%同一であることが示されている[ 13]
αマクログロブリン(αM)ファミリーのタンパク質には、ヒトの四量体型α2 -マクログロブリンに代表されるプロテアーゼ阻害因子が含まれる[ 14] アミン とチオエステルとの反応によって阻害能力が不活性化される、といった定義となる共通したいくつかの性質が存在する。αMファミリーのプロテアーゼ阻害因子は、立体障害によって阻害を行う[ 15] 活性部位 は立体的に遮蔽されており、そのためタンパク質基質へのアクセスが大幅に低下する。ベイト領域の切断後にはさらに2つのイベント、すなわち (i) 分子内のシステイン とグルタミン酸 の間のチオエステル結合の開裂と (ii) 保存されたC末端の受容体結合ドメインを露出させる大きなコンフォメーション変化が生じる[ 16] [ 17]
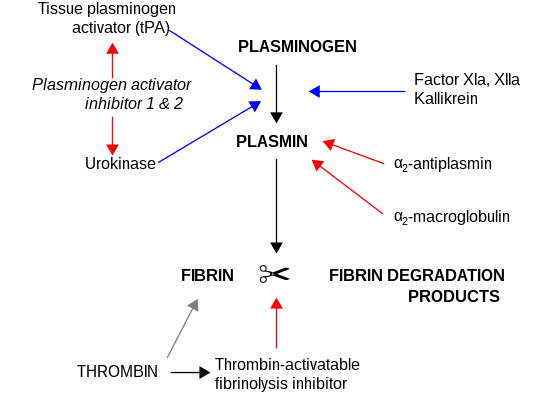
α2 -マクログロブリンは膨大な種類のプロテイナーゼ(セリンプロテアーゼ 、システインプロテアーゼ 、アスパラギン酸プロテアーゼ 、メタロプロテアーゼ を含む)を不活性化することができる。プラスミンやカリクレインを阻害し、線維素溶解の阻害因子として機能する。トロンビンを阻害し、血液凝固の阻害因子としても機能する[ 5] 2 -マクログロブリンには35アミノ酸からなるベイト領域が存在する。ベイト領域に結合し切断を行うプロテイナーゼはα2 -マクログロブリンに結合するようになり、α2M-プロテアーゼ複合体は受容体に認識されて系から除去される。
線維素溶解の間略図。青い矢印は促進を、赤い矢印は阻害を示している。 α2 -マクログロブリンは血漿中で亜鉛 や銅 を結合することが知られている。その結合はアルブミン よりも強く、トランスクプレイン (transcuprein)という名称でも知られている[ 18] 2 -マクログロブリンによってキレート されている[ 19]
α2 -マクログロブリンのレベルは血清アルブミンのレベルが低下した時に上昇する[ 7] 2 -マクログロブリンはサイズが大きく血流に保持されるため、すべてのタンパク質の産生が増大することでα2 -マクログロブリンの濃度は上昇する。この濃度上昇が健康に与える悪影響はほとんど存在しないが、診断のための手がかり[ 20] [ 21]
α2 -マクログロブリンで一般的にみられる多型 (29.5%)は、アルツハイマー病 のリスクを高める[ 22] [ 23]
^ a b c GRCh38: Ensembl release 89: ENSG00000175899 - Ensembl , May 2017
^ a b c GRCm38: Ensembl release 89: ENSMUSG00000030111 - Ensembl , May 2017
^ Human PubMed Reference: ^ Mouse PubMed Reference: ^ a b “Alpha-2-macroglobulin functions as an inhibitor of fibrinolytic, clotting, and neutrophilic proteinases in sepsis: studies using a baboon model” . Infect. Immun. 61 (12): 5035–43. (December 1993). PMC 281280 . PMID 7693593 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC281280/ .
^ Rehman, Ahmed A.; Ahsan, Haseeb; Khan, Fahim H. (2013-08). “α-2-Macroglobulin: a physiological guardian” . Journal of Cellular Physiology 228 (8): 1665–1675. doi :10.1002/jcp.24266 . ISSN 1097-4652 . PMID 23086799 . https://www.ncbi.nlm.nih.gov/pubmed/23086799 . ^ a b Stevenson, FT; Greene, S; Kaysen, GA (January 1998). “Serum alpha 2-macroglobulin and alpha 1-inhibitor 3 concentrations are increased in hypoalbuminemia by post-transcriptional mechanisms.”. Kidney International 53 (1): 67–75. doi :10.1046/j.1523-1755.1998.00734.x . PMID 9453001 .
^ “Low resolution X-ray structure of human methylamine-treated alpha 2-macroglobulin”. J. Biol. Chem. 270 (42): 25133–41. (October 1995). doi :10.1074/jbc.270.42.25133 . PMID 7559647 . ^ “Primary structure of human alpha 2-macroglobulin. V. The complete structure.”. J Biol Chem 259 (13): 8318–27. (1984). PMID 6203908 . ^ “The phylogeny and evolution of the thioester bond-containing proteins C3, C4 and alpha 2-macroglobulin”. Immunol. Rev. 166 : 15–26. (December 1998). doi :10.1111/j.1600-065X.1998.tb01249.x . PMID 9914899 . ^ “Alpha2-macroglobulin: an evolutionarily conserved arm of the innate immune system”. Dev. Comp. Immunol. 23 (4–5): 375–90. (1999). doi :10.1016/s0145-305x(99)00018-x . PMID 10426429 . ^ “Human alpha2-macroglobulin is composed of multiple domains, as predicted by homology with complement component C3.” . Biochem J 407 (1): 23–30. (2007). doi :10.1042/BJ20070764 . PMC 2267405 . PMID 17608619 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2267405/ . ^ Devriendt, K.; Van den Berghe, H.; Cassiman, J. J.; Marynen, P. (1991-01-17). “Primary structure of pregnancy zone protein. Molecular cloning of a full-length PZP cDNA clone by the polymerase chain reaction” . Biochimica Et Biophysica Acta 1088 (1): 95–103. doi :10.1016/0167-4781(91)90157-h . ISSN 0006-3002 . PMID 1989698 . https://www.ncbi.nlm.nih.gov/pubmed/1989698 . ^ Sottrup-Jensen L (July 1989). “Alpha-macroglobulins: structure, shape, and mechanism of proteinase complex formation”. J. Biol. Chem. 264 (20): 11539–42. PMID 2473064 . ^ “Proteinase binding and inhibition by the monomeric alpha-macroglobulin rat alpha 1-inhibitor-3”. J. Biol. Chem. 264 (19): 11428–35. (July 1989). PMID 2472396 . ^ “A conserved region in alpha-macroglobulins participates in binding to the mammalian alpha-macroglobulin receptor”. Biochemistry 28 (3): 1406–12. (February 1989). doi :10.1021/bi00429a069 . PMID 2469470 . ^ “Human pregnancy zone protein and alpha 2-macroglobulin. High-affinity binding of complexes to the same receptor on fibroblasts and characterization by monoclonal antibodies”. J. Biol. Chem. 261 (35): 16622–5. (December 1986). PMID 2430968 . ^ Liu, Nanmei; Lo, Louis Shi-li; Askary, S. Hassan; Jones, LaTrice; Kidane, Theodros Z.; Nguyen, Trisha Trang Minh; Goforth, Jeremy; Chu, Yu-Hsiang et al. (September 2007). “Transcuprein is a macroglobulin regulated by copper and iron availability” . The Journal of Nutritional Biochemistry 18 (9): 597–608. doi :10.1016/j.jnutbio.2006.11.005 . PMC 4286573 . PMID 17363239 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4286573/ . ^ Liu, Nan-mei; Nguyen, Trang; Kidane, Theodros; Moriya, Mizue; Goforth, Jeremy; Chu, Andy; Linder, Maria (6 March 2006). “Transcupreins are serum copper-transporters of the macroglobulin family, and may be regulated by iron and copper” (英語). The FASEB Journal 20 (4): A553–A554. doi :10.1096/fasebj.20.4.A553-d . ISSN 0892-6638 . http://www.fasebj.org/doi/abs/10.1096/fasebj.20.4.A553-d . ^ “α2-マクログロブリン ”. primary-care.sysmex.co.jp . 2020年4月18日 閲覧。 ^ “蛋白分画の検査と臨床的意義 ”. 広島市医師会. 2020年4月8日 閲覧。 ^ “Alpha-2 macroglobulin is genetically associated with Alzheimer disease”. Nat. Genet. 19 (4): 357–60. (August 1998). doi :10.1038/1243 . PMID 9697696 . ^ Kovacs DM (July 2000). “alpha2-macroglobulin in late-onset Alzheimer's disease”. Exp. Gerontol. 35 (4): 473–9. doi :10.1016/S0531-5565(00)00113-3 . PMID 10959035 .
McPherson & Pincus: Henry's Clinical Diagnosis and Management by Laboratory Methods, 21st ed.
Firestein: Kelley's Textbook of Rheumatology, 8th edition.