|
Tiirano
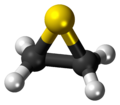
Il tiirano, più comunemente conosciuto come solfuro di etilene, è un composto organico solforato (o zolforganico), cioè un composto organico contenente legami carbonio-zolfo, eterociclico avente formula C2H4S, o anche (CH2)2S.[2] Esso è in particolare il più semplice dei composti eterociclici contenenti zolfo nell'anello ed il più semplice degli episolfuri,[3] composti isoelettronici di valenza degli epossidi. In condizioni standard il tiirano si presenta come un liquido incolore, volatile e infiammabile;[4] come molti altri composti organici solforati, emana un forte odore sgradevole. Con il nome di tiirani si descrivono oggi tutti i derivati del solfuro di etilene. Proprietà e struttura molecolareIl solfuro di etilene è un composto endotermico (ΔHƒ° = +52±1 kJ/mol),[5] ma cineticamente è abbastanza stabile, anche se ha una certa tendenza alla polimerizzazione e non si può conservare per lungo tempo.[2] È solubile in acetone e cloroformio, ma poco solubile in alcool ed etere[4] ed è praticamente insolubile in acqua, a differenza dell'ossido di etilene, suo isoelettronico.[6] Lo scheletro della molecola è un triangolo isoscele con l'atomo di zolfo al vertice e i carboni alla base, legati ciascuno a due idrogeni; ne risulta una simmetria molecolare C2v.[7] La molecola è polare, il suo momento di dipolo,1,84 D,[8] è quasi uguale a quello dell'acqua (1,86 D) e dell'ossido di etilene (1,89 D). Da indagini spettroscopiche rotazionali nella regione delle microonde è stato possibile ricavare i parametri strutturali (lunghezze ed angoli di legame) della molecola del solfuro di etilene in fase gassosa:[9] r(C–C)) = 148,4 pm; r(C–H) = 108,3 pm; r(C–S) = 181,5 pm; ∠(HCH) = 115,8°; ∠(CSC) = 48,27°; ∠(CCS) = 65,865°; ∠(HCC) = 117,926°. Mentre i legami C–H hanno lunghezza praticamente normale (109 pm[10]), il legame C–C è significativamente più corto del normale (154 pm[10]) per atomi C ibridi sp3 e i legami C–S sono un po' più lunghi del normale (182 pm[10]). Gli angoli interni all'anello differiscono alquanto dai 60° di un triangolo equilatero: come si può vedere, gli angoli su C sono un po' più ampi, mentre quello su S non arriva neanche a 50°. L'angolo tra gli idrogeni geminali (115,8°) è più vicino a quello che ci si attenderebbe per un C sp2 (120°), che per un C sp3 (109,5°). L'anello del tiirano, come altri anelli a tre termini, è in tensione: tensione angolare per gli angoli di legame molto diversi da quelli ottimali, e tensione torsionale per il fatto che gli idrogeni sono tutti eclissati. La tensione complessiva è stata stimata in 17,62 kcal/mol.[11][2] SintesiIl tiirano si ottiene dalla reazione del carbonato di etilene con il tiocianato di potassio (KSCN); questo sale, che è igroscopico, viene prima fatto fondere sotto vuoto onde rimuoverne l'acqua assorbita:[12]
Un'altra sintesi del tiirano si basa sulla reazione in soluzione acquosa, a freddo, della tiourea con l'ossido di etilene, che la trasforma in urea:[13]
UtilizziIl tiirano viene spesso aggiunto alle ammine per ottenere le 2-mercaptanoetilammine,[14] che sono ottimi composti chelanti:
Il tiirano è stato sperimentato anche nella modifica del chitosano assieme all'acrilato di metile e alla cisteamina, per sintetizzare un biopolimero in grado di immobilizzare e rilasciare in maniera controllata l'ibuprofene, un farmaco antinfiammatorio non steroideo.[15] Note
Voci correlateAltri progetti
Collegamenti esterni
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia