|
Eukaryogenese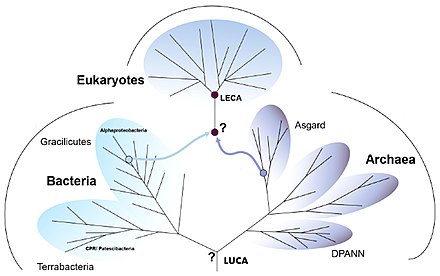 Eukaryogenese bezeichnet den Prozess, der zur Entstehung der eukaryotischen Zelle an der Wurzel des Stammbaums der Eukaryoten als komplex-zellulären Organismen geführt hat. Da die Eukaryoten alle komplex aufgebauten Einzeller und (fast) alle mehrzelligen Organismen umfassen, ist die Eukaryogenese ein Meilenstein in der Evolution. Es herrscht weitgehend Einigkeit darüber, dass es sich bei diesem Prozess um eine Symbiogenese handelte, bei der bestimmte Archaeen und Bakterien zusammenkamen, um den ersten gemeinsamen eukaryotischen Vorfahren (englisch first eukarotic common ancestor, FECA) zu schaffen. Diese Zelle verfügte nach gängigen Vorstellungen über ein neues Maß an Komplexität und Fähigkeiten, unter anderem mit einem Zellkern, mindestens einer Zentriole, fakultativ aeroben Mitochondrien, Sexualität und einer Zellwand. Sie entwickelte sich zunächst zu einer Population von Einzellern, zu der auch der letzte gemeinsame Vorfahre der Eukaryoten (engl. last eukaryotic common ancestor, LECA) gehörte, und erlangte im Laufe der Entwicklung weitere Fähigkeiten. Die Reihenfolge der an diesem Prozess beteiligten Schritte ist allerdings noch umstritten, möglicherweise hat dieser auch nicht mit der Symbiogenese begonnen. Aus dem LECA wiederum ging die Kronengruppe der Eukaryoten hervor, die die Vorfahren von Tieren, Pilzen, Pflanzen und einer Vielzahl von Einzellern umfasst. HintergrundNachdem sich die Erde so weit abgekühlt hatte, dass sich Ozeane gebildet hatten, konnte das Leben entstehen (siehe Chemische Evolution). Der letzte gemeinsame Vorfahr oder Ahn aller heutigen Lebewesen (LUGA, engl. last universal common ancestor, LUCA) war ein Organismus, der einige allen Lebewesen gemeinsame Eigenschaften vereinigte, insbesondere Ribosomen und den genetischen Code zur Erzeugung von Proteinen nach Muster von Nukleinsäuren (RNA); er lebte vermutlich vor etwa 4 Milliarden Jahren. Aus ihm entstanden zwei Hauptzweige (Domänen) des prokaryotischen Lebens, die Bakterien und die Archaeen. Aus diesen kleinzelligen, sich oft schnell teilenden Vorfahren entwickelten sich mit der Zeit die Eukaryoten mit viel größeren Zellen, Zellkernen und einer ausgeprägten Biochemie (Stoffwechsel).[1][2] Nach einer Auffassung bilden die aus dem Zusammenschluss von Archaeen und Bakterien hervorgegangenen „chimären“ Eukaryoten eine neue, dritte Domäne.[3][4] Andere Vorschläge betonen, dass die Eukaryoten mitten aus den Asgard-Archaeen hervorgegangen sind. Damit diese und die Archaeen insgesamt nicht zu paraphyletische Gruppen werden, sollten die Eukaryoten den Asgard-Archaeen zugeordnet werden, genauso, wie die Vögel den Dinosauriern, von denen sie abstammen.[5] Siehe dazu Urvorfahr: Zwei oder drei Domänen. Symbiogenese  MAnc: gemeinsamer Vorfahre der Mitochondrien und ihrer nächsten Verwandtschaft (Alphaproteobakterien). AAnc: gemeinsamer Vorfahre der eukaryotischen Wirtslinie und ihrer nahen Verwandtschaft (Asgard-Archaeen bzw. ihrer Untergruppe Hodarchaeales). PAnc: gemeinsamer Vorfahre der Plastiden (Chloroplasten) und ihrer nächsten Verwandtschaft (Cyanobakterien: Oxyphotobacteria). Nach der von Lynn Margulis zum Durchbruch verholfenen Theorie der Symbiogenese (auch bekannt als Endosymbiontentheorie) verleibte sich ein Mitglied der Archaeen eine Bakterienzelle als Bestandteil ein, ohne diese zu verdauen (siehe Eozyten-Hypothese). Das Bakterium gehörte zu Alphaproteobakterien (unter diesen früher favorisierte Ordnung: Rickettsiales, seit 2023: Iodidimonadales) mit der Fähigkeit Sauerstoff für ihre Atmung zu nutzen. Dies ermöglichte ihm – und damit den Archaeen, die es aufgenommen hatten – das Überleben in Gegenwart von Sauerstoff, denn dieser ist für andere, an reduzierende Bedingungen angepasste (gärende) Organismen giftig. Die endosymbiotischen Bakterien wurden zu den Mitochondrien der eukaryotischen Zelle und lieferten den größten Teil der Energie dieser Zellen.[1][6][8][9] Einen ähnlichen Verschmelzungsprozess, aber mit anderen Stoffwechseldetails, haben William F. Martin und Miklós Müller 1998 vorgeschlagen (Wasserstoff-Hypothese, engl. hydrogen hypothesis).[10] Die Syntrophie-Hypothese betont den Austausch von Stoffwechselprodukten zwischen den Verschmelzungspartnern; ein zusätzlicher Beitrag von Deltaproteobakterien könnte zur Zellmembran der Eukaryoten geführt haben.[11] Nach heutiger Ansicht war die Archaeen-Zelle ein Mitglied der inzwischen entdeckten Asgard-Archaeen und in jüngerer Zeit wurde unter diesen wiederum die Heimdallarchaeen mit ihrer Ordnung Hodarchaeales als die nächste derzeit (Stand 2023) bekannten Verwandten der Eukaryoten identifiziert.[12][5] Eine zweite Fusion vor 1,6 Milliarden Jahren fügte aus Cyanobakterien hervorgegangene Chloroplasten hinzu und schuf so die grünen Pflanzen.[6][13] Lynn Margulis und Kollegen vermuteten darüber hinaus, dass die Zelle auch ein Spirochäten-Bakterium als Symbionten erwarb, das ihr das Zellskelett aus Mikrotubuli und die Fähigkeit zur Bewegung verlieh, einschließlich der Fähigkeit, die Chromosomen während der Mitose, der Zellteilung, in zwei Sätze zu zerlegen.[13] Im Gegensatz zu den beiden anderen Teilen der Endosymbiosetheorie konnte diese Vermutung (bislang) jedoch nicht bestätigt werden. Letzter eukaryotischer gemeinsamer Ahn (LECA) Der letzte gemeinsame Vorfahr oder Ahn aller heutigen Eukaryoten wird in Analogie zum LUCA als Last Eukaryotic Common Ancestor (LECA) bezeichnet.[15] Er lebte vor etwa 2 Milliarden Jahren und umfasste sehr wahrscheinlich eine ganze Population.[16] Es wird angenommen, dass es sich um einen Protisten mit einem Zellkern, mindestens einer Zentriole und einem Cilium, fakultativ aeroben Mitochondrien, Sexualität (Meiose und Syngamie), einer Ruhezyste mit einer Zellwand aus Chitin und/oder Zellulose und Peroxisomen gehandelt hat.[17][18] Falls der Erwerb des Zellkerns dem der Mitochondrien vorausging, muss es zeitweilig amitochondriale Organismen mit Zellkern gegeben haben, die im Laufe ihrer Evolution dann die Mitochondrien durch Endosymbiose erworben haben (siehe Endosymbiontentheorie). Carl Woese und George Fox führten 1977 für diese hypothetischen Formen von „primitiven“ amöboiden prädatorischen Einzellern den Begriff Urkaryoten (engl. urkaryotes) ein.[19] Diese Urkaryoten galten dann als Begründer der dritten Domäne der Eukaryoten, zu der alle komplexen Zellen (Protisten) und die meisten Arten von mehrzelligen Organismen, einschließlich der Tiere, Pflanzen und Pilze gehören. Thomas Cavalier-Smith führt dann 1989 rezente (heutige) primitive einzellige Eukaryoten ohne Mitochondrien – unter der Annahme, diese seien Abkömmlinge dieser Urkaryoten – die Gruppenbezeichnung Archezoa ein.[20] Allerdings mehrten sich nachfolgend Hinweise darauf, dass es sich bei den Archezoen um sekundär amitochondriale echte Eukaryoten handelt.[21] Zudem werden die Vorfahren der Eukaryoten heute mitten unter den Archaeen verortet und nicht mehr als primitive Urkaryoten abseits von diesen. Alle bis heute untersuchten Eukaryoten besitzen einen vom Zytoplasma durch eine Kernmembran abgegrenzten Zellkern. Darüber hinaus findet man bei fast allen Eukaryoten Mitochondrien oder Organellen (Hydrogenosom, Mitosom, MLO etc.), die offensichtlich von Mitochondrien abstammen oder mit diesen einen gemeinsamen Vorfahren haben (engl. mitochondrion-related organelles, MROs). Diese Organellen besitzen meist ihre eigene, mitochondriale DNA (mtDNA). Zumindest ließen sich überall – auch bei den wenigen amitochondrialen Eukaryoten – in der Zellkern-DNA Gene mitochondrialen Ursprungs nachweisen. Diese wurden im Lauf der Evolution durch „endosymbiotischen Gentransfer“ (eine Sonderform des lateralen Gentransfers) von heute reduzierten oder ganz verschwundenen Mitochondrien zum Kern transferiert.[22][23] Es konnten somit – bisher – keine „primär amitochondrialen“ Eukaryoten gefunden werden. Daher sollte LECA bereits einen Zellkern und mitochondrienartige Organellen (mit eigener mtDNA) besessen haben. Brian S. Leander sowie Jürgen F. H. Strassert et al. hatten 2020/2021 vorgeschlagen, dass sich der LECA durch Phagozytose ernährte und andere Mikroorganismen verschlang.[17][18] Nico Bremer et al. konnten jedoch 2022 Belege dafür finden, dass LECA Mitochondrien besaß. Sie vermuteten, dass LECA als Coenocyt über mehrere Kerne verfügte, glaubten jedoch nicht, dass er phagotroph war. Die bei vielen Eukaryoten vorhandene Fähigkeit, (organisches) Material zu verschlingen, hätte sich nach dieser Ansicht erst später entwickelt. Phagocytose hätte daher nicht zum Erwerb der Alphaproteobakterien (als Vorläufer der Mitochondrien) genutzt werden können.[24] Für LECA wird eine „spektakulären zellulären Komplexität“ vermutet, und diese Zellen waren in Kompartimente unterteilt.[25] Es scheint eine Reihe von Proteinen der Endosomalen Sortierkomplexe für den Transport (englisch endosomal sorting complexes required for transport), ESCRT, geerbt zu haben, die es ermöglichen, Membranen umzugestalten, einschließlich der Abtrennung von Vesikeln zur Bildung von Endosomen.[26] Sein Apparat für die Transkription von DNA in RNA und die anschließende Übersetzung (Translation) der RNA in Proteine war räumlich voneinander getrennt, so dass die Expression von Genen komplexer werden konnte. Es verfügte über Mechanismen, mit denen es sein genetisches Material umordnen und möglicherweise seine eigene Evolutionsfähigkeit manipulieren konnte. All dies verschaffte LECA „ein umfassendes Bündel an Selektionsvorteilen“.[25] SzenarienFür die Entstehung der Eukaryoten wurden mehrere Szenarien vorgeschlagen. Es besteht zwar weitgehend Einigkeit darüber, dass der LECA einen Zellkern, Mitochondrien und innere Membranen gehabt haben muss, doch die Reihenfolge, in der diese erworben wurden, wird diskutiert. Nach dem syntrophen Modell erhielt der erste gemeinsame eukaryotische Vorfahr (FECA, vor etwa 2,2 Milliarden Jahren) Mitochondrien, dann Membranen und schließlich einen Zellkern. Nach dem phagotrophen Modell erhielt er zuerst einen Zellkern, dann Membranen und schließlich Mitochondrien. Das phagotrophe Modell setzt die Fähigkeit voraus, Nahrung zu verschlingen, was die Zelle in die Lage versetzte, das aerobe Bakterium zu verschlingen, aus dem das Mitochondrium wurde.[25] In einem komplexeren Prozess erlangte LECA alle drei Komponenten innerhalb vergleichsweise kurzer Zeit, und erst danach weitere Fähigkeiten. Daneben wurden auch noch andere Modelle vorgeschlagen. Was auch immer geschah, es dürften zunächst viele Abstammungslinien entstanden sein, so dass LECA zunächst mit diesen konkurrierte – oder verschiedene Linien schlossen sich zusammen, um einen einzigen Ausgangspunkt für die heutigen Eukaryoten zu bilden.[25] Nick Lane und William F. Martin argumentierten mit der Begründung, dass Energie ein begrenzender Faktor für die Größe der prokaryotischen Zelle war, dafür, dass die Mitochondrien zuerst erworben wurden.[27] Eugene V. Koonin et al. (2005), sowie Joran Martijn und Thijs J. G. Ettema (2013) stellten fest, dass die Archaeen (insbesondere aus der Asgard-Gruppe) viele gemeinsame Merkmale mit Eukaryoten haben. Daher schlugen sie vor, dass rudimentäre eukaryotische Merkmale wie membranartige Kompartimente bereits erworben wurden, bevor die Endosymbiose der frühen eukaryotischen Zelle Mitochondrien hinzufügte, während die Zellwand verloren ging. Der Erwerb der Mitochondrien darf aber so oder so nicht als das Ende des Eukaryogenese-Prozesses angesehen werden, denn nach oder während des endosymbiotischen Verschmelzens mussten noch etliche neue komplexe Genfamilien entwickelt werden. Die Organismen dem Weg vom FECA zum LECA können daher als Protoeukaryoten betrachtet werden. Am Ende des Prozesses war LECA bereits ein komplexer Organismus mit den zellulären Kompartimentierung beteiligten Proteinfamilien.[28][29] E3-Modell der EukaryogeneseDer Stamm (en. strain) MK-D1 von Prometheoarchaeum syntrophicum hat ebenso wie der 2022 kultivierte Stamm B-35 von Lokiarchaeum ossiferum[30] lange „Tentakel“, in denen Partnermikroben (Bakterien) nisten und die ihm womöglich als „Protomitochondrien“ verbesserte Überlebenschancen bei steigendem Sauerstoff ermöglichen. Nach dem E3-Modell der Eukaryogenese konnten so Bakterien als Vorfahren der Mitochondrien umschlossen und endogenisiert wurden.[31][32][33][34] Virale EukaryogeneseVirale Eukaryogenese ist die Bezeichnung einer Hypothese, nach der sich der Zellkern eukaryotischer Lebensformen aus einem großen DNA-Virus in im Zuge einer Endosymbiose in einem methanogenen Archaeon oder einem Bakterium entwickelt hat. Die Hypothese wurde mit dieser Bezeichnung erstmal von Philip John Livingstone Bell 2001 vorgeschlagen[35] Um 2005/2006 schlugen Forscher um Jean-Michel Claverie und Patrick Forterre darüber hinausgehend vor, dass der Übergang von RNA- zu DNA-Genomen zuerst in der Welt der Viren (Virosphäre) stattgefunden hat.[36][37][38] Im Einklang mit der RNA-Welt-Hypothese hätten zelluläre Organismen danach zunächst als sog. Ribozyten (oder Ribozellen) ihre Erbinformation in einem RNA-Genom gespeichert. Ein DNA-basiertes Virus könnte dann von einem Ribozyten-Wirt dazu befähigt haben, seine Erbinformation künftig in der Form eines DNA-Genoms zu speichern, so wie dies heute bei allen bekannten zellulären Organismen der Fall ist.[39] Damit könnten Bakterien und Archaeen sich unabhängig voneinander aus Ribozellen entwickelt haben.[40] In der Originalarbeit war allerdings auch von einer Ribozelle als Vorfahr der Eukaryoten vermutet, wenn auch eine komplexere, fähig zur RNA-Verarbeitung. Da sie eine Entstehung der Eukaryoten unabhängig von den Archaeen postulierte, war sie noch im Einklang mit ursprünglichen Überlegungen von Carl Woese und George Fox aus dem Jahr 1977 (Urkaryoten).[19] Aber auch in dem in neuerer Zeit favorisierten Szenario, bei dem die Eukaryoten aus einer Gruppe der Asgard-Archaeen hervorgingen (Eozyten-Hypothese) könnten Viren einen entscheidenden Beitrag zur Eukaryogenese beigetragen zu haben (englisch out of virus hypothesis). Beispielsweise wurde vorgeschlagen, dass neben dem Zellkern auch die Telomerase und Telomere als Schlüsselaspekte der eukaryotischen Zellreplikation, viralen Ursprungs sind. Der virale Ursprung des modernen eukaryotischen Zellkerns könnte auf einer mehrfachen Infektion von Archaeen-Zellen, die bereits Bakterien als Mitochondrien-Vorläufer aufgenommen hatten, mit lysogenen Viren beruhen.[41] Um diese Hypothese zu belegen und den genauen Vorgang zu erforschen, sind allerdings noch weitere Studien an den Viren der Asgard-Archaeen nötig (Stand Mitte 2023). Ein Schlüssel zur Erforschung der Eukaryogenese konnte im Entwurf eines Stammbaums Chromatins und der eukaryotischen, archaealen und viralen[42] Histone liegen.[43] Syntrophie-HypotheseDie Syntrophie-Hypothese (zuerst vorgeschlagen von Purificación (Puri) López-García und David Moreira um das Jahr 2000), besagt, dass Eukaryoten durch die Kombination der Stoffwechselfähigkeiten eines Archaeons, eines fermentierenden Deltaproteobakteriums und eines methanotrophen Alphaproteobakteriums entstanden sind, wobei sich aus letzterem Mitochondrium entwickelte. Im April 2020 aktualisierte und konkretisierte dieses Team seinen Vorschlag auf ein Wasserstoff-produzierendes Asgard-Archäon und ein Schwefel-oxidierendes Deltaproteobakterium. Der dritte Organismus, das Alphaproteobakterium, soll in der Lage gewesen sein, sowohl aerob als auch anaerob zu atmen und Schwefel zu oxidieren. Dieses entwickelte sich wieder zum Mitochondrium, aber es war möglicherweise auch zur Photosynthese fähig.[44] Fossiler BelegDer LECA begründet die Kronengruppe der Eukaryoten (engl. crown eukaryotes, crown eukaryota). Zu ihnen gehören die Vorfahren von Tieren, Pilzen, Pflanzen und einer Vielzahl von Einzellern (Protisten) mit den neuen Fähigkeiten und der Komplexität der eukaryotischen Zelle.[45][46] Einzeller ohne Zellwände sind jedoch zerbrechlich und haben daher eine geringe Wahrscheinlichkeit, fossilisiert zu werden. Selbst wenn sie fossilisiert werden, weisen sie nur wenige Merkmale auf, die sie eindeutig von Prokaryoten unterscheiden: Größe, morphologische Komplexität und (schließlich) Vielzelligkeit (Zellkolonien). Zu den frühen Eukaryotenfossilien aus dem späten Paläoproterozoikum gehören Acritarcha-Mikrofossilien mit relativ robusten, verschnörkelten Kohlenstoffbläschen wie die Gattung Tappania vor 1,63 Milliarden Jahren oder Shuiyousphaeridium vor 1,8 Milliarden Jahren.[46] Etwas jünger sind die in einer ukrainischen Quarzmine bei Schytomyr gefundenen mutmaßlich eukaryotischen Volyn-Biota, sie sind etwa 1,5 Milliarden Jahre alt.[47] Weblinks
Einzelnachweise
|