|
Tioaseton
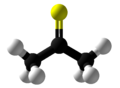
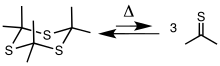
Tioaseton adalah sebuah senyawa organobelerang yang termasuk dalam golongan -tiona yang disebut tioketon, dengan rumus kimia (CH3)2CS. Ia adalah zat oranye atau coklat tak stabil yang dapat diisolasi hanya pada suhu rendah.[3] Di atas suhu −20 °C (−4 °F), tioaseton dapat dengan mudah berubah menjadi polimer dan trimer, tritioaseton.[4] Ia memiliki bau yang sangat kuat dan tak mengenakkan, serta dianggap sebagai salah satu bahan kimia berbau paling buruk yang dikenal manusia. Tioaseton pertama kali diperoleh pada tahun 1889 oleh Baumann dan Fromm, sebagai pengotor minor dalam sintesis tritioaseton mereka.[2] PersiapanTioaseton biasanya diperoleh melalui perengkahan trimer siklis tritioaseton, [(CH3)2CS]3. Trimer itu dibuat melalui pirolisis alil isopropil sulfida atau melalui reaksi antara aseton dengan hidrogen sulfida dengan adanya asam Lewis.[5][6] Trimer itu akan merengkah pada suhu 500–600 °C (932–1.112 °F) untuk menghasilkan tiona.[2][7][8] PolimerisasiTidak seperti analog oksigennya aseton, yang tak mudah berpolimerisasi, tioaseton secara spontan akan berpolimerisasi bahkan pada suhu yang sangat rendah, dalam bentuk murni atau yang telah larut dalam eter atau etilena oksida, menghasilkan padatan putih yang merupakan campuran beragam polimer linear ···–[C(CH3)2–S–]n–··· dan trimer siklik tritioaseton. Penyerapan inframerah dari produk ini terjadi terutama pada 2950, 2900, 1440, 1150, 1360, dan 1375 cm−1 karena pasangan metil geminal, serta pada 1085 dan 643 cm−1 karena ikatan C–S. Spektrum NMR 1H menunjukkan puncak tunggal pada x = 8,1.[2] Berat molekul rata-rata polimer tersebut bervariasi dari 2000 hingga 14000 tergantung pada metode pembuatan, suhu, dan keberadaan tautomer tioenol. Polimer itu melebur dalam kisaran sekitar 70 °C hingga 125 °C. Polimerisasi dipromosikan oleh cahaya dan radikal bebas.[2] Trimer siklik tioaseton (tritioaseton) adalah senyawa berwarna putih atau nirwarna dengan titik lebur 24 °C (75 °F), mendekati suhu kamar. Ia juga memiliki bau yang tak mengenakkan.[4] BauTioaseton memiliki bau yang sangat busuk. Seperti banyak senyawa organobelerang dengan berat molekul rendah lainnya, baunya sangat kuat dan dapat dideteksi bahkan ketika sangat encer.[9] Pada tahun 1889, upaya penyulingan bahan kimia di kota Freiburg, Jerman, diikuti oleh kasus mual, muntah-muntah, dan tak sadarkan diri di area dengan radius 0,75 kilometer (0,47 mi) di sekitar laboratorium akibat bau tersebut.[10] Dalam laporan tahun 1890, ahli kimia Inggris di Whitehall Soap Works di Leeds mencatat bahwa pengenceran tampaknya memperburuk bau dan menggambarkan baunya sebagai "menakutkan".[11] Tioaseton dianggap sebagai bahan kimia berbahaya karena baunya yang sangat busuk dan kemampuannya membuat orang tak sadarkan diri, menyebabkan muntah, dan terdeteksi dari jarak jauh. Pada tahun 1967, peneliti Esso mengulangi percobaan perengkahan tritioaseton, di sebuah laboratorium di selatan Oxford, Britania Raya. Mereka melaporkan pengalaman mereka sebagai berikut:
Lihat pula
Referensi
Pranala luar
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia