|
Metisilin
Metisilin adalah antibiotik spektrum sempit dari kelas penisilin. Metisilin ditemukan pada tahun 1960.[1] SejarahMetisilin dikembangkan oleh Beecham pada tahun 1959.[2] Sebelumnya digunakan untuk mengobati infeksi yang disebabkan oleh bakteri gram-positif yang rentan, khususnya penghasil penisilinase seperti Staphylococcus aureus yang mungkin resisten terhadap sebagian besar penisilin. Perannya dalam terapi sebagian besar telah digantikan oleh oksasilin (digunakan untuk uji kerentanan antimikroba klinis), flukloksasilin, dan dikloksasilin, namun istilah Staphylococcus aureus yang resisten terhadap metisilin (MRSA) terus digunakan untuk menggambarkan strain S. aureus yang resisten terhadap semua penisilin.[3] Kegunaan dalam medisDibandingkan dengan penisilin lain yang menghadapi resistansi antimikroba karena β-laktamase, penisilin ini kurang aktif, hanya dapat diberikan secara parenteral, dan memiliki frekuensi nefritis interstisial yang lebih tinggi, yang merupakan efek samping penisilin yang jarang terjadi. Namun, pemilihan metisilin bergantung pada hasil uji kerentanan sampel infeksi, dan karena sudah tidak diproduksi lagi, maka metisilin juga tidak diuji secara rutin lagi. Hal ini juga bertujuan di laboratorium untuk menentukan sensitivitas antibiotik Staphylococcus aureus terhadap penisilin lain yang menghadapi resistensi β-laktam; peran ini kini telah diteruskan ke penisilin lain, yaitu kloksasilin, serta pengujian genetik untuk mengetahui keberadaan gen mecA melalui PCR.[butuh rujukan] Spektrum aktivitasPada suatu waktu, metisilin digunakan untuk mengobati infeksi yang disebabkan oleh bakteri gram-positif tertentu termasuk Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pyogenes, dan Streptococcus pneumoniae. Metisilin hanya efektif melawan 50% Staphylococcus aureus saja. Resistensi terhadap metisilin terjadi melalui aktivasi gen mecA protein pengikat penisilin bakteri (PBP) yang baru. Ini mengkodekan protein PBP2a. PBP2a bekerja dengan cara yang mirip dengan PBP lainnya, namun PBP2a mengikat β-laktam dengan afinitas yang sangat rendah, yang berarti PBP2a tidak bersaing secara efisien dengan substrat alami enzim dan tidak akan menghambat biosintesis dinding sel. Ekspresi PBPA2 memberikan resistensi terhadap semua β-laktam.[butuh rujukan] Data kerentanan ini diberikan pada beberapa bakteri yang penting secara medis:
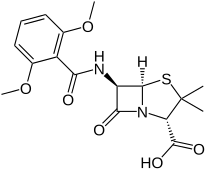
Mekanisme kerjaSeperti antibiotik beta-laktam lainnya, metisilin bekerja dengan menghambat sintesis dinding sel bakteri. Ini menghambat hubungan silang antara rantai polimer peptidoglikan linier yang membentuk komponen utama dinding sel bakteri gram positif. Hal ini dilakukan dengan mengikat dan menghambat secara kompetitif enzim transpeptidase (juga dikenal sebagai protein pengikat penisilin (PBP)). Glikopeptida pengikat silang PBP ini (D-alanil-alanin), membentuk dinding sel peptidoglikan. Metisilin dan antibiotik β-laktam lainnya merupakan analog struktural dari D-alanil-alanin, dan enzim transpeptidase yang mengikatnya terkadang disebut protein pengikat penisilin (PBP).[5] Metisilin sebenarnya adalah antibiotik β-laktam yang resisten terhadap penisilinase. Penisilinase adalah enzim bakteri yang diproduksi oleh bakteri yang resisten terhadap antibiotik β-laktam lainnya yang menghidrolisis antibiotik tersebut, sehingga menjadikannya tidak berfungsi. Metisilin tidak terikat dan dihidrolisis oleh penisilinase, artinya dapat membunuh bakteri, meskipun enzim ini ada. Kimia medisinalMetisilin resisten terhadap beta-laktamase, yaitu enzim yang disekresi oleh banyak bakteri yang resisten terhadap antibiotik beta-laktam. Kehadiran gugus orto-dimetoksifenil yang melekat langsung pada gugus karbonil rantai samping inti penisilin memfasilitasi resistensi β-laktamase, karena enzim tersebut relatif tidak toleran terhadap hambatan sterik rantai samping. Dengan demikian, ia mampu berikatan dengan PBP dan menghambat ikatan silang peptidoglikan, namun tidak terikat atau dinonaktifkan oleh β-laktamase.[butuh rujukan] Referensi
|
||||||||||||||||||||||||||||||||||||||||||||||||