|
Фульмінат срібла
Фульмінат срібла (гремуче срібло) - неорганічна сполука, сіль срібла фульмінової кислоти AgCNO. Фульмінат срібла є первинною вибуховою речовиною, але має обмежене використання, через його надзвичайну чутливість до удару, тепла, тиску та електрики. Сполука стає поступово чутливою, оскільки вона агрегується, навіть у невеликих кількостях; дотик падаючої пір’їнки, удар однієї краплі води або невеликий статичний розряд — усе це призводить до вибухової детонації необмеженої кількості фульмінату срібла розміром з дрібну монету та вагою не більше кількох міліграмів. Агрегування більших кількостей неможливо через схильність сполуки до самодетонації під власною вагою. Фульмінат срібла вперше було отримано 1800 року Едвардом Чарльзом Ховардом у його дослідницькому проєкті з отримання великої різноманітності фульмінатів. Разом із фульмінатом ртуті, це єдиний фульмінат, достатньо стабільний для комерційного використання. Детонатори, що використовують фульмінат срібла, використовувалися для ініціювання пікринової кислоти 1885 року, але з тих пір використовувалися лише ВМС Італії.[2] Сучасне комерційне використання було у виробництві нешкідливих новинок шумогенераторів дитячих іграшок. Структура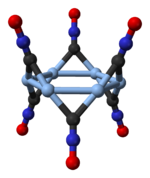 Фульмінат срібла зустрічається у двох поліморфних формах — ромбічній і тригональній з ромбоедричною решіткою.[3] Тригональний поліморф складається з циклічних гексамерів (AgCNO)6.[4] ВластивостіФульмінати токсичні приблизно так само, як ціаніди.[2] У чистому вигляді фульмінат срібла хімічно стабільний і не розкладається після багатьох років зберігання. Як і багато інших солей срібла, він темніє на світлі. Він малорозчинний у холодній воді і може бути перекристаллізований за допомогою гарячої води.[2][5] Його також можна перекристалізувати з 20% розчину ацетату амонію.[2] Він не гігроскопічний і може вибухнути у вологому стані або під водою; навіть після 37 років зберігання під водою він залишається вибухонебезпечним.[2] Він вибухає при контакті з концентрованою сульфатною кислотою, хлором або бромом, але не при контакті з йодом.[2] Він нерозчинний в нітратній кислоті, але розчиняється в аміаку, хлоридах та ціанідах лужних металів, аніліні, піридині та йодиду калію, утворюючи комплекси.[2] Концентрована хлоридна кислота розкладає його без вибуху з шипінням; тіосульфати також розкладають його без вибуху і можуть бути використані для утилізації.[2]  ОтриманняФульмінат срібла можна отримати шляхом вливання розчину нітрату срібла в нітратній кислоті в етанол під ретельним контролем умов реакції, щоб уникнути вибуху.[6] Реакцію зазвичай проводять при 80–90 °C; при 30 °C осад може не утворюватися.[2] За один раз слід готувати лише невелику кількість фульмінату срібла, оскільки власна вага кристалів може призвести до їх самодетонації. Інший спосіб отримання фульмінату срібла полягає у взаємодії карбонату срібла з розчиненим аміаком. 4Ag Гремуче срібло також утворюється, коли газоподібний оксид азоту пропускають через розчин нітрату срібла в етанолі.[2] Фульмінат срібла можна приготувати ненавмисно, при контакті кислого розчину нітрату срібла зі спиртом.[6] Це небезпека в деяких рецептурах хімічного сріблення дзеркал. Примітки
|
||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia

