|
Оцтовий ангідрид
О́цтовий ангідри́д, ангідри́д о́цтової кислоти́ — органічна сполука, представник ряду ангідридів карбонових кислот складу (CH3CO)2O. За звичайних умов є безбарвною рідиною із неприємним запахом та сльозогінною дією. При взаємодії з водою утворює оцтову кислоту. Вперше оцтовий ангідрид був синтезований французьким хіміком Шарлем Фредеріком Жераром у 1852 році шляхом взаємодії бензоїлхлориду із розплавленим ацетатом калію. Ангідрид широко використовується як агент ацилювання — для добування ацетилцелюлози, деяких лікарських засобів, вибухівки гексогену. Також він є складовою нітрувальних сумішей у виробництві барвників. Фізичні властивостіВін змішується із полярними розчинниками, розчиняється у воді, зазнаючи гідролізу, розчиняється у холодних спиртах із незначним розкладанням. Розкладання, яке каталізується мінеральними кислотами, веде до утворення оцтової кислоти.
Теплопровідність при 20 °C складає 2,209 мДж/(см·с·K).[6] ОтриманняІсторичні методи отриманняНайперші методи отримання оцтового ангідриду базувалися на взаємодії ацетатів лужних металів із надлишком агентів хлорування (SOCl2, POCl3). За цим методом половина вихідного ацетату утворює ацетилхлорид, який взаємодіє із іншою половиною, що ще не прореагувала: В подальшому був розробений метод синтезу ангідриду шляхом взаємодії оцтової кислоти із фосгеном (у присутності хлориду алюмінію): Сучасні методиОтримання з кетенуОтримання оцтового ангідриду за кетеновим процесом включає в себе дві стадії: термічне розкладання оцтової кислоти із утворенням кетену і його взаємодію з кислотою: Тепловий ефект реакції складає 147 кДж/моль. Розкладання пари кислоти відбувається при температурі 700–750 °C і тиску 15–20 кПа у присутності органічних похідних ортофосфатної кислоти (відіграють роль поглиначів вологи). Низький тиск сприяє підвищенню виходу продукту, але не ефективності процесу. На першій стадії методу мають місце також побічні реакції: Обладнання, що використовується для піролізу оцтової кислоти, не має містити нікелевмісних сплавів, оскільки нікель сприяє утворенню сажі і коксу (серйозна втрата у ефективності методу), а також взаємодіє із побічним монооксидом вуглецю, формуючи токсичні карбоніли. Після розкладання кислоти до піролізних газів додається аміак для запобігання взаємодії кетену із залишковою кислотою чи водою, після чого газова суміш охолоджується, оцтова кислота відокремлюється зрудженням, а кетен подається на газоочисник для подальшої взаємодії із кислотою за другим етапом. Окиснення етаналюСинтез оцтового ангідриду окисненням етаналю (оцтового альдегіду) відбувається у присутності каталізаторів і проходить через стадію утворення пероксооцтової кислоти. Реакції проводяться за температути 45–60 °C і тиску 100–300 кПа; каталізаторами є солі кобальту, міді, мангану (добавки солей мангану перешкоджають утворенню вибухонебезпечних кількостей пероксооцтової кислоти). Розчинниками можуть бути оцтова кислота або етилацетат. За необхідного тиску і температури 55–56 °C розкладання ацетальдегідпероксоацетату в присутності каталізатору (ацетатів кобальту і міді) відбувається майже кількісно. Також використовуються добавки солей марганцю для зниження вибухонебезпечності пероксооцтової кислоти. Через присутність води в реакційній суміші гідроліз ангідриду і, відповідно, втрати синтезу є невідворотними. Очистка кінцевого продукту є доволі легкою і проводиться шляхом дистиляції. Карбонілювання метилацетатуОтримання оцтового ангідриду шляхом карбонілювання метилацетату (метод Гелкона) було запатентоване у 1973 році, але застосоване у виробництві тільки у 1983. За цим методом метилацетат обробляється у рідкій фазі монооксидом вуглецю (парціальний тиск 2–5 МПа) при температурі 160–190 °C у присутності родієвого каталізатору: Вихідна сировина метилацетат може бути отримана естерифікацією оцтової кислоти метанолом, а також як побічний продукт у виробництві оцтової кислоти з метанолу та CO. Хімічні властивостіОцтовий ангідрид легко гідролізується водою, а також лугами:
Він бере участь у реакціях естерифікації спиртів, які проходять із труднощами у випадку оцтової кислоти. Також здатен ацилювати аміни (в тому числі третинні): Слабкою стороною використання оцтового ангідриду як агенту ацилювання є те, що лише половина молекули здійснює ацилювання, інша ж перетворюється на кислоту. Ангідрид здатен також ацилювати неорганічні кислоти, наприклад, фосфітну: При дії на нього пероксиду водню утворюється пероксооцтова кислота: ТоксичністьОцтовий ангідрид швидко проникає крізь шкіру, залишаючи серйозні опіки та пухирці, які важко піддаються лікуванню. Особливо небезпечною є його дія на чутливі ділянки тіла: очі, ніс, вуха, рот. Присутність ангідриду у повітрі за запахом відчувається при його концентрації вище 0,49 мг/м³, але очі отримують ушкодження вже при 0,36 мг/м³. До таких наслідків відносяться: сльозотеча, кон'юнктивіт, боязнь світла, ірит, опіки рогівки опіки з подальшою втратою зору. При використанні ангідриду у роботі обов'язковими є гумові рукавиці, щільні окуляри для захисту очей або маска, що закриватиме усе обличчя включно з вухами. ЗастосуванняОцтовий ангідрид використовується переважно як агентацилювання та осушувача. У великих масштабах ангідрид застосовується в ацилюванні целюлози, у синтезі лікарських засобів (ацетилсаліцилової кислоти, ацеклідину, омепразолу, теофіліну), для отримання вибухівки гексогену. Через потенційну можливість використання ангідриду для синтезу наркотику героїну, його обіг у деяких країнах, в тому числі і в Україні, є суттєво обмеженим. Так, постановою Кабінету Міністрів України оцтовий ангідрид віднесено до групи «прекурсори, обіг яких обмежено і стосовно яких встановлюються заходи контролю».[7] Див. такожПримітки
Джерела
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia

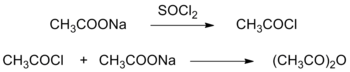













![{\displaystyle \mathrm {(CH_{3}CO)_{2}O+H_{3}PO_{3}\longrightarrow CH_{3}C(OH)[PO(OH)_{2}]_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2a53f75a791373888ddacebbe580ade7abf001e)
