Етилендіамінтетраоцтова кислота
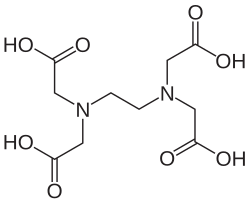
Етилендіамінтетраоцтова кислота (ЕДТА від англ. EDTA) — органічна сполука, чотириосновна карбонова кислота з хімічною формулою (HOOCCH2)2N(CH2)2N(CH2COOH)2, білий дрібнокристалічний порошок, малорозчинний у воді, не розчиняється в більшості органічних розчинників, розчинний у лугах, з катіонами металів утворює солі етилендіамінтетраацетат. Отримують шляхом конденсації етилендіаміна з монохлороцтовою кислотою. Застосовується як хелатувальний агент у різних галузях. Синоніми і скорочення: комплексон II.  ЗастосуванняЗастосовують ЕДТА у вигляді дигідрату двонатрієвої солі (комплексон III, трилон Б, Na2-ЕДТА) — у текстильній, шкіряній, паперовій, лакофарбовій промисловості, у виробництві металів, каучуку, у кольоровій кінематографії, для пом'якшення води. В аналітичній хімії ЕДТА дозволяє визначати більше 60 елементів. У медицині ЕДТА використовують для виведення з організму радіоактивних і токсичних металів, для консервації крові та ін. У токсикології кобальтові солі ЕДТА використовуються як антидот у разі отруєння синильною кислотою або хлорціаном. У стоматології використовується під час ендодонтичної обробки каналів зуба. Для підвищення ефективності проходження кореневого каналу він розм'якшує поверхневий дентин, зв'язуючи кальцій у хелати із тканин дентину. У фармацевтичних технологіях ЕДТА застосовують для посилення проникності ліків через слизові оболонк[1]. Також застосовується у сільському господарстві як добриво (так звані елементи у хелатній формі). Хелатна форма поживних елементів добре засвоюється рослинами, як у разі кореневого, так і листового підживлення[]. У молекулярній біології ЕДТА використовується в розчинах для зберігання ДНК, оскільки пригнічує дію багатьох металозалежних нуклеаз[]. Побічні й негативні дії ЕДТА ЕДТА проявляє низьку гостру токсичність при ЛД50 (щури) від 2,0 г/кг до 2,2 г/кг.[2]Було виявлено, що вона є цитотоксичною і в незначній мірі генотоксичною (виявлено в результаті дослідів на лабораторних тваринах). Відзначається, що пероральне введення призводить до змін у репродуктивній системі й загальному розвитку.[3] Вплив на довкілляЕДТА має настільки широке застосування, що піднімається питання, чи є цей органічний забруднювач стійким. Хоча ЕДТА має багато важливих функцій у різних промислових, фармацевтичних та інших напрямках, екологічна тривалість ЕДТА може викликати серйозні проблеми в навколишньому середовищі. Розпад ЕДТА відбувається повільно. В основному це відбувається абіотично під дією сонячних променів.[4] Найважливішим процесом для усунення ЕДТА з поверхневих вод є прямий фотоліз при довжинах хвиль нижче 400 нм.[5] Багато комплексів ЕДТА (такі як Mg2+ і Ca2+) у природі зустрічаються в надмірній кількості і є стійкими. Дослідження також показують, що ЕДТА негативно впливає на родючість ґрунтів і врожайність сільськогосподарських культур.[6] Оскільки ЕДТА збільшує рухливість важких металів, їх вплив негативно позначається і на стані ґрунтової мікрофлори, що у свою чергу негативно впливає на родючість ґрунту. Зазвичай рослини майже не засвоюють токсичні для них важкі метали, але з огляду на те, що ЕДТА виконує функцію транспортного агента, ці комплекси потрапляють в організм рослини і призводять до порушення процесів у клітинах, а отже впливають на ріст і розвиток рослини в цілому. Зокрема, було виявлено, що в результаті потрапляння надлишкової кількості важких металів у рослину може виникати хлороз, уповільнення ростових процесів, порушення метаболізму і зниження здатності фіксувати молекулярний азот у бобових культур. Важкі метали накопичуються в рослинах, а в подальшому і в сільськогосподарській продукції, впливаючи на її якість.[7] Див. такожПримітки
Література
Посилання
|
||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia