|
กฎของแก๊สอุดมคติ
 กฎของแก๊สอุดมคติ (อังกฤษ: ideal gas law) บ้างก็เรียกว่า สมการแก๊สทั่วไป เป็นสมการของสภาวะ (equation of state) ของแก๊สอุดมคติ (ideal gas) สมมุติและเป็นการประมาณพฤติกรรมของแก๊สที่ดีภายใต้สภาวะต่าง ๆ แม้ยังมีข้อจำกัดอยู่หลายข้อ ถูกกล่าวถึงเป็นครั้งแรกโดย เบอนัว ปอล เอมีล กลาแปรง ในปี ค.ศ. 1834 เป็นการรวมกันของกฏของบอยล์ (Boyle's law), กฎของชาร์ล (Charles's law), กฎของอาโวกาโดร และกฎของแก-ลูว์ซัก (Gay-Lussac's law) ซึ่งเป็นเชิงประจักษ์[1] กฎของแก๊สอุดมคติมักถูกเขียนอยู่ในรูปเชิงประจักษ์: โดย , และ คือ ความดัน, ปริมาตร และอุณหภูมิ (Thermodynamic temperature) คือ จำนวนของสสาร (amount of substance) และ คือ ค่าคงตัวของแก๊สซึ่งมีค่าเท่าเดิมไม่ว่าเป็นแก๊สชนิดใด เราสามารถอนุพัทธ์สมการนี้ได้จากทฤษฎีจลน์ของแก๊สในระดับจุลทรรศน์ดังเช่นที่ได้กระทำแล้ว (โดยอิสระจากกัน) โดย เอากุสต์ เครอนิค (August Krönig) ในปี ค.ศ. 1856[2] และ รูด็อล์ฟ เคลาซีอุส ในปี ค.ศ. 1857[3] สมการ สภาวะ (state function) ของแก๊สปริมาณหนึ่งถูกกำหนดโดยความดัน, ปริมาตร และอุณหภูมิ สมการรูปแบบปัจจุบันแสดงความสัมพันธ์เหล่านี้เป็นสองรูปแบบอย่างง่าย อุณหภูมิในสมการของสภาวะเป็นอุณหภูมิสัมบูรณ์ซึ่งมีหน่วย SI เป็นเคลวิน[4] รูปแบบสามัญรูปแบบที่พบได้บ่อยที่สุด คือ: โดย:
ในหน่วย SI p ถูกวัดเป็นปาสกาล V ถูกวัดเป็นลูกบาศก์เมตร n ถูกวัดเป็นโมล และ T ถูกวัดเป็นเคลวิน (มาตราวัดเคลวินคือมาตราวัดเซลเซียสที่ถูกเลื่อนซึ่งอุณหภูมิที่ต่ำที่สุด 0.00 K = −273.15 °C) R มีค่าเท่ากับ 8.314 J/(K·mol) ≈ 2 cal/(K·mol) หรือ 0.0821 l·atm/(mol·K) รูปแบบโมลาร์เราสามารถระบุปริมาณแก๊สที่มีอยู่ได้จากมวลแทนปริมาณทางเคมีได้ ดังนั้นจึงมีประโยชน์หากเรามีกฎของแก๊สอุดมคติอีกรูปแบบหนึ่ง ปริมาณทางเคมี (n) (หน่วยเป็นโมล) เท่ากับมวลรวมของแก๊ส (m) (หน่วยเป็นกิโลกรัม) หารด้วยมวลโมลาร์ (molar mass) (M) (หน่วยเป็นกิโลกรัมต่อโมล): เมื่อแทน n ด้วย m/M แล้วใส่ความหนาแน่น ρ = m/V ลงไปในสมการ เราจะได้: ให้นิยามค่าคงตัวของแก๊สจำเพาะ Rspecific(r) เป็นอัตราส่วน R/M กฎของแก๊สอุดมคติรูปแบบนี้มีประโยชน์อย่างมากมาก เพราะสามารถเชื่อมโยงความดัน ความหนาแน่น และอุณหภูมิเข้าด้วยกันในสูตรที่เป็นเอกลักษณ์ซึ่งไม่พึ่งพาปริมาณของแก๊สที่เราพิจารณา กฎนี้สามารถเขียนเป็นอีกแบบได้โดยใช้ค่าปริมาตรจำเพาะ v ซึ่งเป็นส่วนกลับของความหนาแน่น: ในการใช้งานทางวิศวกรรมและอุตุนิยมวิทยา ค่าคงตัวของแก๊ส จำเพาะ มักถูกแทนด้วยสัญลักษณ์ R และค่าคงตัวของแก๊ส สากล จะใช้สัญลักษณ์ต่างจากเดิมเป็น หรือ เพื่อแยกแยะทั้งสองค่าจากกัน อย่างไรก็ตาม บริบทและ/หรือหน่วยของค่าคงตัวของแก๊สจะเป็นตัวบอกให้กระจ่างเองว่าสัญลักษณ์นั้นแทนค่าคงตัวของแก๊สแบบจำเพาะหรือสากล[5] กลศาสตร์สถิติในกลศาสตร์สถิติ (statistical mechanics) เราสามารถอนุพัทธ์หาสมการเชิงโมเลกุลได้จาก ในสมการแรก โดย P คือ ความดันสัมบูรณ์ของแก๊ส, n คือ ความหนาแน่นเชิงจำนวนของโมเลกุล (กำหนดเป็นอัตราส่วน n = N/V ซึ่งต่างจากรูปสมการก่อนที่ n เป็น จำนวนโมล), T คือ อุณหภูมิทางอุณหพลศาสตร์ และ kB คือ ค่าคงตัวบ็อลทซ์มันซึ่งแสดงความสัมพันธ์ระหว่างพลังงานและอุณหภูมิ กำหนดว่า: โดย NA คือ ค่าคงตัวอาโวกาโดร จากนี่เราพบว่าแก๊สมวล m มีมวลอนุภาคเฉลี่ยเท่ากับ μ คูณค่าคงตัวมวลอะตอม mu (หรือเท่ากับ μ u) จำนวนของโมเลกุลเท่ากับ: เนื่องจาก ρ = m/V = nμmu เราจึงสามารถเขียนกฎของแก๊สอุดมคติอีกแบบได้เป็น ในหน่วย SI P มีหน่วยเป็นปาสกาล, V มีหน่วยเป็นลูกบาศก์เมตร, T มีหน่วยเป็นเคลวิน และ kB = 1.38×10−23 J⋅K−1 กฎรวมของแก๊สนำกฎของชาร์ล กฎของบอยล์ และกฎของแก-ลูว์ซักมารวมกันแล้วได้ กฎรวมของแก๊ส ซึ่งมีรูปแบบการใช้งานแบบเดียวกับกฎของแก๊สอุดมคติ หากแต่ไม่ระบุจำนวนโมลของแก็สและสมมุติว่าอัตราส่วน ต่อ เป็นค่าคงตัว ():[6] โดย คือ ความดันของแก๊ส, คือ ปริมาตรของแก๊ส, คือ อุณหภูมิสัมบูรณ์ของแก๊ส และ เป็นค่าคงตัว เมื่อเราต้องการเปรียบเทียบสสารเดียวกันภายใต้สภาวะที่ต่างกันสองสภาวะ สามารถเขียนกฎนี้ได้เป็น พลังงานซึ่งสัมพันธ์กับแก๊สตามสมมติฐานจากทฤษฎีจลน์ของแก๊ส เราสามารถสมมุติได้ว่าโมเลกุลของแก๊สอุดมคตินั้นไม่มีแรงดึงดูดระหว่างโมเลกุล หรือพูดอีกแบบคือไม่มีพลังงานศักย์ พลังงานทั้งหมดที่แก๊สมีจึงเป็นเพียงพลังงานจลน์ของแก๊สแต่ละโมเลกุล คือสูตรสำหรับพลังงานจลน์ของแก็สอะตอมเดี่ยวจำนวน n โมลซึ่งมีองศาเสรี 3 องศา; x, y, z
การประยุกต์ใช้ในกระบวนการทางอุณหพลศาสตร์ในตารางด้านล่าง สมการของแก๊สอุดมคติถูกทำให้ง่ายลงสำหรับการนำไปใช้กับกระบวนการเฉพาะต่าง ๆ และทำให้สามารถแก้ปัญหาด้วยวิธีเชิงตัวเลขง่ายยิ่งขึ้น กระบวนการทางอุณหพลศาสตร์ (thermodynamic process) มีนิยามเป็นระบบซึ่งเคลื่อนจากสภาวะที่ 1 ไปสู่สภาวะที่ 2 โดยเลขซึ่งบอกสภาวะแทนด้วยตัวห้อย โดยกระบวนการพื้นฐานถูกแบ่งออกเป็นแต่ละชนิดตามคุณสมบัติของแก๊สที่ถูกตรึงให้คงที่ไว้ตลอดกระบวนการ (P, V, T, S หรือ H) ดังที่แสดงในสดมภ์แรกของตาราง จะต้องมีการระบุ (ไม่ว่าโดยตรงหรือโดยอ้อม) หนึ่งในอัตราส่วนระหว่างคุณสมบัติ (ซึ่งมีการจัดรายการไว้ในสดมภ์ที่ชื่อว่า "อัตราส่วนที่รู้จัก") เพื่อระบุขอบเขตของกระบวนการทางอุณหพลศาสตร์ชนิดหนึ่ง และคุณสมบัติซึ่งปรากฎอยู่ในอัตราส่วนจะต้องต่างจากคุณสมบัติที่คงที่ (ไม่เช่นนั้นแล้วอัตราส่วนก็จะเป็นเอกภาพ และเราจะไม่มีข้อมูลมากพอที่จะสามารถทำให้สมการง่ายลงได้) ส่วนในสามสดมภ์สุดท้าย เราสามารถหาค่าของคุณสมบัติ (p, V หรือ T) ของสภาวะที่ 2 ได้จากการนำค่าของคุณสมบัติเหล่านั้นในสภาวะที่ 1 มาคำนวณในสมการซึ่งถูกจัดไว้อยู่ในรายการ
^ a. ในกระบวนการเอนโทรปีคงที่ เอนโทรปี (S) ของระบบมีค่าคงที่ และ p1 V1γ = p2 V2γ ภายใต้เงื่อนไขนี้ โดย γ คืออัตราส่วนความร้อนจำเพาะ (heat capacity ratio) ซึ่งในแก๊สสมบูรณ์แบบทางพลังงาน (calorically perfect gas) มีค่าคงที่ ค่าของ γ ที่ปกติใช้กับแก๊สสองอะตอม (diatomic gas) เช่นแก๊สไนโตรเจน (N2) และแก๊สออกซิเจน (O2) (และอากาศ ซึ่งประกอบไปด้วยแก๊สสองอะตอม 99%) มีค่าเท่ากับ 1.4 ส่วนค่าที่ใช้กับแก๊สอะตอมเดี่ยวเช่นแก๊สมีสกุล ฮีเลียม (He) และอาร์กอน (Ar) มีค่าเท่ากับ 1.6 ค่า γ ในเครื่องยนต์เผาไหม้ภายในมีค่าระหว่าง 1.35 และ 1.15 ซึ่งขึ้นกับองค์ประกอบของแก๊สและอุณหภูมิ ^ b. ในกระบวนการเอนทาลปีคงที่ เอนทาลปี (H) ของระบบมีค่าคงที่ ในบริบทของการขยายตัวอิสระ (free expansion) ของแก๊สอุดมคติ อุณหภูมิมีค่าคงที่และโมเลกุลไม่มีปฏิกิริยาระหว่างกัน กลับกันในแก๊สจริงนั้น โมเลกุลมีปฏิกิริยาระหว่างกันผ่านการดึงดูดหรือผลักไสขึ้นกับความดันและอุณหภูมิ และสามารถร้อนหรือเย็นลงได้ นี่เป็นที่รู้จักว่าปรากฏการณ์จูล-ทอมสัน (Joule-Thomson effect) สำหรับการอ้างอิง สัมประสิทธิ์จูล-ทอมสัน μJT สำหรับอากาศที่อุณหภูมิห้อง ณ ระดับน้ำทะเลเท่ากับ 0.22 °C/bar[7] การเบี่ยงเบนจากพฤติกรรมในอุดมคติของแก๊สจริงสมการของสภาวะที่กำหนดมานี้ (PV=nRT) สามารถนำไปใช้กับแก๊สอุดมคติหรือนำไปใช้เพื่อประมาณพฤติกรรมของแก๊สจริงซึ่งมีความคล้ายกับแก๊สอุดมคติพอสมควรได้เท่านั้น ความจริงแล้ว สมการของสภาวะสมการนี้มีรูปแบบอยู่หลายรูปแบบ กฎของแก๊สอุดมคติไม่สนใจขนาดโมเลกุล (molecular size) และแรงดึงดูดระหว่างโมเลกุล (inter molecular attraction) จึงสามารถนำไปใช้ได้อย่างแม่นยำที่สุดกับแก๊สอะตอมเดี่ยว (monatomic) ที่อุณหภูมิสูงและความดันต่ำ ยิ่งความหนาแน่นลดลงหรือยิ่งปริมาตรสูงขึ้นและความดันต่ำลง ความสำคัญของขนาดโมเลกุลก็ยิ่งลดลงเช่นเดียวกัน เพราะระยะทางความห่างระหว่างโมเลกุลโดยเฉลี่ยจะมีค่าสูงกว่าขนาดของโมเลกุลอย่างมาก และยิ่งพลังงานจลน์ทางความร้อนสูงขึ้นหรือยิ่งอุณหภูมิสูงขึ้น ความสำคัญของแรงดึงดูดระหว่างโมเลกุลก็ยิ่งลดลงโดยสัมพัทธ์ สมการของสภาวะที่มีรายละเอียดสูงกว่า เช่น สมการวานเดอร์วาลส์ (van der Waals equation) จะมีการแก้ไขการเบี่ยงเบนจากอุดมคติซึ่งเกิดจากขนาดของโมเลกุลและแรงระหว่างโมเลกุล สมบัติตกค้าง (residual property (physics)) มีนิยามเป็นความแตกต่างระหว่างสมบัติของแก๊สจริง (real gas) และสมบัติของแก๊สอุดมคติภายใต้ความดัน อุณหภูมิ และองค์ประกอบเดียวกัน การอนุพัทธ์เชิงประจักษ์กฎเชิงประจักษ์ซึ่งนำไปสู่การอนุพัทธ์กฎของแก๊สอุดมคติถูกค้นพบผ่านการทดลอง โดยใช้การเปลี่ยนตัวแปรสภาวะของแก๊สเพียงสองอย่างและตรึงตัวแปรที่เหลือให้คงที่ กฎของแก๊สทั้งหมดที่สามารถค้นพบได้ด้วยการจัดเตรียมการทดลองแบบนี้มี:
 โดย "P" แทนความดัน, "V" แทนปริมาตร, "N" แทนจำนวนอนุภาคของแก๊ส และ "T" แทนอุณหภูมิ โดย ไม่ใช่ค่าคงตัวของจริง แต่เป็นค่าคงตัวในบริบทนี้ เพราะแต่ละสมการต้องการตัวแปรที่ระบุไว้อย่างชัดเจนให้เปลี่ยนเท่านั้น เราไม่จำเป็นต้องรู้กฎของแก๊สทั้งหกสูตรเพื่ออนุพัทธ์กฎของแก๊สอุดมคติ เพียงรู้แค่สามกฎเราจะสามารถอนุพัทธ์กฎที่เหลือได้ และเราต้องรู้แค่สี่กฎเพื่อที่จะสามารถอนุพัทธ์กฎของแก๊สอุดมคติได้ ในเมื่อสูตรแต่ละสูตรจะเป็นจริงก็ต่อเมื่อตัวแปรสภาวะที่อยู่ในสูตรเท่านั้นที่เปลี่ยนแปลงในขณะที่ตัวแปรที่เหลือมีค่าคงที่ เราไม่สามารถใช้พีชคณิตเพื่อรวมสูตรโดยตรงได้ เราต้องพิจารณาถึงการทดลองของบอยล์ว่าเขาทำการทดลองโดยตรึงค่า N และ T ไว้ให้คงที่ เมื่อคำนึงถึงสิ่งนี้ เราจำเป็นต้องจินตนาการว่าแก๊สเปลี่ยนสถาวะผ่านกระบวนการทีละกระบวนการเพื่อให้อนุพัทธ์ได้อย่างถูกต้อง การอนุพัทธ์ซึ่งใช้สูตรสี่สูตรเป็นดังนี้: ในตอนแรก แก๊สมีพารามิเตอร์ ให้เริ่มเปลี่ยนเฉพาะความดันและปริมาตรตามกฎของบอยล์ แล้ว:
จากนั้นใช้สมการที่ (5) เพื่อเปลี่ยนจำนวนอนุภาคและอุณหภูมิของแก๊ส
จากนั้นใช้สมการที่ (6) เพื่อเปลี่ยนความดันและจำนวนอนุภาค
จากนั้นใช้กฎของชาร์ลเพื่อเปลี่ยนปริมาตรและอุณหภูมิของแก๊ส
จากนั้นใช้พีชคณิตรวมสมการที่ (7), (8), (9) และ (10) จะได้:
ในทางเดียวกัน ในเมื่อ โดย "n" คือจำนวนโมลของแก๊ส และ "R" คือค่าคงตัวของแก๊สสากล เราจะได้:
หากเราทำการทดลองและพบสูตรเพียงสามสูตรจากทั้งหกสูตร เราสามารถอนุพัทธ์สูตรที่เหลือได้ผ่านวิธีการที่เขียนอธิบายไว้ด้านบน แต่เพราะแต่ละสมการมีตัวแปรแค่สองตัวเท่านั้น เราไม่สามารถใช้สูตรสามสูตรสูตรใดก็ได้ เช่นหากเรามีสมการที่ (1), (2) และ (4) เราไม่สามารถอนุพัทธ์สมการอื่นได้ เพราะการรวมสมการสองสมการใด ๆ จะให้ผลเป็นสมการอันที่สามที่เราเลือกมา แต่หากเรามีสมการที่ (1), (2) และ (3) เราจะสามารถหาสมการทั้งหกสมการได้โดยไม่จำเป็นต้องทำการทดลองอื่นอีก เพราะการรวมสมการที่ (1) และ (2) จะให้ผลเป็นสมการที่ (4), (1) และ (3) จะได้สมการที่ (6), (4) และ (6) หรือ (2) และ (3) จะได้สมการที่ (5) ตามที่มีการอธิบายให้เห็นเป็นรูปภาพที่แสดงความสัมพันธ์ดังต่อไปนี้: 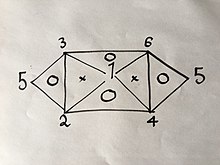 โดยเลขแต่ละตัวแทนกฎของแก๊สตามที่เรียงเลขที่ไว้ด้านบน หากเราทำตามวิธีการด้านบนกับกฎสองกฎจากเลขที่อยู่บนมุมสองมุมจากทั้งสามมุมของสามเหลี่ยมที่มีเลข "O" อยู่ภายใน เราจะได้ผลออกมาเป็นกฎตามเลขที่ปรากฏบนมุมที่สาม ตัวอย่างเช่น: เปลี่ยนแค่ความดันและปริมาตรก่อน: (1´) จากนั้นเปลี่ยนแค่ปริมาตรและอุณหภูมิ: (2´) และในเมื่อเราสามารถให้ แทนค่าใดก็ได้ เราจะให้ และสมการที่ (2´) จะกลายเป็น: (3´) การรวมสมการที่ (1´) และ (3´) จะได้ผลเป็น ซึ่งก็คือสมการที่ (4) โดยเราไม่เคยรู้จักสมการนี้มาก่อนจนกระทั่งเราได้อนุพัทธ์มันออกมา เชิงทฤษฎีทฤษฎีจลน์เราสามารถอนุพัทธ์กฎของแก๊สอุดมคติได้จากหลักการแรก (first principle) โดยใช้ทฤษฎีจลน์ของแก๊สซึ่งมีสมมติฐานที่ทำให้ง่ายลงหลายข้อ เช่นการสมมติว่าโมเลกุลหรืออะตอมของแก๊สเป็นมวลจุดหรือมีมวลแต่มีปริมาตรที่น้อยจนไม่มีนัยสำคัญ และชนกับผนังของภาชนะและชนกันอย่างยืดหยุ่นเท่านั้น โดยอนุรักษ์โมเมนตัมเชิงเส้นและพลังงานจลน์ สมมติฐานพื้นฐานของทฤษฎีจลน์ของแก๊สบอกเป็นนัยว่า จากนั้น ตามการกระจายตัวแบบแมกซ์เวลล์-บ็อลทซ์มัน (Maxwell-Boltzmann distribution) โมเลกุลส่วนหนึ่งที่มีอัตราเร็วอยู่ในช่วง ถึง เท่ากับ โดย และ คือค่าคงตัวบ็อลทซ์มัน ค่าเฉลี่ยกำลังสองหาได้จากการคำนวณดังนี้ ด้วยสูตรของปริพันธ์ เราจึงได้ และจากนั้น เราก็จะได้กฎของแก๊สอุดมคติ: กลศาสตร์สถิติให้ q = (qx, qy, qz) และ p = (px, py, pz) แสดงถึงเวกเตอร์ตำแหน่งและเวกเตอร์โมเมนตัมของอนุภาคแก๊สอุดมคติตามลำดับ ให้ F แสดงถึงแรงสุทธิที่กระทำบนอนุภาคนั้น แล้วพลังงานจลน์เฉลี่ยกับเวลาของอนุภาคเท่ากับ: โดยสมการแรกคือกฎข้อที่สองของนิวตัน บรรทัดที่สองใช้สมการของแฮมิลตันและทฤษฎีบทการแบ่งเท่า (equipartition theorem) ผลบวกรวมทั้งระบบของอนุภาค N อนุภาคเท่ากับ ตามกฎข้อที่สามของนิวตันและสมมติฐานของแก๊สอุดมคติ แรงสุทธิที่กระทำบนระบบคือแรงที่ผนังของภาชนะกระทำ และแรงนี้ถูกกำหนดโดยความดัน P ของแก๊ส ดังนั้น โดย dS คือองค์ประกอบพื้นที่ขนาดกณิกนันต์รอบผนังของภาชนะ ในเมื่อไดเวอร์เจนซ์ (divergence) หรือความลู่ออกของเวกเตอร์ตำแหน่ง q เท่ากับ ทฤษฎีบทไดเวอร์เจนซ์ (divergence theorem) บอกเป็นนัยว่า โดย dV คือปริมาตรขนาดกณิกนันต์ภายในภาชนะ และ V คือปริมาตรทั้งหมดของภาชนะ เมื่อนำสมการทั้งหมดมารวมกัน จะได้ผลเป็น ซึ่งแสดงถึงกฎของแก๊สอุดมคติของอนุภาค N อนุภาค: โดย n = N/NA คือจำนวนโมลของแก๊ส และ R = NAkB คือค่าคงตัวของแก๊ส ในมิติอื่นความดันของแก๊สอุดมคติในระบบ d มิติเท่ากับ:[8] โดย คือปริมาตรของขอบเขต d มิติที่มีแก๊สอยู่ สังเกตว่ามิติ (หรือหน่วย) ของความดันเปลี่ยนตามมิติที่เปลี่ยนไป ดูเพิ่ม
อ้างอิง
แหล่งข้อมูลอื่น
|
Portal di Ensiklopedia Dunia

















































































