|
Neopentán
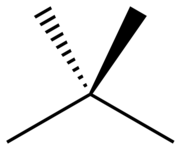
Neopentán, systematicky 2,2-dimetylpropán, je vetvený alkán s piatimi atómami uhlíka. Neopentán je pri izbovej teplote a tlaku horľavý plyn, ktorý sa pri nízkych teplotách alebo vysokých tlakoch premieňa na prchavú kvapalinu. Neopentán je najjednoduchší alkán s kvartérnym uhlíkovým atómom a má achirálnu tetraédrickú symetriu. Je to jeden z troch štruktúrnych izomérov alkánu so vzorcom C5H12, ostatné dva sú n-pentán a izopentán.[1] Je to jediný z týchto troch izomérov, ktorý je pri štandardných podmienkach plynný, ostatné sú kvapaliny. NázovNázov neopentán sa nachádzal v odporúčaniach IUPAC z roku 1993,[2][3] ale od roku 2013 už ho IUPAC neodporúča používať. Preferovaným názvom je 2,2-dimetylpropán, i keď použitie polohy substituentov nie je nutné, pretože je to jediný možný „dimetylpropán“.  Substituent neopentyl, označovaný ako Np,[chýba zdroj] má vzorec Me3C–CH2–.[4] Nachádza sa napríklad v neopentylalkohole (Me3CCH2OH alebo NpOH). Skratka Np sa používa i ako symbol pre neptúnium, takže použitie Np pre neopentyl môže viesť k nedorozumeniam. Niekedy sa používa i starší názov, tetrametylmetán, hlavne v starších zdrojoch.[5][6] Fyzikálne vlastnostiTeplota varu a topeniaTeplota varu neopentánu je 9,5 °C, výrazne nižšia než teplota varu izopentánu (27,7 °C) alebo n-pentánu (36,0 °C). Neopentán je teda pri štandardných podmienkach plyn, zatiaľ čo jeho izoméry sú kvapaliny. Teplota topenia neopentánu (-16,6 °C) je však výrazne vyššia než teplota topenia izopentánu (-159,9 °C) a n-pentánu (-129,8 °C). Tieto anomálie sa prisudzujú lepšiemu skladaniu molekúl v pevnom stave vďaka tetraédrickému usporiadaniu molekuly neopentánu, ale toto vysvetlenie bolo spochybnené kvôli jeho nízkej hustote oproti ostatným izomérom. Okrem toho je zlučovacia entalpia neopentánu nižšia než zlučovacie entalpie n-pentánu a izopentánu, čo naznačuje vyššiu teplotu topenia kvôli entropickému efektu, ktorý vzniká kvôli vyššej symetrii molekuly. Zlučovacia entropia neopentánu je skutočne asi štyrikrát nižšia ako u n-pentánu a izopentánu.[7] 1H NMR spektrumKeďže neopentán je veľmi symetrický, všetky vodíkové atómy sú chemicky ekvivalentné, čo znamená, že v 1H NMR spektre vykazuje iba jeden pík, pri chemickom posune δ = 0,902, pri meraní v chloride uhličitom.[8] V tom sa podobá svojmu silánovému analógu, tetrametylsilánu, ktorého chemický posun je po dohode rovný nule. Symetriu neopentánu možno znížiť, ak sa niektoré atómy vodíku nahradia za deutérium. Ak má každá metylová skupina rôzny počet substituovaných atómov (0, 1, 2 a 3), vzniká chirálna molekula. Chiralita je v tomto prípade spôsobená výhradne rozložením hmotnosti jadier, aj keď rozloženie elektrónovej hustoty je prakticky achirálne.[9] Referencie
ZdrojTento článok je čiastočný alebo úplný preklad článku Neopentane na anglickej Wikipédii. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia