|
Brómtymolová modrá
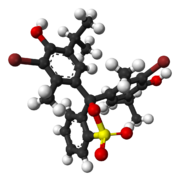
Brómtymolová modrá (tiež známa ako brómtymolsulfónftaleín) je pH indikátor. Väčšinou sa používa v aplikáciách, ktoré vyžadujú meranie látok, ktoré by mali relatívne neutrálne pH (okolo 7). Bežne sa používa na meranie prítomnosti kyseliny uhličitej v kvapaline. Zvyčajne sa predáva v pevnej forme ako sodná soľ indikátora kyseliny. Štruktúra a vlastnosti
Brómtymolová modrá pôsobí v roztoku ako slabá kyselina. Môže teda byť v protónovanej alebo deprotonovanej forme, pričom sa javí ako žltá alebo modrá. Sama o sebe je žiarivo akvamarínová a v neutrálnom roztoku zeleno-modrá. Deprotonácia neutrálnej formy vedie k vysoko konjugovanej štruktúre, ktorá zodpovedá za rozdiel vo farbe. Medziprodukt deprotonačného mechanizmu je zodpovedný za zelenkastú farbu v neutrálnom roztoku.[1] Protónovaná forma brómtymolovej modrej má maximálnu absorpciu pri 427 nm, čím prepúšťa žlté svetlo v kyslých roztokoch, zatiaľ čo deprotonizovaná forma má maximálnu absorpciu pri 602 nm, čím prepúšťa modré svetlo v zásaditejších roztokoch.[2] Naproti tomu vysoko kyslá brómtymolová modrá má purpurovú farbu. Všeobecný uhlíkový skelet brómtymolovej modrej je spoločný pre mnohé indikátory vrátane chlórfenolovej červenej, tymolovej modrej a brómkrezolovej zelene.[1] Prítomnosť jednej miernej skupiny priťahujúcej elektróny (atóm brómu) a dvoch stredne silných donorových skupín (alkylové substituenty) sú zodpovedné za aktívny indikačný rozsah brómtymolovej modrej od pH 6,0 do 7,6. Zatiaľ čo konjugácia je zodpovedná za dĺžku a povahu rozsahu zmeny farby, tieto skupiny substituentov sú v konečnom dôsledku zodpovedné za aktívny rozsah indikátora.[1]  Brómtymolová modrá je ťažko rozpustná v oleji, ale je rozpustná vo vode, éteri a vodných roztokoch zásad. Je menej rozpustný v nepolárnych rozpúšťadlách, ako je benzén, toluén a xylén, a prakticky nerozpustná v petroléteri.[4] Syntéza a prípravaBrómtymolová modrá sa syntetizuje pridaním elementárneho brómu k tymolovej modrej v roztoku v ľadovej kyseline octovej.[5] Na prípravu roztoku na použitie ako indikátor pH sa rozpustí 10 mg v 8 ml N/50 (známy ako 0,02 Normál) NaOH a zriedi sa vodou na 250 ml. Na prípravu roztoku na použitie ako indikátor pri objemovej práci sa rozpustí 10 mg na 100 ml, 50 % (v/v) etanolu.[4] Použitie Brómtymolová modrá sa môže použiť na pozorovanie fotosyntetických aktivít alebo ako indikátor dýchania (s pridaním oxidu uhličitého zožltne).[6][7] Bežná demonštrácia vlastností indikátora pH brómtymolovej modrej zahŕňa výdych cez hadičku do neutrálneho roztoku. Keď sa oxid uhličitý absorbuje z dychu do roztoku, tvorí sa kyselina uhličitá a mení farbu roztoku zo zelenej na žltú. Brómtymolová modrá sa teda bežne používa na hodinách prírodných vied, aby sa demonštrovalo, že čím viac sa svaly používajú, tým väčší je výstup oxidu uhličitého. Brómtymolová modrá sa použila v spojení s fenolovou červenou na monitorovanie aktivity enzýmu hubovej asparaginázy, pričom fenolová červeň sa zmenila na ružovú a brómtymolová modrá sa zmenila na modrú, čo signalizuje zvýšenie pH, a tým aj enzýmovú aktivitu.[8] Nedávna štúdia však naznačuje, že metylová červeň je užitočnejšia pri určovaní aktivity v dôsledku jasne žltého kruhu vytvoreného v zóne enzýmovej aktivity.[9] Môže sa použiť aj v laboratóriu ako farbivo na biologické sklíčko. Niekedy sa používa na stanovenie bunkových stien alebo jadier pod mikroskopom. Bromotymolová modrá sa používa v pôrodníctve na detekciu predčasného pretrhnutia membrán.[10] Plodová voda má zvyčajne pH > 7,2, bromotymol preto pri kontakte s tekutinou unikajúcou z amniónu zmodrie. Keďže vaginálne pH je normálne kyslé, modrá farba indikuje prítomnosť plodovej vody. Test môže byť falošne pozitívny v prítomnosti iných alkalických látok, ako je krv alebo sperma, alebo v prítomnosti bakteriálnej vaginózy. Pozri ajReferencie
Externé odkazyZdrojTento článok je čiastočný alebo úplný preklad článku Bromothymol blue na anglickej Wikipédii. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia